 产业资讯
产业资讯
 研发客
研发客  2021-12-08
2021-12-08
 3685
3685
根据日本厚生劳动省医药品医疗器械综合机构(PMDA)发布的《2020年度药品审评报告》,去年,PMDA及时、良好地开展了药品、医疗器械的审批审评工作。
肿瘤药是日本研发主流
首先来看审批时限的完成情况。在申请人的配合下,PMDA 2020年几乎实现了对药品、医疗器械、再生医疗等产品的所有审批目标。去年药品总审批时间的既定目标是9个月,实际上80%批准的药品完成了这一目标。非先驱审查(即非优先审批)的既定目标为12个月,实际花了11.9个月,达标80%;先驱审查(即优先审批)的目标是6个月,实际完成时间在4.5~6个月以内。
PMDA同时还汇总了2011~2020年欧洲、美国、日本、加拿大、瑞典和澳大利亚药监机构审批时限的平均值。从下图可见,日本经历了一段药物上市滞后期,为此,PMDA进行了一系列的创新改革,之后,PMDA是六国当中审批新药速度最快的监管机构之一。

来源|Centre for Innovation in Regulatory Science(CIRS),2021,R&D Briefing
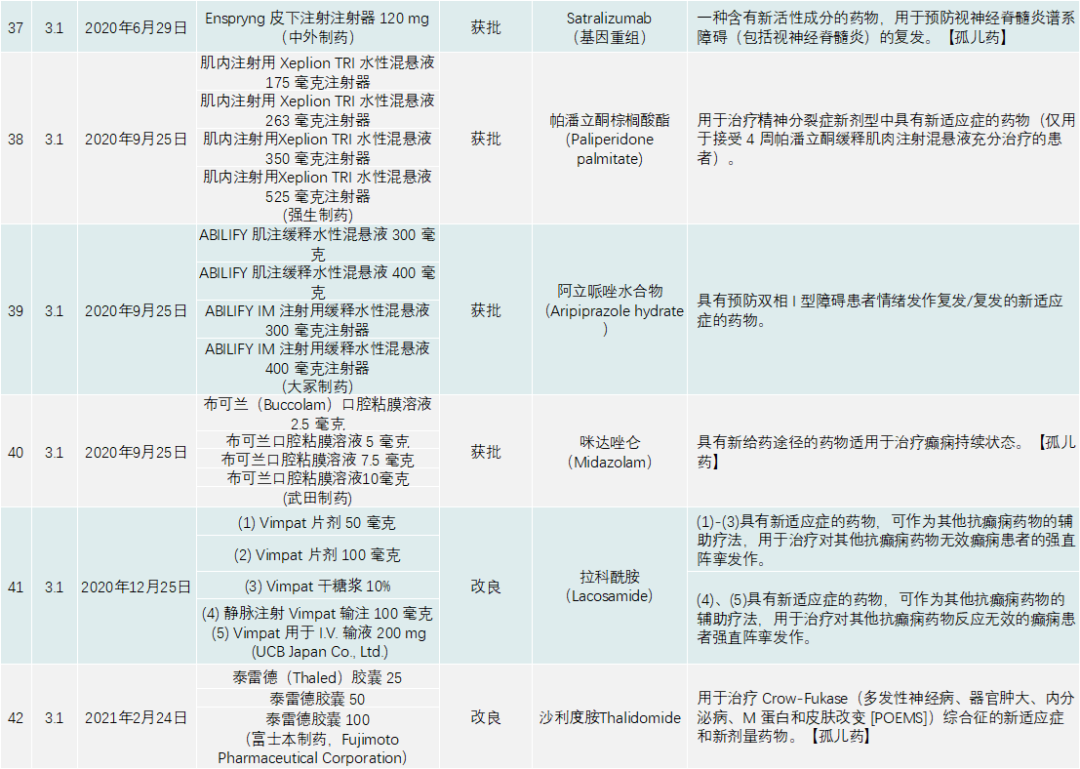
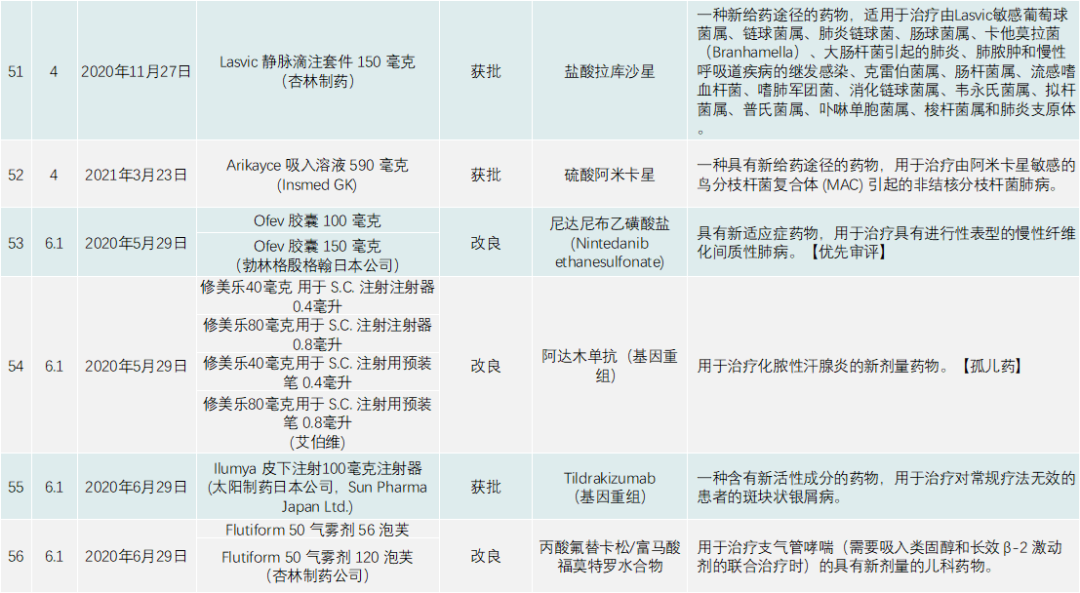
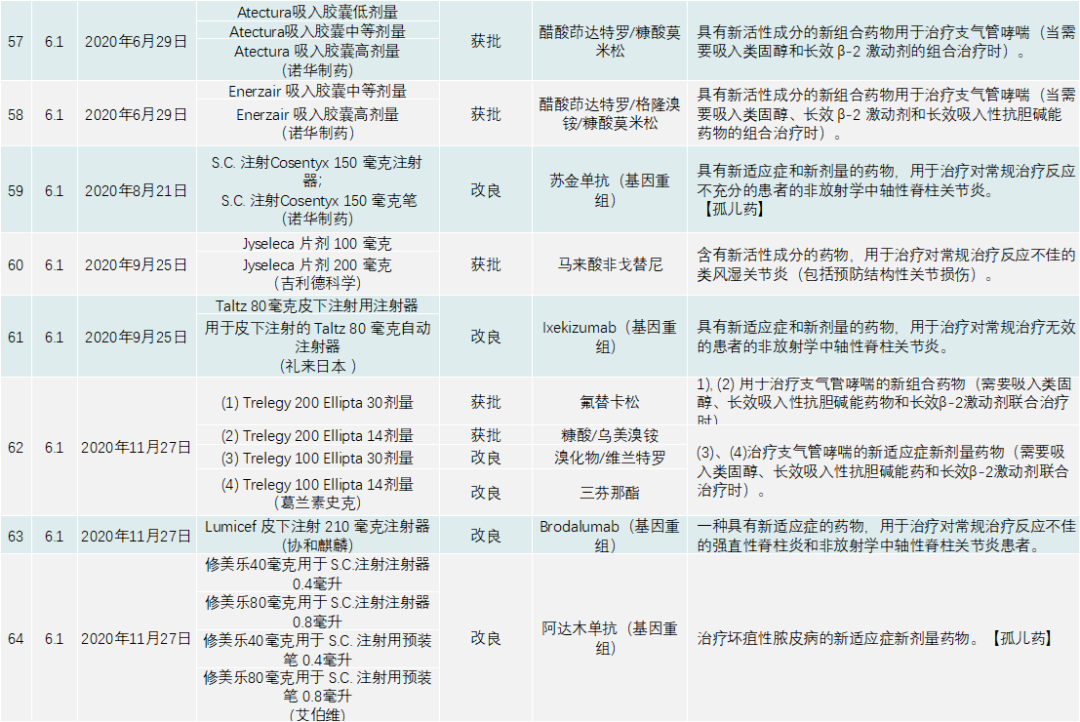
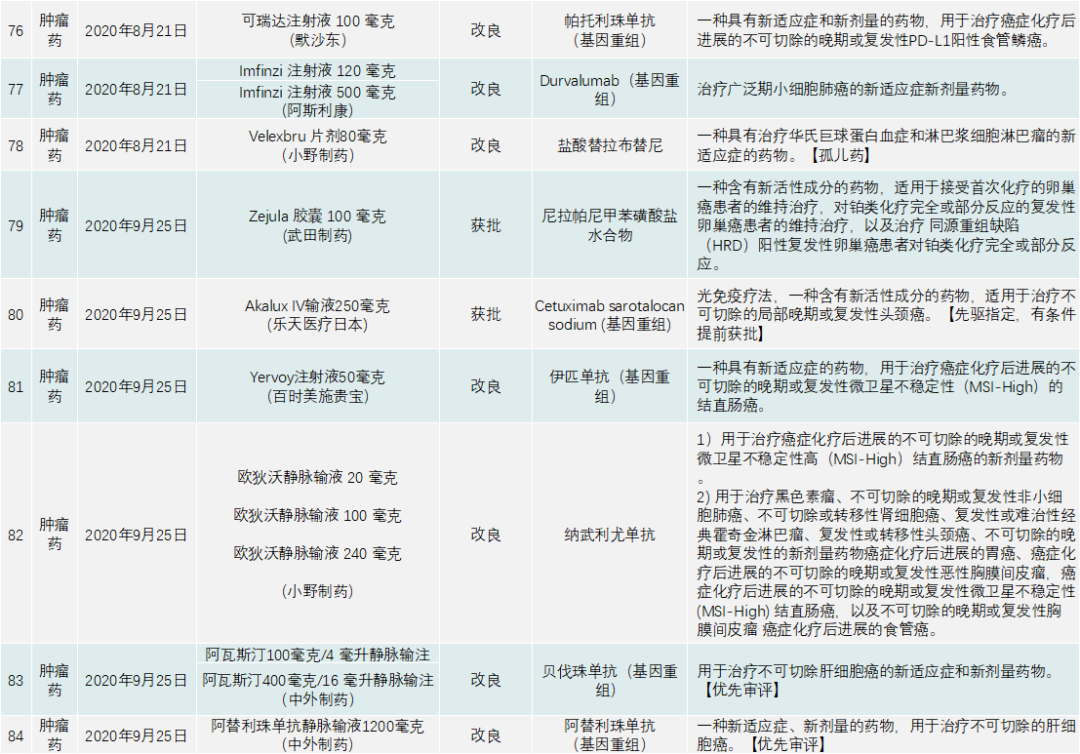
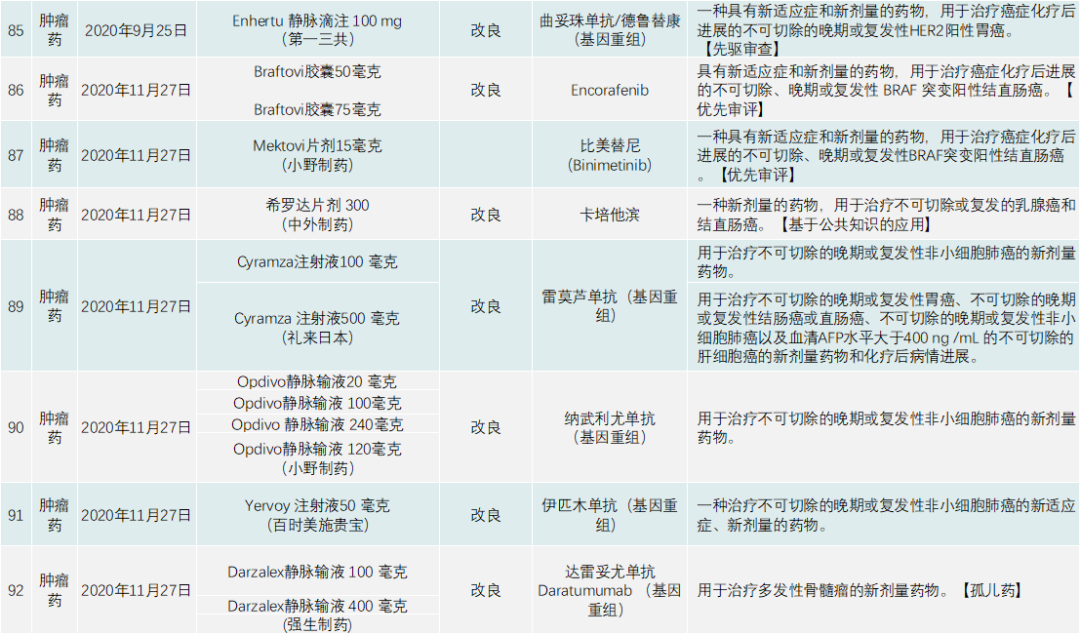
PMDA在 2020年审批的新药共有123个,包括新分子实体、新剂型、新适应症,见下表:

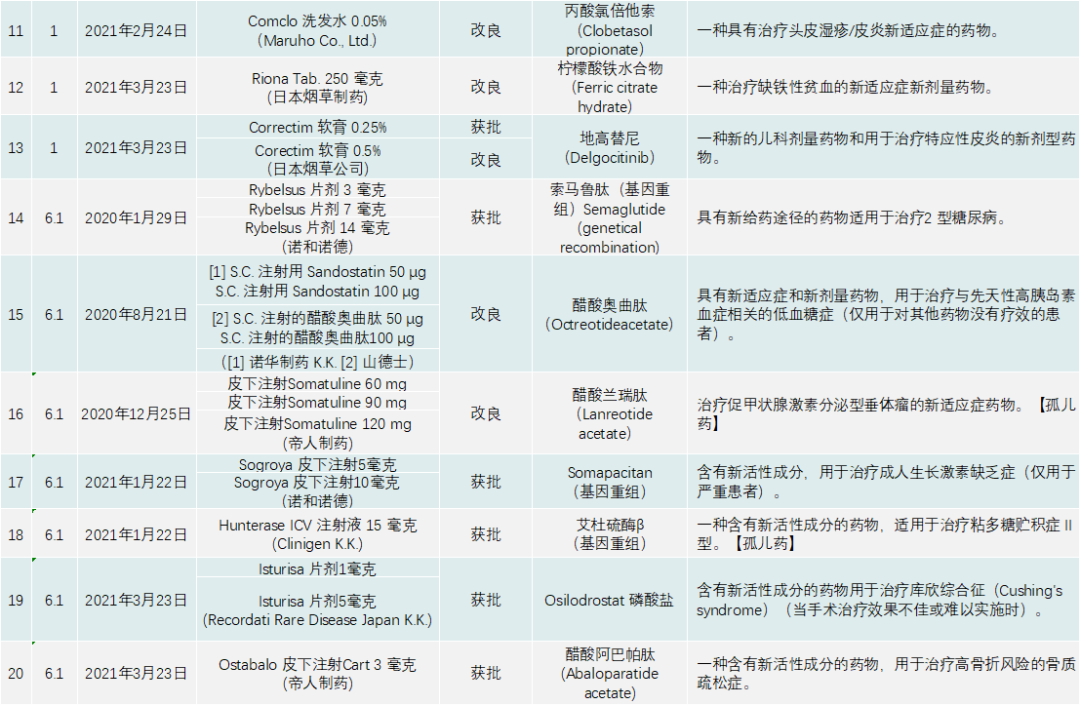



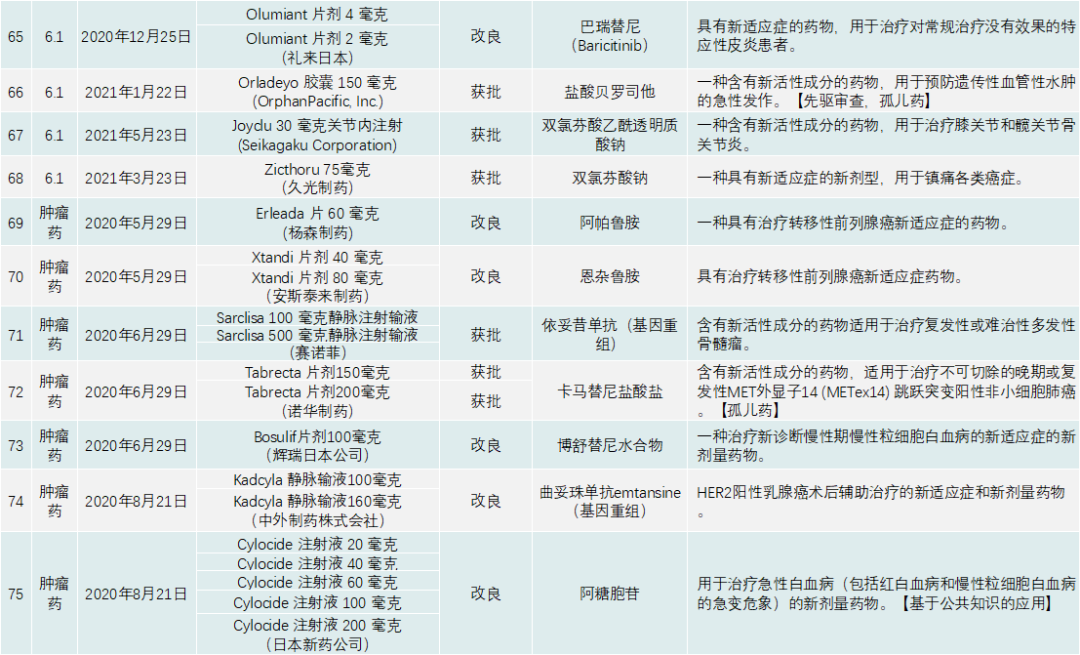

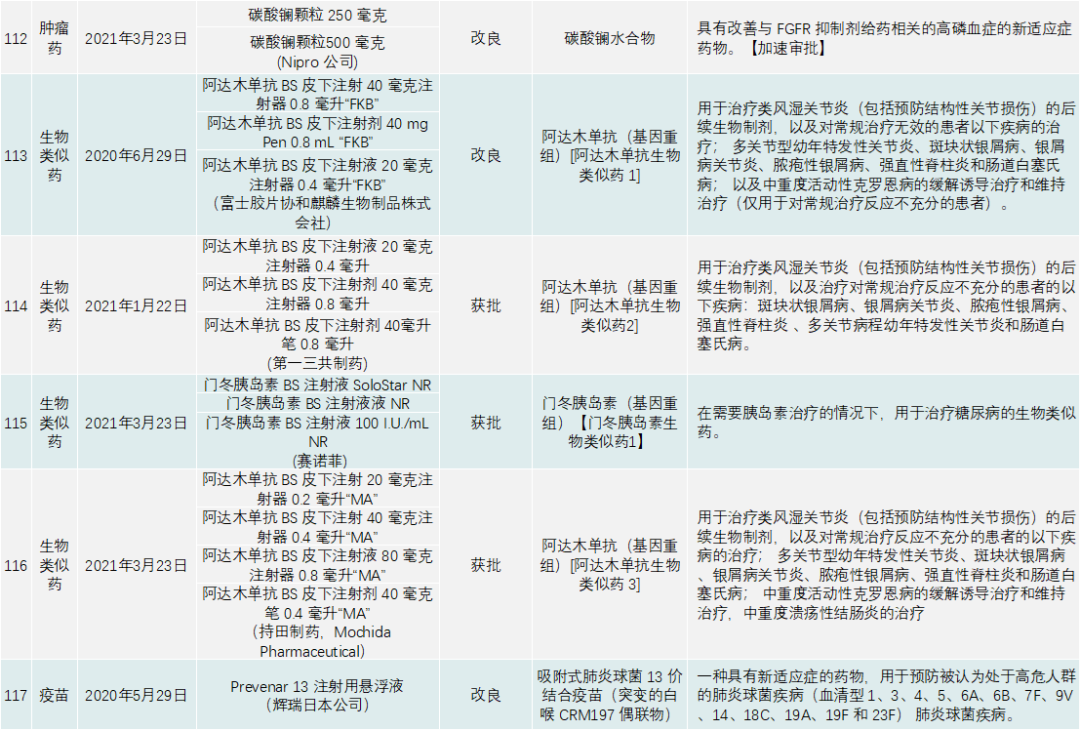

日本的处方药分类跟我国和美国不太一样,该国药监局是按照适应症分类,显示出PMDA和药厂并不追求药物分子的结构创新,而是以临床、医学及患者需求为导向,以解决某种疾病问题为出发点研发药物。日本药品一共分有六大类,见表2。
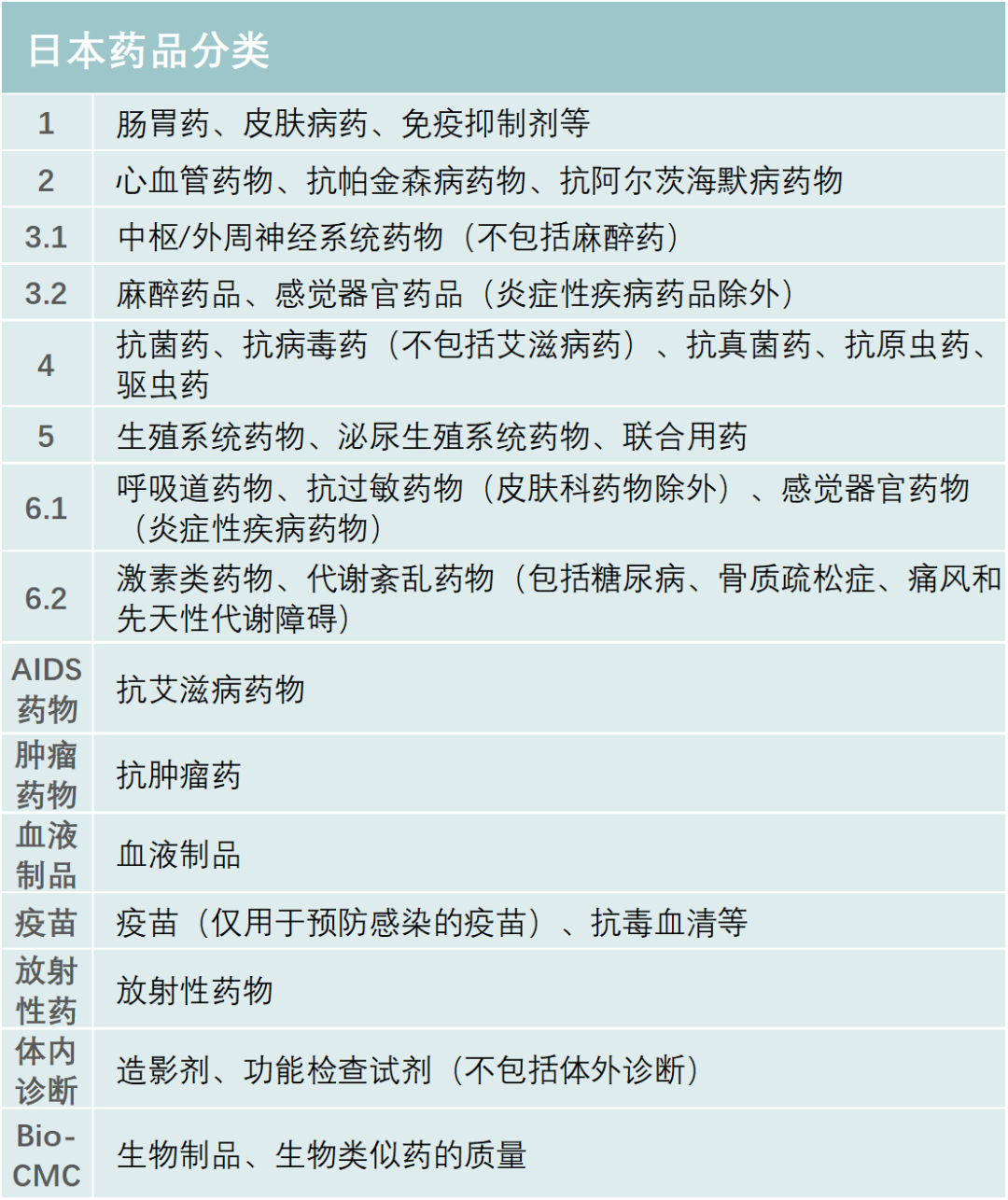
除了与新冠疫情相关的产品,PMDA批准的新药类别是1类药有13个,2类药8个,3.1类药11个,3.2类药3个,4类药4个,5类药4个,6.1类药16个,6.2类药8个。与中国一样,日本获批的肿瘤药最多,共有44个;此外,生物类似药有4个,疫苗4个,血液制品3个,放射性产品有1个。
首先来看肿瘤药,日本不乏具有创新性又针对本国特有癌种的治疗药。44个肿瘤产品中,包括新剂型和新适应症在内,前5大适应症为非小细胞肺癌,共有5个新药获批,治疗白血病的药物有5个,治疗淋巴瘤的药物有5个,治疗结直肠癌的药物有5个,治疗肝癌的药物有3个。
其他还有乳腺癌、胃癌、胰腺癌、胆道癌、尿路上皮癌等都有相应的新药上市。参与肿瘤药角逐的厂家中,不乏武田、小野制药、安斯泰来、卫材制药、强生、阿斯利康、默沙东、拜耳等。
其他适应症方面,肠胃药、皮肤病药、免疫抑制剂、呼吸道药物、抗过敏药物(皮肤科药物除外)、炎症性疾病药物及中枢/外周神经系统药物(不包括麻醉药)在日本研发较为活跃,“日本药厂研发药物不太会受到投资的驱动,而以患者所需开发药物。”有相关相熟日本行业的人士说。
近年来,不少国内药厂纷纷到日本授权引进(license in)药物。例如,专注于免疫相关疾病领域的创响生物今年从日本Kissei引进改善原发免疫性血小板减少症药物;去年3月,烨辉医药获得日本Carna Biosciences新一代非共价结合可逆的BTK抑制剂BN10,该公司的投资基金之一就是日本三井株式会社。
有分析认为,中国企业在欧美国家license in比较多,以后可多关注日本品种,因为日本与中国的人种差异小,疾病谱相似,遇到合适的品种可及时引入。此外,日本是全民医疗保险,创新药价格根据临床价值会给予比现有药品更高的价格,因此,如果中国企业将目标定位在日本市场,或许会有很好的回报。
创响生物首席医学官兼高级运营副总裁项安波博士曾在日本求学工作将近20年,熟悉日本医药市场。她告诉研发客,日本制药公司对外合作比较谨慎,所以深入细致和坦诚的沟通非常重要。“他们很认真,流程会比较慢,但答应的时间和事情会很遵守,因此,在合作中,中国国内公司给出具体的时间和要求有助于项目的引进和进展。”项安波博士说。
烨辉医药创始人兼CEO华烨博士认为,日本是相对封闭保守的市场,日方企业并不会因为中国企业出价高而出让产品权限。引进日本创新药物首先要赢得日本制药公司的信赖,需要依靠自身研发实力和信誉,同时中国公司要有足够的经验和资质给出清晰的临床试验方案,最好还有日本大企业背书才有可能达成协议。
先驱审查制度等加速新药商业化
PMDA有先驱审查、有条件批准等加快流程。举例而言,有条件批准制度是PMDA认定那些因患者人数少等原因,难以进行验证性临床试验,且患者需长期使用、治疗严重且缺乏有效治疗手段疾病的药物尽早上市的快速通道之一。被认定的企业在一定样本量患者设计的临床试验中,研究结果达到既定的临床终点,药品具有有效性和安全性。有条件审批上市后,申请人必须对上市后产品再次确认开展更大规模病例数的临床研究。
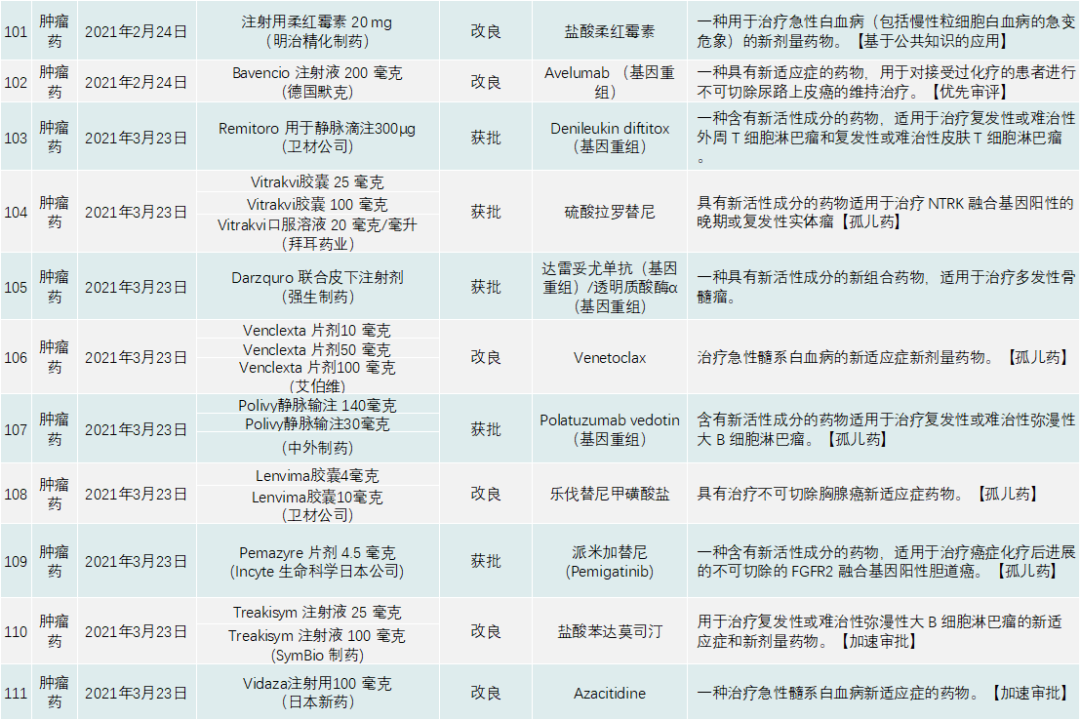
先驱审查制度也是PMDA重要的开创性审评制度。该制度在2015年4月设立,旨在将全球开发的创新药、医疗器械和再生医疗产品更早带到日本。特别是在早期试验已有显著疗效的药物,先驱审查将促进其更早商业化(例如,药品和医疗器械审批时限是6个月,比平时减少一半)。PMDA的报告整理了自2015年以来所有被纳入先驱审查制度的项目,见下表:
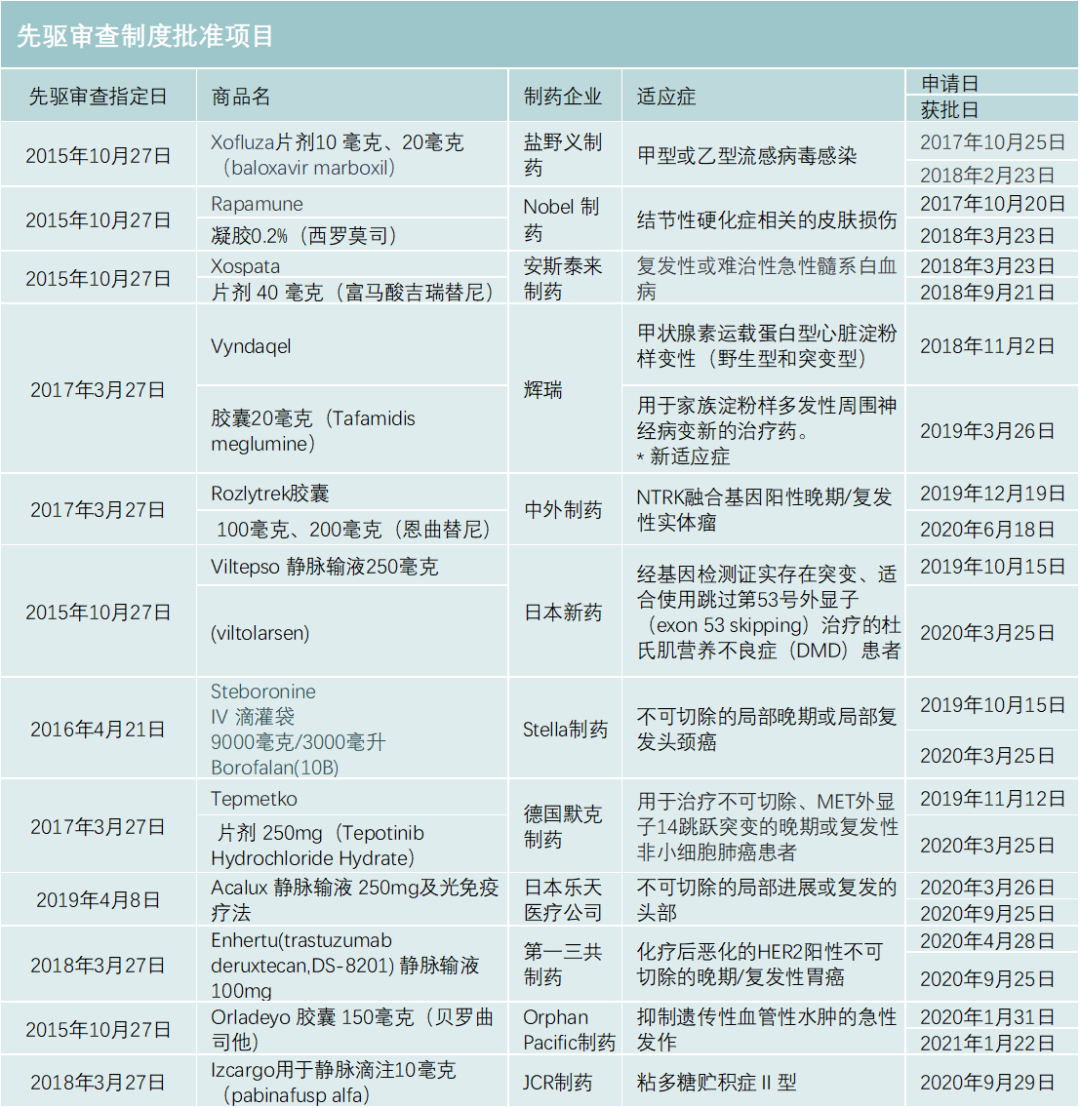
其中,有几个通过先驱审查制度的产品值得关注:
①日本乐天医疗公司的基因重组产品光免疫疗法Acalux 250 毫克(西妥昔单抗)用于不可切除的局部晚期或局部复发头颈癌。该药既有攻击癌细胞的抗体——西妥昔单抗,也有对光产生反应的化学物质,抗体与癌细胞结合以后,再向患者近距离照射红外射线光,激活药物中的抗体,达到破坏癌细胞的功能。PMDA批准该产品是基于一项I期试验和一项IIa期试验结果。在I期临床中,3例无法手术切除的颈部鳞状上皮细胞癌患者在接受Akalux 输注后,再次接受激光束照射治疗,2例患者出现部分缓解。IIa期临床与I期临床的设计类似,30例患者接受治疗后,观察到的总缓解率为43.3%,其中4例患者完全缓解,9例患者部分缓解。
②第一三共制药的抗体偶联药物Enhertu(曲妥珠单抗/德鲁替康,trastuzumab/deruxtecan)用于治疗癌症化疗后进展不可切除晚期或复发性HER2阳性胃癌的新适应症。
③ Orphan Pacific 制药生产的150 毫克Oraldeyo (盐酸贝罗司他)胶囊抑制遗传性血管性水肿的急性发作。这是一种高度选择性的血浆激肽释放酶抑制剂。
④JCR制药生产的Izcargo用于治疗II型黏多糖贮积症,该药将IDS蛋白酶与靶向人类转铁蛋白(transferrin)受体的抗体融合在一起,利用转铁蛋白受体介导的转胞吞作用帮助穿越血脑屏障,从而提高Izcargo在大脑中的水平。
沟通过程被一一认真记录
PMDA十分注重与企业的沟通交流。有时候,当企业只有一个早期想法还没有任何具体研发产品和计划时,PMDA都会十分欢迎他们前来预约咨询。在交流过程中,双方达成的共识都一一被认真记录,成为作为凭据的会议纪要。只要企业按照PMDA的指引去做,审评结果都是可预见和可控的,而企业无需在此过程中反复与监管部门沟通确认,生怕会有变动的情况出现。
去年PMDA开展的沟通交流见下表:
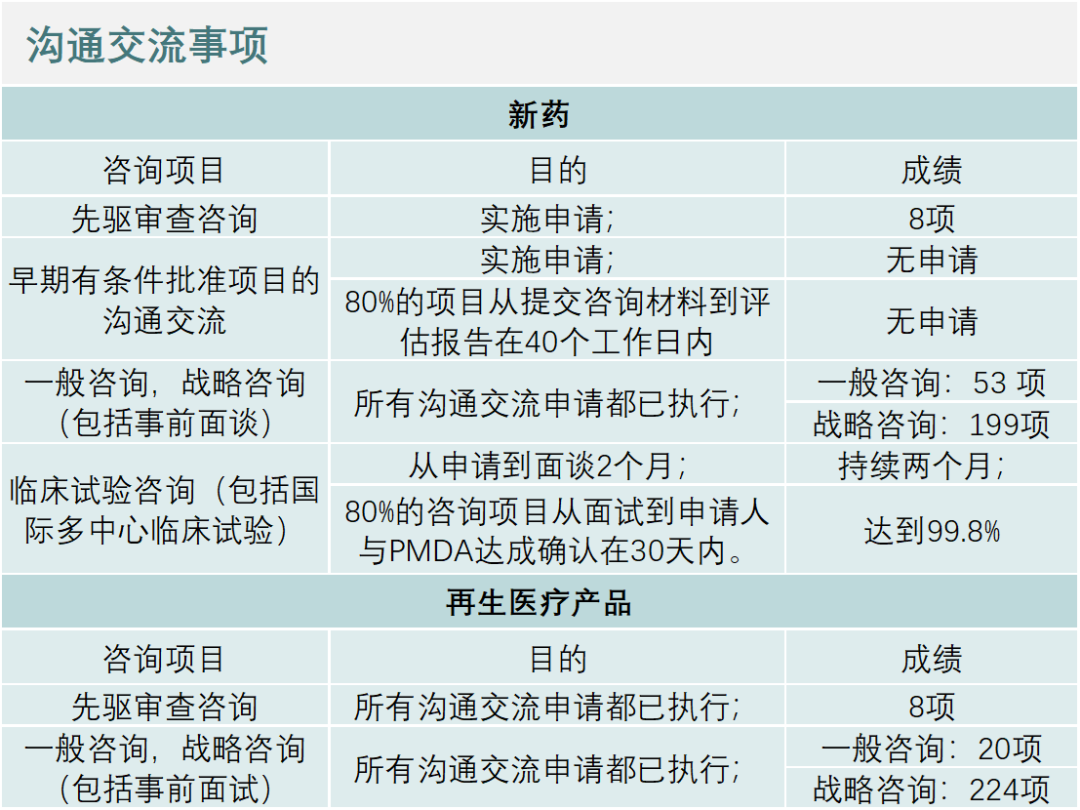
而一般消费者和患者,就药品和医疗器械进行咨询的次数如下:药品咨询12,129人(共13,349项),医疗器械咨询670人(共706例)。此外,PMDA把面向公众的座谈会录制为视频,并在PMDA的主页上发布。
除了努力实现上述沟通交流目标以外,PMDA还及时展开新冠产品的审批咨询。PMDA在2020年10月1日设立了新冠病毒疫苗战略咨询小组。为应对疫情,PMDA开展远程调查,并在网站上发布了为企业制作的视频指南。(详见 日本DIA年会:疫情下急剧转型的临床试验)

为了推动真实世界数据在注册申请中的运用,PMDA不仅设立了真实世界研究工作小组,还出台了《关于在批准申请中使用真实世界证据基本指南》等文件,以促进可靠的真实世界数据在药品等开发和申报中被监管部门接受。
此外,PMDA把咨询表格改为“药品数据库咨询”,进一步推进线上服务,PMDA计划在2022年接受线上注册申报。最后,在“以患者为中心”的主导思想下,PMDA制定了2个疫苗技术新指南,同时更新了18个药品研发技术指南。
总结
据AnswersNews截至2021年11月22日披露的信息,日本国内药企小分子化合物研发占比49%,如大冢制药、卫材、住友制药等公司都是小分子药物研发项目居多,生物制药合计占日本国内药企研发项目的31%,核酸药物占比8%,细胞和基因疗法占比7%,肽类药研发项目占比4%,剩余7%为其他类别的药物。
不过,过去五年,日本其他领域的研发项目显著增加。据由日本制药工业协会 (JPMA)统计,今年1~8月日本获批药物中,约有一半是非小分子药物。销售额在2500亿日元以上的大型/准大型企业中,开发产品的48%是小分子化合物,38%是生物药。
与欧美近年来审批新药的数量相比,PMDA并不是最多的,但可以看到,去年日本获批新药分布的适应症较平均,且都以临床急需为重,一些改良型新药的有效性、安全性和便利性均能围绕患者需求来开发。其研制的新药以严谨、科学的研究数据获得PMDA的审核和临床大夫的信赖。日本的医药创新自上世纪90年代在全球腾飞,如今,日本大药厂依然能紧跟甚至引领全球研发潮流,特别是在基础研究方面依然独具实力。如果我国的制药企业想要做到源头创新,也要在实验室发现上努力。同时,还可考虑在中国和日本之间开展同步临床开发,以高质量的研究数据被PMDA认可和接受,从而进入日本医药市场。
参考文献
1. PMDA業務実績https://www.pmda.go.jp/about-pmda/annual-reports/0001.html
2. PMDA業務実績 for 令和2事業年度https://www.pmda.go.jp/files/000241308.pdf
3. PMDA業務実績参考資料https://www.pmda.go.jp/files/000241511.pdf

 产业资讯
产业资讯
 UmabsDB
UmabsDB  2025-06-23
2025-06-23
 3
3

 产业资讯
产业资讯
 支点财经
支点财经  2025-06-23
2025-06-23
 4
4

 产业资讯
产业资讯
 药视声
药视声  2025-06-23
2025-06-23
 4
4