 研发追踪
研发追踪
 药明康德
药明康德  2021-12-13
2021-12-13
 3454
3454
近日,百时美施贵宝(BMS)旗下新基(Celgene)宣布,美国FDA已授予“first-in-class”血红细胞成熟剂Reblozyl(luspatercept-aamt)的补充生物制品许可申请(sBLA)优先审评资格,用于治疗非输血依赖性β地中海贫血成人患者。此前,FDA已批准该药用于治疗输血依赖性β地中海贫血症患者,与某些罕见血液疾病患者出现的贫血。在今年1月,中国国家药监局药品审评中心(CDE)也将注射用Reblozyl(中文商品名:罗特西普)纳入优先审评名单,治疗需要定期输注血红细胞(RBC)的β地中海贫血患者。

β地中海贫血是一种遗传性血液疾病,它是最常见的常染色体隐性遗传病之一。患者的血红蛋白遗传缺陷导致生成的RBC越来越少,往往会导致严重的贫血并引起其他严重的健康问题。这种疾病的治疗选择有限,主要治疗手段包括频繁输注RBC,但可能导致铁过载和感染,引起器官损伤等严重并发症。非输血依赖性β地中海贫血患者尽管不需要终身定期输血就能生存,但他们同样需要偶尔或在某段时间内频繁的输血,面临着慢性贫血和铁过载导致的一系列临床并发症威胁。
Reblozyl是一款通过调节后期血红细胞成熟过程,降低输血负担的创新药物。作为一种可溶性融合蛋白,该药由人免疫球蛋白G1(IgG1)的Fc结构域,与活化素受体IIB(ActRIIB)的细胞外结构域融合而成。它能够作为TGF-β的配体陷阱(ligand trap),防止TGF-β激活Smad2/3信号通路,进而促进晚期红细胞的分化和成熟,以减轻患者定期RBC输注的负担。
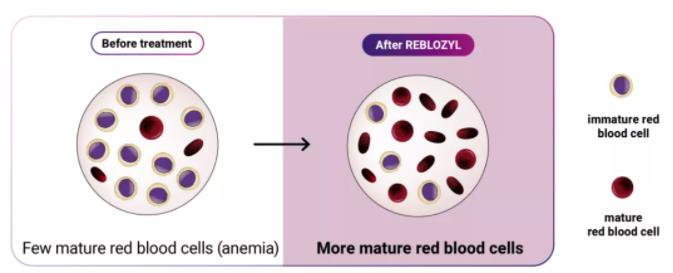
▲Reblozyl能增加患者血液中血红蛋白含量,增加成熟红细胞的分化(图片来源: reblozyl.com)
该项申请是基于一项关键性2期临床试验获得的积极结果,试验共入组145例非输血依赖性β地中海贫血成人患者,在最佳支持治疗的基础上,受试者以2:1的比例随机接受Reblozyl或安慰剂给药。试验达到其主要终点,从治疗第13周至第24周,与安慰剂组(0/49例)相比,Reblozyl组中96例患者中有74例(77.1%)血红蛋白平均值较基线升高≥1.0 g/dL。且该药表现出良好的耐受性与安全性特征,最常见的不良事件为骨痛、头痛和关节痛,未报告恶性肿瘤或血栓栓塞事件。
百时美施贵宝血液学开发部高级副总裁Noah Berkowitz博士表示:“我们致力于继续推进Reblozyl的临床项目,并期待与FDA合作,以尽快将该疗法带给这类患者人群。”

 研发追踪
研发追踪
 药时代
药时代  2026-02-13
2026-02-13
 106
106

 研发追踪
研发追踪
 医药魔方
医药魔方  2026-02-13
2026-02-13
 98
98

 研发追踪
研发追踪
 瞪羚社
瞪羚社  2026-02-13
2026-02-13
 91
91