 产业资讯
产业资讯
 医药地理
医药地理  2021-12-30
2021-12-30
 2288
2288
随着新冠疫情走向常态化,医药板块的市场情绪逐渐回归理性。自国家药品监督管理局药品审评中心7月2日发布《以临床价值为导向的抗肿瘤药物临床研发指导原则》(征求意见稿)起,医药板块开始整体呈震荡下行态势,进入11月份医保谈判,19日审评中心正式发布《以临床价值为导向的抗肿瘤药物临床研发指导原则》,政策落地后医药板块走势终于开始回暖。
究竟是怎样一份指导文件有如此大的“魔力”?
《以临床价值为导向的抗肿瘤药物临床研发指导原则》(以下简称《抗肿瘤药物指导原则》),强调新药研发应以患者需求为核心,以临床价值为导向。该原则对创新药的研发提出了更高的要求,旨在实现新药研发的根本价值——解决临床需求,实现患者获益的最大化。创新药的研发具有高风险高投入高收益的特点,有很强的技术壁垒。《抗肿瘤药物指导原则》将使创新药研发的马太效应更为凸显,管线丰富研发投入大的头部药企稳居强势地位,缺乏创新能力研发薄弱的药企则面临巨大挑战,这无疑会推动我国大部分医药企业逐步从me-too往me-better或者完全自主的创新药的路径上转型。
他山之石可以攻玉,如何具体践行抗肿瘤药物指导原则?
纵观2021年欧美前3季度的新药审批,美国FDA和欧盟EMA集中审评共批准了27个抗肿瘤新药。他山之石可以攻玉,接下来以欧美批准的抗肿瘤新药为例具体解读我国《抗肿瘤药物指导原则》中以患者需求为导向的五个新药研发要求。
01.加强机制研究
美国FDA于5月28日加速批准了安进公司的KRASG12C抑制剂Lumakras,用于治疗既往至少接受过一次系统治疗的携带KRASG12C突变局部晚期或转移性非小细胞肺癌(NSCLC)患者。Lumakras是在长达40多年KRAS突变癌蛋白研究之后,全球首个成药的KRASG12C抑制剂。默沙东的抗肿瘤新药Welireg为第一款HIF-2α抑制剂疗法,是第一个也是唯一一个获批用于治疗希佩尔•林道综合征(VHL)疾病相关癌症的药物,相关生物学研究于2019年获得诺贝尔生理学或医学奖。

我国《抗肿瘤药物指导原则》中明确提出基础研究和药物作用机制创新,是推进药物研发的根本动力。药物研发伊始,应加强肿瘤发生、发展机制的基础研究,同时加加强药物作用机制的研究,通过突破与创新,优化药物设计,开发新的治疗方法,不断满足肿瘤患者的治疗需求。
02.提高精准化治疗
随着生物技术在医学领域的快速发展,以及对肿瘤发病机制研究的不断深入,肿瘤的诊断与治疗已向精准医学转化。2021年前3季度欧美批准了多款精准治疗的抗肿瘤新药。
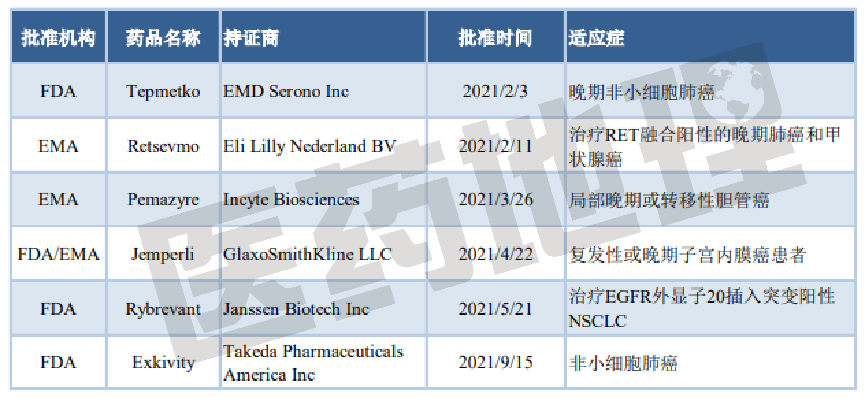
靶向抗肿瘤药Tepmetko,用于治疗携带MET基因第14号外显子跳过改变(METex14skipping)的晚期非小细胞肺癌(NSCLC)成人患者,是全球第一个被批准用于治疗携带MET基因改变的晚期NSCLC患者的口服MET抑制剂。礼来公司的Retsevmo,用于治疗RET融合阳性的晚期肺癌和甲状腺癌。Pemazyre是治疗在接受至少一种系统疗法后病情复发或难治、存在FGFR2融合或重排、不能手术切除的局部晚期或转移性胆管癌患者的首个靶向疗法。葛兰素史克(GSK)抗肿瘤新药抗PD-1疗法Jemperli用于治疗接受含铂化疗期间或之后病情进展、错配修复缺陷(dMMR)复发性或晚期子宫内膜癌患者,同时获FDA和EMA批准。强生(JNJ)的EGFR-MET双特异性抗体Rybrevant,用于治疗在接受含铂化疗失败后病情进展、EGFR基因外显子20插入突变阳性的转移性非小细胞肺癌(mNSCLC)成人患者,是第一个获批治疗EGFR外显子20插入突变阳性NSCLC的靶向疗法。武田制药(Takeda)的肺癌创新药Exkivity,用于治疗先前接受含铂化疗期间或之后病情进展、经FDA批准的检测方法证实为携带表皮生长因子受体(EGFR)20号外显子插入突变(EGFRex20ins)的局部晚期或转移性非小细胞肺癌成人患者。
我国《抗肿瘤药物指导原则》强调在抗肿瘤药物研发过程中,应关注并且持续改进患者与治疗药物的匹配程度,不断提升抗肿瘤治疗的精准性,使肿瘤患者能接受到更为适合自己的治疗药物。
03.关注治疗需求的动态变化
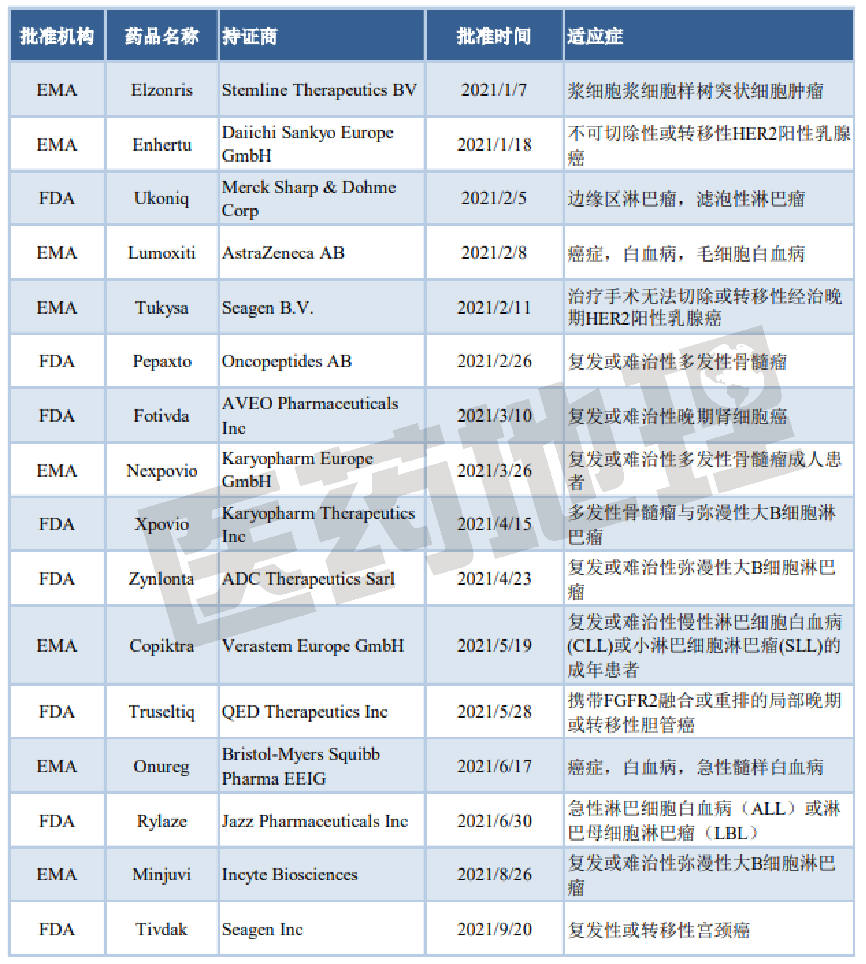
随着靶向治疗的发展,抗肿瘤治疗越来越精准,抗肿瘤药物治疗的有效性也逐步提高,但肿瘤患者的治疗需求始终处于动态变化中。
新一代口服PI3Kδ/CK1-ε双重抑制剂Ukoniq用于治疗已接受过至少一种基于抗CD20方案的复发或难治性边缘区淋巴瘤(MZL)患者或已接受过至少3种系统疗法的复发或难治性滤泡性淋巴瘤(FL)成人患者。Nexpovio获EMA批准,联合地塞米松用于治疗既往接受过至少4种疗法且其疾病对至少2种蛋白酶体抑制剂(PI)、2种免疫抑制剂(IMiD)、1种抗CD38单克隆抗体难治、接受最后一种疗法时疾病进展的复发或难治性多发性骨髓瘤(RRMM)成人患者。Jazz制药的Rylaze获得美国FDA批准用于治疗对大肠杆菌衍生的天冬酰胺酶过敏的1个月及以上的儿童和成人患者。Tivdak用于治疗在化疗中或化疗后疾病进展的复发性或转移性宫颈癌成人患者,以应对一旦宫颈癌复发或转移,临床上的治疗选择非常有限的现状。Minjuvi则用于先联合来那度胺,后tafasitamab单药治疗不适合自体干细胞移植(ASCT)的复发或难治性弥漫性大B细胞淋巴瘤(r/rDLBCL)的成人患者。
我国《抗肿瘤药物指导原则》亦明确提出时刻关注患者治疗需求的变化,不断发掘抗肿瘤患者未满足的临床需求。
04.不断改善药物安全性

Breyanzi最初由Juno研发,是一种靶向CD19抗原的CAR-T细胞疗法。相比其他已经上市的CAR-T疗法,Breyanzi具有最好的安全性数据,其CD8阳性和CD4阳性T细胞的比例为1:1,可更好地控制细胞疗法的毒副作用。FDA批准的Cosela是全球第一款也是唯一一款可降低化疗诱导的骨髓抑制发生率的骨髓保护疗法,能够为接受化疗的ES-SCLC患者提供骨髓保护作用。可降低严重中性粒细胞减少症和贫血的发生率和持续时间、减少诸如生长因子和红细胞输注等抢救性干预措施的需要。我国《抗肿瘤药物指导原则》提出,在抗肿瘤药物的研发中,应关注肿瘤患者对用药安全性,特别是对长期用药安全性日益提高的需求和期待,将提高和不断改善抗肿瘤药物的安全性,作为重要的研发方向。
05.改善治疗体验和便利性
今年3月,美国FDA批准Abecma,用于治疗复发和难治性多发性骨髓瘤(R/RMM)成人患者。Abecma是全球首个上市的BCMA导向CAR-T细胞疗法。Abecma的批准上市,将为这类患者提供一种新的、有效的、个性化治疗方案,仅需一次输液即可实现快速、深度、持久的缓解。除开发长效制剂,我国《抗肿瘤药物指导原则》给出的其他改良给药途径还有,开发皮下制剂、口服制剂,改善患者治疗的便利性;减少给药频次,有助于减少患者治疗负担。

创新是一个长期过程,无法一蹴而就。我国医药创新开端良好但前路依然漫长,可以肯定的是我国大力发展创新药的方向非常明确,加强研产学结合,充分联动学术界和企业界,打通创新源头和商业化主体,以患者需求为核心,以临床应用为目的,促进产业化链条逐步形成、完善。医药产业与人民生活密切相关,是永远的朝阳产业,更高的创新要求只会加速我国走向医药产业创新时代的进程,迎来医药创新的黄金时代。

 产业资讯
产业资讯
 研发客
研发客  2025-05-13
2025-05-13
 40
40

 产业资讯
产业资讯
 药智数据
药智数据  2025-05-13
2025-05-13
 39
39

 产业资讯
产业资讯
 佰傲谷BioValley
佰傲谷BioValley  2025-05-13
2025-05-13
 40
40