 产业资讯
产业资讯
 研发客
研发客  2022-01-20
2022-01-20
 3973
3973
在《荷马史诗》中,英雄阿克琉斯的母亲为了让儿子获得不死之身,将其浸入冥河,又因河水湍急,她捏住阿克琉斯的脚后跟不敢松手而导致其脚后跟未浸入河水。成年后的阿克琉斯果然变得战无不胜,然而最终因为脆弱的脚踝中了毒箭死去。
2021年,美国FDA批准了4款生物类似药,其中有2款为可互换产品(interchangeable product)。这是FDA首次批准可互换生物类似药,国外许多分析师认为“可互换”将为生物类似药的发展带来重大影响。
可互换产品是指药师无需医生重新处方即用可互换产品替代原研生物药(需遵循美国各州不同法律)。尽管业界有观点认为可互换认证是对生物类似药的一种“加持”,FDA也认为可互换产品与创新疗法一样安全有效,但囿于现实中的一些复杂因素,如广泛存在的专利保护、复杂的法律和现实的临床评价等问题,可互换认证究竟能否提升生物类似药的竞争力值得讨论。
事实上,如同阿克琉斯获得“不坏之身”之后反而暴露其弱点,可互换性被过分强调对于生物类似药产业的发展未见得是好事。除了可能制造出额外的竞争,还可能加大医生与患者对于同类产品理解和选择的难度,而获得认证的产品后续可能还要面临一系列复杂的问题,如对照产品的给药方式、说明书发生变更等。可互换的“头衔”可能成为生物类似药的“阿克琉斯之踵”吗?
对出海产品的挑战
FDA批准的两款可互换产品分别为:Viatris和Biocon Biologics的 Semglee(长效甘精胰岛素),可与赛诺菲的Lantus互换;勃林格殷格翰的Cyltezo,为艾伯维Humira(阿达木单抗)的可互换生物类似药——这也是FDA批准的首个阿达木单抗可互换生物类似药。
“药王”Humira的美国专利将于2023年到期,目前已有6款生物类似药获得FDA的批准等待上市。根据公开信息,安进的Amjevita(2016 年9月获批)和辉瑞的Abrilada(2019年获批)这两款在美国上市的Humira生物类似药正在计划通过FDA获得可互换性的认证;还有Alvotech的AVTO2(一种无柠檬酸盐的高浓度阿达木单抗),正在准备向美国FDA申请上市,并进行可互换认证。
FDA批准的6款Humira生物类似药
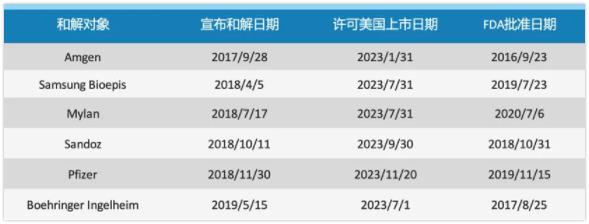
数据来源|药融云数据库
而在中国,有4款国产Humira生物类似药上市,分别来自复宏汉霖、信达生物、海正生物以及百奥泰,这4家企业尚未公开在美国递交上市申请的计划。此外,还有超过26家本土企业的Humira生物类似药处于临床研究的不同阶段。未来,若国产生物类似药准备出海,是否要进行可互换认证将成为一项需要重点考量的因素。
值得注意的是,韩国Celltrion公司与香港南丰集团的合资企业鼎赛医药的三款已在全球市场销售的明星生物类似药均已在美国获批,并已进行过可互换性的研究,分别为Remsima(英夫利昔单抗生物类似药)、Truxima(利妥昔单抗生物类似药)和Herzuma(曲妥珠单抗生物类似药)。
FDA关于互换性的决策经验
过去的几十年间,FDA关于生物制品的可互换决定仅限于同一生产厂家的产品。此次FDA关于可互换性的监管决定之所以引起重视,是因为这是世界上第一次由药监部门决定来自不同生产厂家的生物制剂可以进行互换,而不需要医生的处方。
此前需要互换的应用场景通常发生在原研药企对其原研生物制剂在上市后进行的不同程度的“改造和升级”。这些原研厂家对同一产品的不同版本向FDA提供相关数据,FDA经评估后认定不同版本的产品可以让患者得到相同的临床获益。
2007年,时任 FDA 副局长的Janet Woodcock曾提到,FDA很少要求原研厂家对于产品的“升级”额外再开展临床研究。值得一提的还有,如果原研厂家的特定生物制剂的生产发生变更,FDA再进行批准时一般不征询公众意见。产品的标签保持不变,患者和医生通常不知道产品发生了变化。
这些既往的经验体现了FDA对于生物制剂生产变更后的安全性和有效性具有信心,一定程度上为证明所谓原研药(初代产品)与生物类似药的“相同”打下了基础。
可互换性代表更高要求
生物类似药是与原研生物制剂高度相似的替代品,需要经过严格的评估来确保产品的疗效和安全性。对于可互换的生物类似药,除了需要满足生物类似药的标准外,FDA还要求开展转换研究来进行评估。
这意味着可互换的生物类似药必须在任何患者身上产生与原研生物制剂相同的临床效果。此外,患者必须能够在可互换的生物仿制药和原始生物制剂之间来回切换,没有安全风险或降低有效性。只有这样,FDA 才会批准该生物类似药具有可互换性。
目前我国还未建立生物类似药“可互换”的标准。不过,2020年发布的《生物类似药临床应用管理专家共识(第一版)》指出,生物类似药与原研药的相似性可分为两个层次,生物相似性是基本要求,可互换性是更高要求,可互换性需要接受更加严格的临床试验。
拥有更强的竞争力?
谈到药物治疗,首先要关注的当然是临床应用的疗效和安全性,然而某些原研药物昂贵的定价可能让患者难以承受。可互换性除了为生物类似药镀上一层可媲美原研产品的“光环”,还能通过创造市场上的竞争降低药价,提高患者用药可及性,进而降低社会层面整体的医疗成本。
Janet Woodcock曾表示这是FDA支持生物产品竞争市场的重要举措,以求让患者获得安全、有效和高质量、价格更低的药物。据RAND公司预测,从2017年到2026年,在美国通过使用生物类似药将使生物制剂的直接支出减少540亿美元。
然而,也正是基于既往FDA审批生物类似药的经验,有分析师认为,目前还很难判断可互换性认证对于生物类似药可及性的提高有多大的助益。自2015年美国FDA第一次批准了生物类似药Zarxio以来,超过30款生物类似药已经经过FDA严格审批上市。想要拥有可互换“头衔”需要更高的开发成本,然而拥有这样的“头衔”并不意味着就比其他没有认证的生物类似药更有效或更安全。
事实上,在现实的临床应用中,很多互换的临床应用场景已经在发生了。以慢性病为例,患者由于需要长期服药,可能无可避免地会发生换药。一些仿制药企为此已经开展过相关的真实世界研究,当然,研究的初衷或许并不是为了在监管层面获得可互换的认证,这些研究的数据此前很多并未进行公开的展示和讨论。
Lupin Pharmaceuticals的全球许可和业务发展高级副总裁Anshuman Patwardhan博士在2021年的GRx+Biosims会议上曾提到,即便没有得到可互换认证,一些生物类似药在真实世界研究中的数据也已证实互换后并未出现关于疗效、安全性和免疫原性的问题。
实际效果有待考察
在监管层面,可互换的“头衔”给了生物类似药和原研生物药分庭抗礼的机会,然而许多从业者担忧,如果眼下过分强调可互换的“头衔”,反而会降低医生和患者对于生物类似药的重视,同时可能造成生物类似药之间的“内卷”,不一定有益于整个生物类似药产业的发展。
与此同时,由可互换认证带来的许多问题仍有待回答。例如,如果生物类似药或原研药的给药方式发生变化,互换性的“头衔”是否仍可以保留?原研产品如果获得了新适应症,生物类似药是否仍可视为可互换?医生和患者对于可互换概念的了解需要经过怎样的过程?是否会产生新的困扰?
对此,FDA 药物评估和研究中心的治疗性生物制剂和生物类似药办公室主任 Sarah Yim博士曾表示,FDA正在制定产品标签的应用指南,并将针对给药设备、适应症等可能变化的因素提供相应的解释与指导。
可以确定的是,目前在美国,通过监管层面和真实世界研究结果的公布,越来越多生物类似药企开始为产品寻求可互换的“头衔”,以期获得公众和投资者的青睐。

 产业资讯
产业资讯
 清科研究
清科研究  2025-08-02
2025-08-02
 31
31

 产业资讯
产业资讯
 空之客
空之客  2025-08-02
2025-08-02
 34
34

 产业资讯
产业资讯
 医药魔方
医药魔方  2025-08-02
2025-08-02
 34
34