 产业资讯
产业资讯
 艾美达医药咨询
艾美达医药咨询  2022-04-01
2022-04-01
 2713
2713
3月30日,Taiho Oncology和Taiho Pharmaceutical宣布FDA已受理futibatinib用于既往接受过治疗、携带FGFR2融合(包括基因融合)的局部晚期或转移性胆管癌(CCA)的新药申请(NDA)。同时,FDA还授予该申请优先审评资格,PDUFA日期为2022年9月30日。

futibatinib(TAS-120)是一款口服、选择性FGFR1-4抑制剂,通过与FGFR1-4的ATP结合“口袋”不可逆地共价结合,抑制FGFR介导的信号传导,从而降低携带FGFR1-4基因变异的肿瘤细胞的增殖。2018年5月,futibatinib被FDA授予治疗胆管细胞癌的孤儿药资格。2021年4月,futibatinib又被FDA授予突破性药物资格,用于治疗携带FGFR2基因重排、先前接受过治疗的局部晚期或转移性胆管癌患者。
此次NDA是基于futibatinib关键2b期临床研究FOENIX-CCA2 的积极结果。该研究是一项单臂多中心研究,旨在评估futibatinib治疗携带FGFR2基因重排(包括基因融合)、接受过至少一种疗法治疗失败的局部晚期或转移性肝内胆管癌(iCCA)患者的疗效和安全性。研究中,103例iCCA患者每日口服 20 mg futibatinib,直至疾病进展或不可接受的毒性作用。研究的主要终点为独立影像学委员会评估的客观缓解率(ORR),次要终点包括疾病控制率(DCR)、缓解持续时间(DOR)、无进展生存期(PFS)和安全性。
2021年4月美国癌症研究协会(AACR)上公布的该研究结果显示:futibatinib治疗的ORR为41.7%,达到独立中心审查评估确定的ORR>20%的主要终点。次要终点方面:mDOR为9.7个月,72%的缓解时间≥6个月,DCR为82.5%,mPFS为9.0个月、中位总生存期(mOS)为21.7个月,72%的患者在12个月时存活。
安全性方面,研究中常见的治疗相关不良事件为高磷血症(85%)、脱发(33%)和口干(30%)。最常见的3级TRAE是高磷血症(30%),但经适当的治疗后症状消失。
FGFR,即成纤维细胞生长因子受体,是受体酪氨酸激酶的亚族之一,包括FGFR1、FGFR2、FGFR3、FGFR4四种亚型。由FGFR介导的信号传导通路如RAS-RAF-MAPK、PI3K-AKT、信号转导子和转录激活子(STAT)以及磷脂酶Cγ(PLCγ)等是正常细胞生长分化所必需的,参与新血管生成、细胞增殖和迁移、调节器官发育、伤口愈合等生理过程。
当FGFR发生突变或者过表达时,FGFR信号通路会过度激活,诱发正常细胞癌变。2015年Clinical Cancer Research上发表的一项研究显示:大约7.1%的癌症中发现FGFR畸变,几乎所有检测的恶性肿瘤中均存在FGFR畸变,发生率较高的癌症有尿路上皮癌、乳腺癌、子宫内膜癌、鳞状上皮癌等。而常见的FGFR通路异常包括扩增、突变和重排。
目前,全球药企围绕FGFR靶点已经开发出多款药物,其中强生的Balversa(erdafitinib)、Incyte公司/信达生物的Pemazyre(pemigatinib)、BridgeBio/Helsinn的Truseltiq(infigratinib)已经获批上市。
Balversa是Astex制药发现的一种每日口服一次的FGFR激酶抑制剂,2019年4月被FDA批准用于治疗携带易感FGFR3或FGFR2基因改变、并且接受至少一种含铂化疗期间或之后(包括新辅助或辅助含铂化疗12个月内)病情进展的局部晚期或转移性尿路上皮癌(mUC)成人患者。2008年,强生与Astex制药达成独家全球授权和合作协议,共同开发和商业化该药。
Pemazyre是Incyte公司研发的一种针对FGFR异构体1、2、3的强效、选择性、口服小分子抑制剂,2020年4月被FDA批准用于治疗先前已接受过治疗、存在FGFR2融合或重排、不能手术切除的局部晚期或转移性胆管癌患者。2018年,信达生物与Incyte公司达成独家授权许可协议,获得包括该药在内的3款药物单药或联合治疗在中国内地及香港、澳门和台湾地区的临床开发与商业化授权。
Truseltiq是创新型口服FGFR 1-3选择性强效抑制剂,具有明确的新型化学结构及药理作用,2021年5月被FDA批准用于治疗先前接受过治疗、携带FGFR2融合或重排的局部晚期或转移性CCA患者。该药由BridgeBio从诺华引进,目前BridgeBio和Helsinn共同负责美国市场,Helsinn负责美国以外(不包括大中华区)市场,联拓生物负责大中华区(中国大陆、香港、澳门)的临床开发、注册申请和未来的商业运营中国市场的开发和商业化。
据公司财报,Pemazyre 2020年、2021年销售额分别为25.9百万美元、68.5百万美元。另外两款产品具体销售额未知,不过Nature Review Drug Discovery预测Balversa 2024年销售额约为12亿美元。
此外,目前还有多款FGFR抑制剂处于临床试验阶段,详见下表。其中Rogaratinib是拜耳开发的一种具有口服活性的高效、选择性FGFR1-4抑制剂,针对尿路上皮癌适应症的临床试验处于3期临床。bemarituzumab是Five Prime Therapeutics研发的一款抗FGFR2b单抗,先后被FDA和CDE授予突破性疗法资格认定,联合改良版FOLFOX6化疗方案(mFOLFOX6:氟嘧啶+亚叶酸钙+奥沙利铂),一线治疗成纤维细胞生长因子受体2b(FGFR2b)过表达、HER2阴性、转移性和局部晚期胃及胃食管交界部(GEJ)癌患者。2017年12月,再鼎医药与Five Prime达成授权协议,获得bemarituzumab在大中华区的权益。derazantinib是ArQule公司研制的一种强效、口服、泛-FGFR抑制剂,对FGFR1、2、3具有很强的活性,且还能抑制CSF1R(即集落刺激因子1受体激酶,其介导的信号对维持促肿瘤巨噬细胞很重要,已被确定为抗癌药物的潜在靶点),曾被FDA和EMA授予治疗肝内胆管癌的孤儿药资格。2018年2月,Roivant Sciences与ArQule达成合作,获得该药在大中华区的授权。
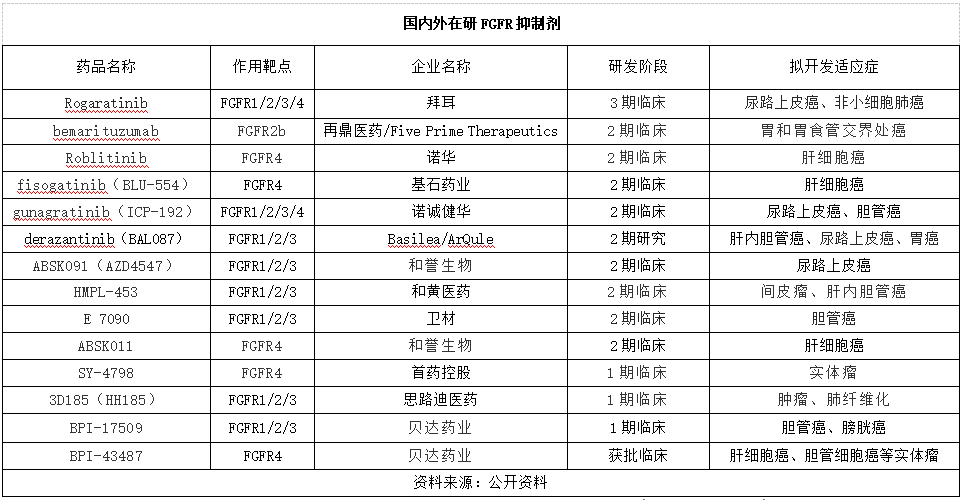
纵观上述在研FGFR抑制剂,除了泛FGFR抑制剂,企业已开始布局FGFR4抑制剂。而且FGFR抑制剂的适应症更加广泛,除了胆管癌和尿路上皮癌,已扩大到肝细胞癌、胃和胃食管交界处癌以及间皮瘤等。我国药企也在积极布局FGFR抑制剂市场,除了引进,还积极自主研发,例如贝达药业不仅研发了泛FGFR抑制剂,还开发了FGFR4抑制剂。

 产业资讯
产业资讯
 医药魔方数据库
医药魔方数据库  2025-05-22
2025-05-22
 44
44

 产业资讯
产业资讯
 药智网
药智网  2025-05-22
2025-05-22
 38
38

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-05-22
2025-05-22
 42
42