 产业资讯
产业资讯
 FIC Intelligence
FIC Intelligence  2022-04-14
2022-04-14
 2921
2921
根据药品监督管理局官网发布信息统计,3月共有27款新药在中国NMPA获批上市或新增适应症,其中化药10个,生物药17个;共有13款新药在美国FDA获批上市,其中化药12个,生物药1个。适应症涵盖肿瘤、自身免疫系统疾病、神经系统疾病等多个领域。本文选取部分备受关注的新药信息进行分享。
FDA 3月获批上市新药
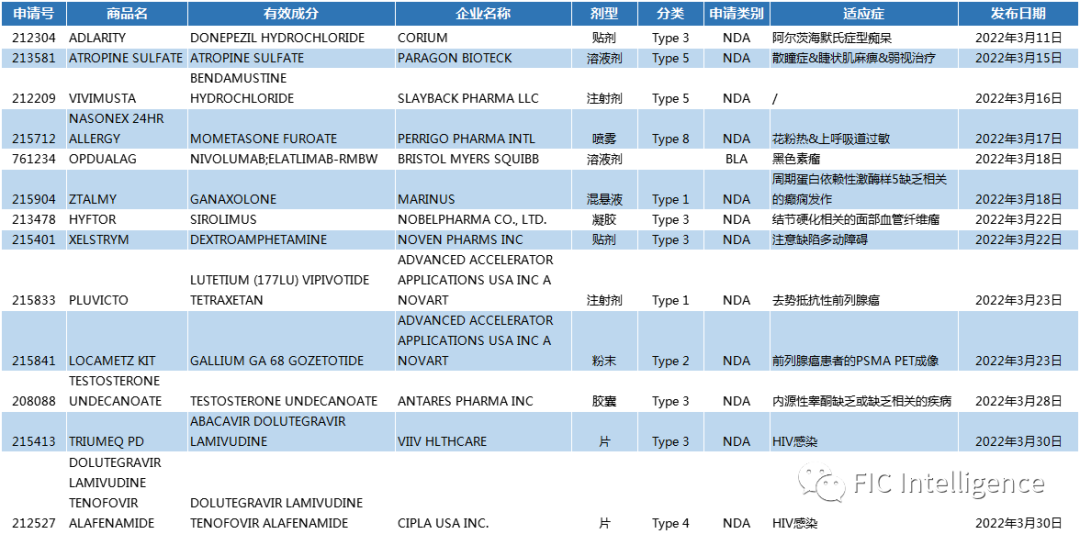
药品名:Ztalmy
公 司:Marinus
3月18日,美国食品药品监督管理局(FDA)批准Ztalmy®(甘氨噻酮)口服混悬液的上市申请。Ztalmy(Ganaxolone)用于治疗2岁及以上人群周期蛋白依赖性激酶样5(CDKL5)缺乏症相关的癫痫发作,是美国FDA批准的首个专门用于治疗CDD的药物。Ztalmy是一种神经活性类固醇,可作为GABA的正变构调节剂A受体。
该批准基于3期金盏花双盲安慰剂对照试验的数据,其中101名患者被随机分组,接受Ztalmy治疗的个体在28天内主要运动性癫痫发作频率中值降低了30.7%,而接受安慰剂治疗的个体中值降低了6.9%,达到了试验的主要终点(p=0.0036)。在Marigold open label extension研究中,接受Ztalmy治疗至少12个月(n=48)的患者主要运动性癫痫发作频率平均降低49.6%。
参考来源:https://www.ztalmy.com/

药品名:Pluvicto
公 司:Novart
3月23日,FDA官网公布,诺华子公司Advanced Accelerator Applications S.A.的Pluvicto作为放射性配体治疗剂,被批准用于治疗已接受雄激素受体 (AR) 通路抑制剂和紫杉烷类化疗的前列腺特异性膜抗原 (PSMA) 阳性转移性去势抵抗性前列腺癌 (mCRPC) 成年患者 。
FDA 批准 Pluvicto 是基于 III 期 VISION 试验的结果,该试验表明 PSMA 阳性 mCRPC 患者以前接受过雄激素受体 (AR) 通路抑制和紫杉烷类化疗,与单独标准治疗相比,接受Pluvicto加标准治疗疗法的参与者死亡风险降低了38%,并且影像学疾病进展或死亡 (rPFS) 风险显著降低,有统计学显著差异。
相关阅读:精准治疗|首款FDA批准治疗mCRPC患者的靶向放射配体疗法
EMA 3月获批上市新药
EMA 3月无新药上市
NMPA 3月获批上市新药
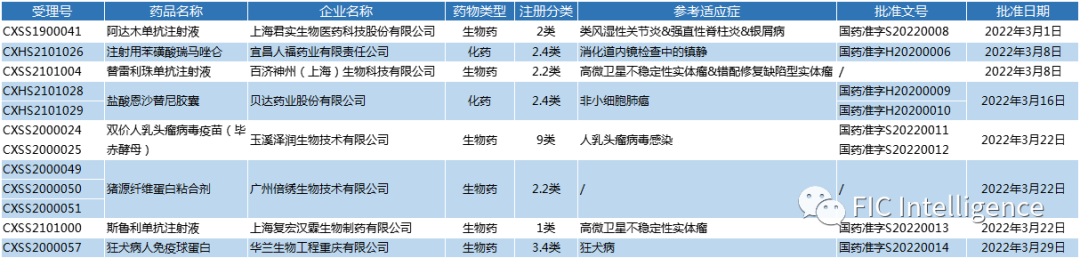
NMPA国产上市新药
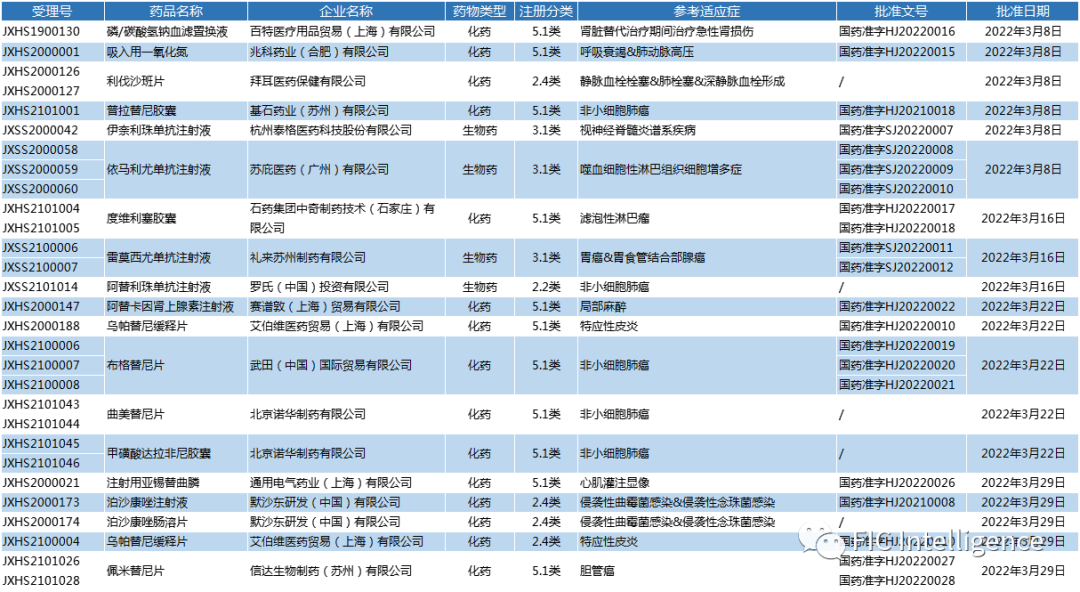
NMPA进口上市新药
通用名:斯鲁利单抗注射液
公 司:复宏汉霖
3月24日,复宏汉霖申请的1类新药斯鲁利单抗注射液(商品名:汉斯状®,研发代码:HLX10)获批上市(受理号:CXSS2101000)。汉斯状为重组人源化抗PD-1单抗注射液,是国内第七款上市的PD-1,也是复宏汉霖首个自主研发的创新型单抗,该产品获批用于治疗微卫星高度不稳定(MSI-H)实体瘤。
此次获批主要是基于一项单臂、多中心、关键性II期临床研究(CTR20190719)。截止到2021年7月10日,本试验共入组108名患者,其中68名经中心实验室或研究中心确认MSI-H的患者被纳入主要疗效分析人群。主要疗效分析人群中,经IRRC评估的ORR为39.7%。
围绕斯鲁利单抗,复宏汉霖在全球开展并加速推进多元化的肿瘤免疫联合疗法,广泛覆盖肺癌、食管癌、头颈癌和胃癌等高发癌种,全面覆盖肺癌一线治疗。其中治疗局部晚期或转移性非鳞状非小细胞肺癌(sqNSCLC)的新药申请已获NMPA受理,有望今年获批上市。
参考来源:https://www.henlius.com/NewsDetails-3511-26.html
图片来源:复宏汉霖官网
通用名:盐酸恩沙替尼胶囊
公 司:贝达药业
3月21日,贝达药业收到国家药品监督管理局签发的《药品注册证书》(药品批准文号:国药准字H20200009、国药准字H20200010),盐酸恩沙替尼胶囊(贝美纳®)适用于间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者治疗的新适应症(简称“一线治疗适应症”)获批上市,这是恩沙替尼获批的第二项适应症。
盐酸恩沙替尼是一种新型强效、高选择性的新一代ALK抑制剂,是贝达药业和控股子公司Xcovery共同开发的全新的、拥有完全自主知识产权的创新药。2020年11月,恩沙替尼二线治疗适应症获批上市,成为中国第一个用于治疗ALK阳性晚期非小细胞肺癌的国产1类新药。
参考来源:https://www.bettapharma.com/Product/index/cid/52/id/20

图片来源:贝达药业官网
通用名:曲美替尼片&甲磺酸达拉非尼胶囊
公 司:北京诺华
3月25日,北京诺华双靶向联合治疗药物泰菲乐®(甲磺酸达拉非尼胶囊)和迈吉宁®(曲美替尼片),获国家药品监督管理局批准新增适应症,用于治疗BRAF V600突变阳性转移性非小细胞肺癌。这不仅是泰菲乐®联合迈吉宁®获批的第三个适应症,也是目前中国首个批准针对BRAF V600突变阳性转移性非小细胞肺癌的双靶向联合治疗药物。
此前,泰菲乐®和迈吉宁®已获批用于治疗BRAF V600突变阳性的不可切除或转移性黑色素瘤及BRAF V600突变阳性的III期黑色素瘤患者完全切除后的辅助治疗。本次获批,则为中国肺癌少见突变的患者带来新的治疗选择,是肺癌靶向治疗领域又一重要的里程碑。
参考来源:https://www.novartis.com.cn/

图片来源:北京诺华官网

 产业资讯
产业资讯
 药渡
药渡  2025-11-07
2025-11-07
 116
116

 产业资讯
产业资讯
 药时代
药时代  2025-11-07
2025-11-07
 125
125

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-11-07
2025-11-07
 115
115