 产业资讯
产业资讯
 同写意
同写意  2022-05-30
2022-05-30
 3170
3170
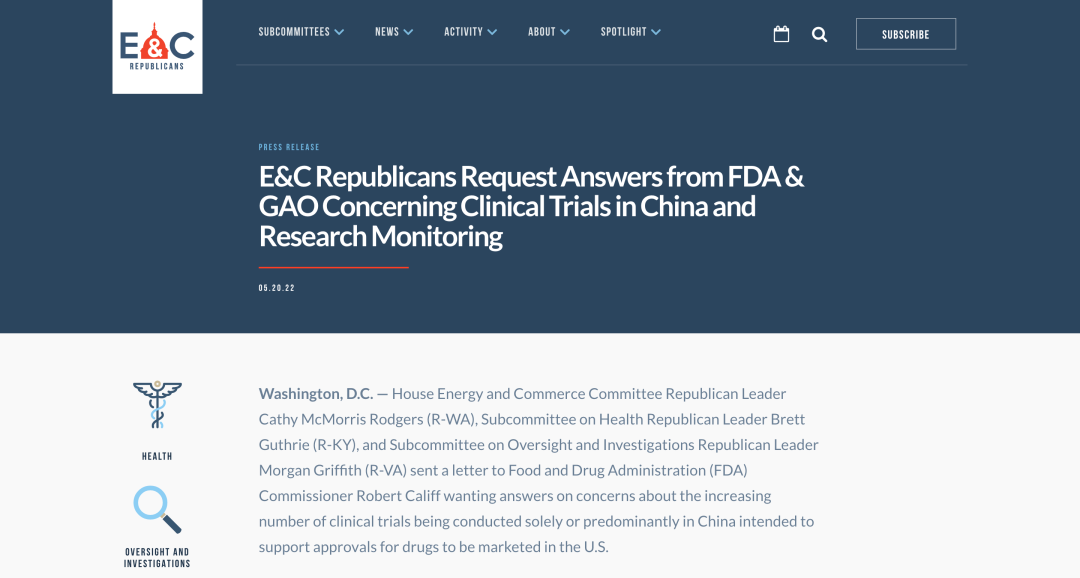
看事态发展,尤其是FDA局长Califf怎么回复
孟八一|美国医药特邀评论员
首先,国会能源和商业委员会Committee on Energy and Commerce,是国会很厉害的一个委员会。历史上,很多重要的法案,都是出自这个委员会。
Cathy McMorris Rodgers虽然不是该委员会主席,但是,Ranking Member是代表共和党在该委员会行使权力。写这封信的三个议员,都是共和党。除了发给FDA局长Califf之外,还发给了国会问责委员会GAO一封信。
这就意味着,这三位议员有意识把这件事搞大。如果问责委员会开启调查,就可能会写出调查报告,就是我们常见的所谓“GAO report”。GAO是代表国会做调查,调查结果,基本就反映了国会的态度。所以,看事态发展,尤其是FDA局长Califf怎么回复。或许,会有国会听证。
从这封信的态度,明显是要FDA对中国临床试验,采取否定态度。
(致信GAO的函件原文:https://republicans-energycommerce.house.gov/wp-content/uploads/2022/05/5.20.22-Letter-to-GAO.pdf)
美国三议员致信FDA局长和美国总审计长,欲对中国注册发难
2022年5月20日,美国E&C Republicans网站公布一则新闻,三位共和党人Cathy McMorris Rodgers 、Brett Guthrie和Morgan Griffith联名向美国食品药品监督管理局(FDA)局长Robert Califf发送了一封关于中国临床试验的信函。信中表达了对在美申报上市批准的药物的临床试验,越来越多仅在中国或者主要在中国进行的担忧,希望可以得到解答。 E&C成员提出了下述几项隐忧:
仅依赖于单一国家患者入组的临床试验可能无法代表美国患者群体。
数据质量,因为在中国进行的临床试验有伪造数据的历史记录。
E&C成员要求Califf局长在2022年6月3日之前,回复下述有关在中国进行临床试验的问题。(三位议员给Califf局长的信文末已附)
FDA共收到了多少仅基于或主要基于中国临床试验的生物制剂许可申请或药物申请?
在新冠流行之前,在2017年1月1日-2020年1月1日期间,中国有多少个临床试验点接受过FDA的检查?以及这些检查的结果是什么?
在向FDA提交的申请中,有多少中国临床试验点被确认有数据撤回?解决在这类试验点中发现的数据完整性问题需要采取哪些措施?在提交给监管部门,尤其是FDA的国际多中心临床试验中,是否有任何一个试验点贡献了大量的患者?
E&C成员同时也致函于美国总审计长Gene Dodaro,要求政府问责局 (Government Accountability Office,GAO)对FDA的生物研究监测计划(Bioresearch Monitoring Program,BIMO)进行审查,BIMO是FDA在批准之前确保药物安全和有效的关键组成部分。 “在过去的二十年里,临床研究变得更加全球化和复杂,越来越多地在美国以外的国家进行。日益全球化的趋势给FDA带来了许多挑战,包括需要对外国场所进行更多检查。GAO已经报告了对FDA监督日益全球化的药品制造供应链的能力的长期担忧,这是过去10年间GAO的高风险系列中强调的问题之一。GAO上一次报告是在2019年,表示在2015年,FDA对外国药品生产企业的检查总数已经超过了国内总数,FDA面临着与确定检查场所和对外国药品生产场所执行检查相关的持续挑战。然而,GAO先前的报告并未审查FDA确保来自临床试验和生物等效性研究(包括在海外进行的研究)的数据,作为品牌和仿制药申请的一部分,是否完整和准确的能力。” E&C成员要求审计长Dodaro审查BIMO计划,以确保在美国批准的药物安全有效,具体如下:
在BIMO计划下的对临床试验和生物等效性研究场所的检查,如何帮助FDA确保数据质量和数据完整性,这些数据提交给FDA用以支持药物申请。
FDA支持BIMO计划而对国内外场地检查的频率。
FDA在国内或海外实施BIMO项目时面临的任何挑战。
三位议员给Califf局长的信
翻译|写意君
尊敬的Califf博士,
写信给您,向您表达我们对在中国进行的临床试验增加的担忧 ,这些试验用来支持美国食品药品监督管理局(FDA)对医疗产品的批准,以及对FDA如何应对这一挑战的担忧。 2016年,23.8%的临床试验在美国启动,而在中国启动的只占12.5%。2017年,美国的试验启动占比稳定在23.7%,与此同时,中国的试验启动占比已经增长至15.5%。然而,到了2018年,情况急剧翻转。美国的试验启动占比下滑至21.6%,而中国的启动率则飙升至21.6%。短短两年,中国由原来只有美国的一半启动占比,发展到今日与美国持平。
在中国进行的临床试验激增同样也在FDA的提交申请中体现出来。例如,在涉及检查点抑制剂的肿瘤药物开发中,FDA已获知至少有25份计划提交或已经提交的申请,是基于仅来自中国或是主要来自中国的临床数据。其他检查点抑制剂在该疾病的结果公开后,许多中国的临床试验发起人开始在中国进行临床开发。
目前临床数据的“从东向西”运行并不主要关于创新,多数与FDA讨论的药物都在试图复刻已知进展,亦被称作“me too”药物,并没有满足未满足的医疗需求。这类药物不是生物类似药或仿制药,因此需要有完整的临床和非临床研究以及制造工艺开发。这类药物不能依赖于已经获批的检查点抑制剂所产生的信息。因此,存有大量重复以及问题获益的费用。
2022年2月10日,FDA的肿瘤药物咨询委员会(Oncologic Drugs Advisory Committee,ODAC)考虑了首例上述申请。这项申请涉及一项名为ORIENT-11的试验,该项试验将化疗联合PD-1单抗检查点抑制剂sintilimab,用于转移性非小细胞肺癌的初始治疗,与单独化疗进行了对比。出于对来自中国临床试验数据的担忧,ODAC以14比1支持FDA的立场,即需要额外的临床试验来证明该药物对美国患者和医疗保障的适用性。
中国的临床数据对美国市场上的药物提出了多样性问题。正如FDA官员Harpreet Singh和Richard Pazdur 近日所指出:
「仅仅依靠单一国家入组的试验欠缺种族性,对美国患者的种族代表性不够,尤其是针对目前具有未被满足临床需求的群体。发起人应当前瞻性地提出措施,确保入组患者对最终使用该产品的美国患者的代表性。因为来自单一外国的试验通常在种族和人群种族代表性上与美国不同,因为需要提供额外的数据,以确保产品结果对美国人群的适用性。」
另外,对于数据质量也有一些担忧。2016年的《英国医学杂志》刊登的一份报告指出,在中国进行的80%的试验中都存在数据质量问题。FDA表示,1622份申请中的1308份的数据应该被撤回,因为它们包含了临床试验中伪造、有缺陷或不充分的数据。然而,这份报告发表在5年之前,FDA官员承认相关人员已经采取努力来处理这些问题。总而言之,FDA表示,希望探索特定试验中的任何场所是否涉及这类撤回,以及采取了哪些措施对具体情况进行纠正。
鉴于以上担忧,请于2022年6月3日提供以下内容:
1.FDA共收到了多少仅基于或主要基于中国临床试验的生物制剂许可申请或药物申请?
2.在新冠流行之前,2017年1月1日-2020年1月1日期间,中国有多少个临床试验点接受过FDA的检查?以及这些检查的结果是什么?
3.在向FDA提交的申请中,有多少中国临床试验点被确认有数据撤回?解决在这类试验点中发现的数据完整性问题需要采取哪些措施?在提交给监管部门,尤其是FDA,的国际多中心临床试验中,是否有任何一个试验点贡献了大量的患者?
如果您有任何问题,请与少数民族委员会(Minority Committee)的工作人员Alan Slobodin联系。谢谢您对于这则请求的关注。
Sincerely,
Cathy McMorris RodgersBrett GuthrieH. Morgan Griffith




 产业资讯
产业资讯
 药渡
药渡  2025-11-07
2025-11-07
 83
83

 产业资讯
产业资讯
 药时代
药时代  2025-11-07
2025-11-07
 92
92

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-11-07
2025-11-07
 84
84