 产业资讯
产业资讯
 研发客
研发客  2022-06-09
2022-06-09
 3729
3729
• CDE首次针对双抗产品开发出台技术指导原则。
• 开发双抗的中国企业增多,临床试验进展主要在I期和II期,且基本在中国开展。
• “双抗的出现,本身就是要解决单抗或单抗联合用药在临床上不足以充分发挥治疗效果的问题。”
• 耐药性、安全性等需要开发企业重视。
在尚无本土双抗产品获批上市的国内,国家药监局药审中心(CDE)已经提前动手,发布了双抗类肿瘤药研发技术指南的征求意见稿。
《双特异性抗体类抗肿瘤药物临床研发技术指导原则(征求意见稿)》(以下简称《指导原则》)是首次针对双抗产品开发的技术指导原则,意味着国家药监局药审中心(CDE)对这类药物临床开发价值的充分认可和鼓励,同时提前规范研发秩序,减少企业的盲目开发行为。
眼下,双抗是全球抗肿瘤新药的研发热点之一,立项和临床试验数量正快速增长。迄今为止,在全球获批的双抗产品并不多,包括已经退市的首款双抗药在内,全球只有五只双抗产品获批。
“较早获批的双抗产品来自欧洲、美国和日本,并没有中国创新药的身影,但这种情况将发生改变。”徕博科医药研发日本(Labcorp Drug Development Japan)临床开发高级战略总监高野哲臣(Tetsuomi Takano)说。高野哲臣长期关注中国药政法规和行业。

徕博科医药研发日本(Labcorp Drug Development Japan)高野哲臣
高野哲臣用三个英文关键词“Bispecific antibody”和“Industry” 和“Recruiting or Not yet recruiting”整理了截至2022年5月22日各国在ClinicalTrials.gov登记的双抗临床试验数量(见下图)。
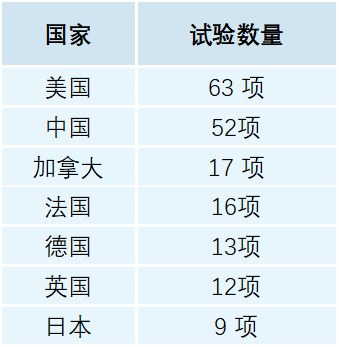
“如同PD-1/PD-L1和CAR-T,美国和中国的双抗类药物试验数量遥遥领先。”高野哲臣说。
自罗氏的emicizumab在2018年中国上市成为中国第一个双抗药物以后,百济神州、康方生物、康宁杰瑞、信达生物、复宏汉霖等企业相继建立了自己的双抗产品管线。头部企业研发进度较快,中国公司与国外公司围绕双抗的合作交易也越来越多。
高野哲臣说,《指导原则》出台得非常及时,既有前瞻性也与国际接轨。美国 FDA在去年5月25日发布了Bispecific Antibody Development Programs Guidance for Industry(双特异性抗体临床开发指南),《指导原则》发布距此未及一年。
“《指导原则》之所以在中国发布得这么快,是因为目前开发双抗的中国企业越来越多,中国监管机构、行业和医疗机构都迫切需要制定相应的指导原则。”他说。
在和铂医药创始人、董事长兼首席执行官王劲松博士看来,《指导原则》与CDE最近出台的一系列政策一脉相承,其主旨跃然纸上,即以患者利益为核心的新药开发。

和铂医药 王劲松博士
“CDE提醒我们,任何立题设计都要具备科学依据,抗体药研发也不例外,申请人没有捷径可走。中国的双抗企业要有清晰的开发思路和能力,致力于为患者提供独特的临床价值。”王劲松博士说。
“否则大家一拥而上,做出重复、低质量的产品,只会稀释临床资源,反而让那些真正有价值的好产品因临床资源分散、病人招募困难而无法开展临床试验,最终不能造福患者。”他说,“CDE这一指南提前敲响了警钟。”
和铂医药最近与阿斯利康就前者研发的CLDN18.2xCD3 双抗产品HBM7022达成全球对外授权协议。阿斯利康将获得HBM7022的研究、开发、注册、生产和商业化的全球独家许可,并负责该药后续的所有费用。早前,和铂医药还与再鼎医药、东曜药业、正大天晴等公司展开了双抗产品方面的合作。
1+1>2的临床优势
《指导原则》就临床试验风险控制、最佳给药策略、临床试验设计、免疫原性、生物标志物开发等方面提出了说明(详见下表):
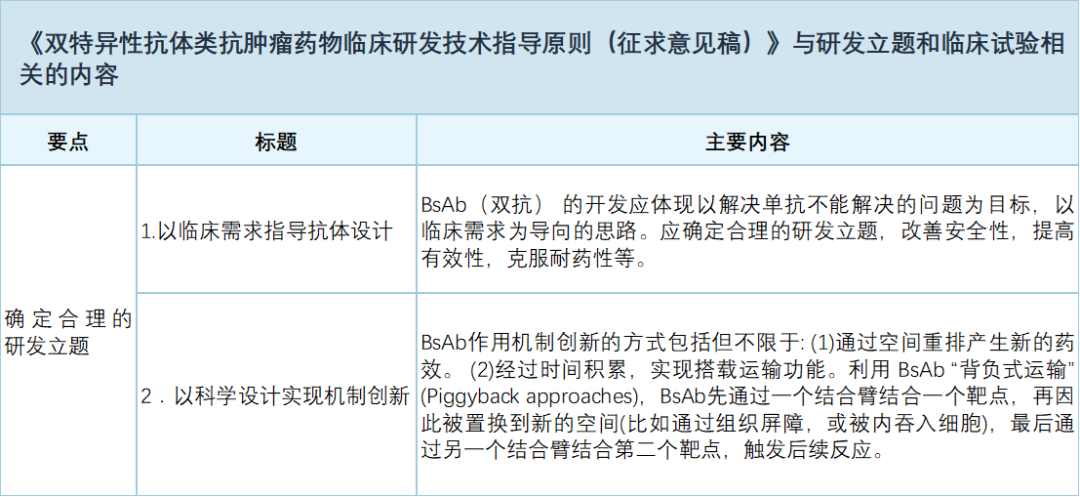


单抗类抗肿瘤药物的临床研发思路与技术要求已较为成熟,但对于针对多个抗原的双抗,由于结构与功能存在特殊性,因此在临床研发中,有其特殊考虑要点。
“如果抗体分子只像玩乐高一样随机组合,对病人来说十分危险。我主张1+1>2的概念。一个好的双抗产品,必须要有独特的生物学机制、创新的分子模块、CMC生产制造和市场策略,最后形成疗效和安全性更优的产品,达到单抗无法达到的临床优势。”
“如果只是两个抗体的堆砌,不会产生生物耦合性, 更没有治疗价值。但如果把这两个抗体分子经抗体工程设计成有高效功能的双抗,就形成了从0到1的创新生物学机理的突破。”王劲松博士说。
《指导原则》对于对照组的考量
《指导原则》对对照组的要求是产业重要关注点之一。《指导原则》指出,应选择最优标准治疗(SOC)为对照组,并列举了3种情形的对照组要求(详见上表)。这会不会为双抗药物开发带来挑战?
王劲松博士认为,任何一个药物开发,不管是单抗、双抗、多抗、ADC,还是其单药或联合用药,必须证明在现有治疗标准上提供进一步改善的证据,要么更安全、要么更有效和使用更方便。增加病人依从性准则,是制药最基本要求,也是NMPA和全球药监机构一贯的要求。
“只是现在分子设计之间的差别越来越小,与现有治疗方案相比较,更细化和精准我觉得这非常合理。正如前面提到的1+1>2的原则,双抗就是要解决单抗或联合用药无法解决的问题,那么就要不惧与单抗或联合用药做头对头比较。”
一旦对比研究成功,挑战将转化为机遇:成为新的SOC。
对双抗企业的建议
王劲松博士认为,双抗研发企业需要谨记:
一是任何新的技术发现都要看最终在临床上是否为病人带来价值,这个价值通过什么方式体现。对双抗而言,通过创新分子机制的开发和构建打造全新分子,能开拓一条新路径,增加双抗的疗效和安全性。
二是双抗分子的设计和开发要遵循为患者带来临床价值的理念,设计出优异分子。
三是监管部门对抗体药的安全性重视程度很高。安全性问题如果通过双抗设计得以解决,有其独特价值。
高野哲臣还提醒说,国内的双抗药物临床试验主要集中在I期和II期,且基本在中国开展,16家中仅有一家正在开展国际多中心临床试验。不过,一些中国企业及时采取了策略调整,在美国也开展了单独的临床试验。他认为,如果中国企业继续严重依赖中国本土试验,未来在海外获批的可能性不大。
“抗体药未来发展将基于科学技术、基于团队、基于平台,研发出好产品,才有可能得到跨国制药公司的青睐。”王劲松博士说,他希望随着《指导原则》的落地,中国双抗企业必将更科学有序发展,在国际上占有一席之地。

 产业资讯
产业资讯
 药渡
药渡  2025-11-07
2025-11-07
 66
66

 产业资讯
产业资讯
 药时代
药时代  2025-11-07
2025-11-07
 74
74

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-11-07
2025-11-07
 65
65