 产业资讯
产业资讯
 研发客
研发客  2022-06-17
2022-06-17
 3037
3037
进一步完善和优化加快审评审批制度,促进行业推出更多具有明显临床价值的药品,满足尚未满足的患者用药需求。
撰文

曹海峰
瑞石生物医药有限公司法规事务部副总裁

朱林
恒瑞医药注册事务部总监
去年以来,加快建设以临床价值为导向的药品研发和审批审评制度,是配置审评审批优势资源向临床急需的创新药申请倾斜的必要措施,也关系到申请人的切身利益,其重要性不言而喻。加快审评审批,作为药审改革中比较有突出代表性的一环,同样经历了多轮调整和发展。
关于加快审评审批制度的变化,一些监管专家发表了相应文章,如2007年和2020年发表在《中国新药杂志》上由高磊、邸云瑞、黄清竹撰写的《我国药品注册优先审评制度的进展与相关考量》和由王婧璨、温宝书和蒲嘉琪撰写的《从新版<药品注册管理办法>看我国药品优先审评审批制度的变化》等,权威严谨,值得学习。
在药政改革的大背景下,我国药品加快审评审批制度有着比较清晰的发展轨迹,本章节从注册申请人的角度简要描述了我国药品加快审评审批制度的变迁,温故知新,立足当下,展望未来。
加快审评审批阶段梳理
伴随着《药品管理法》和《药品注册管理办法》等法律法规的修订,我国药监部门发布了一系列加快审评审批的配套文件,勾勒出了这一制度不同阶段发展完善的过程。每一阶段的优先审评审批政策既是以往实践经验的总结,也是在引导未来方向。
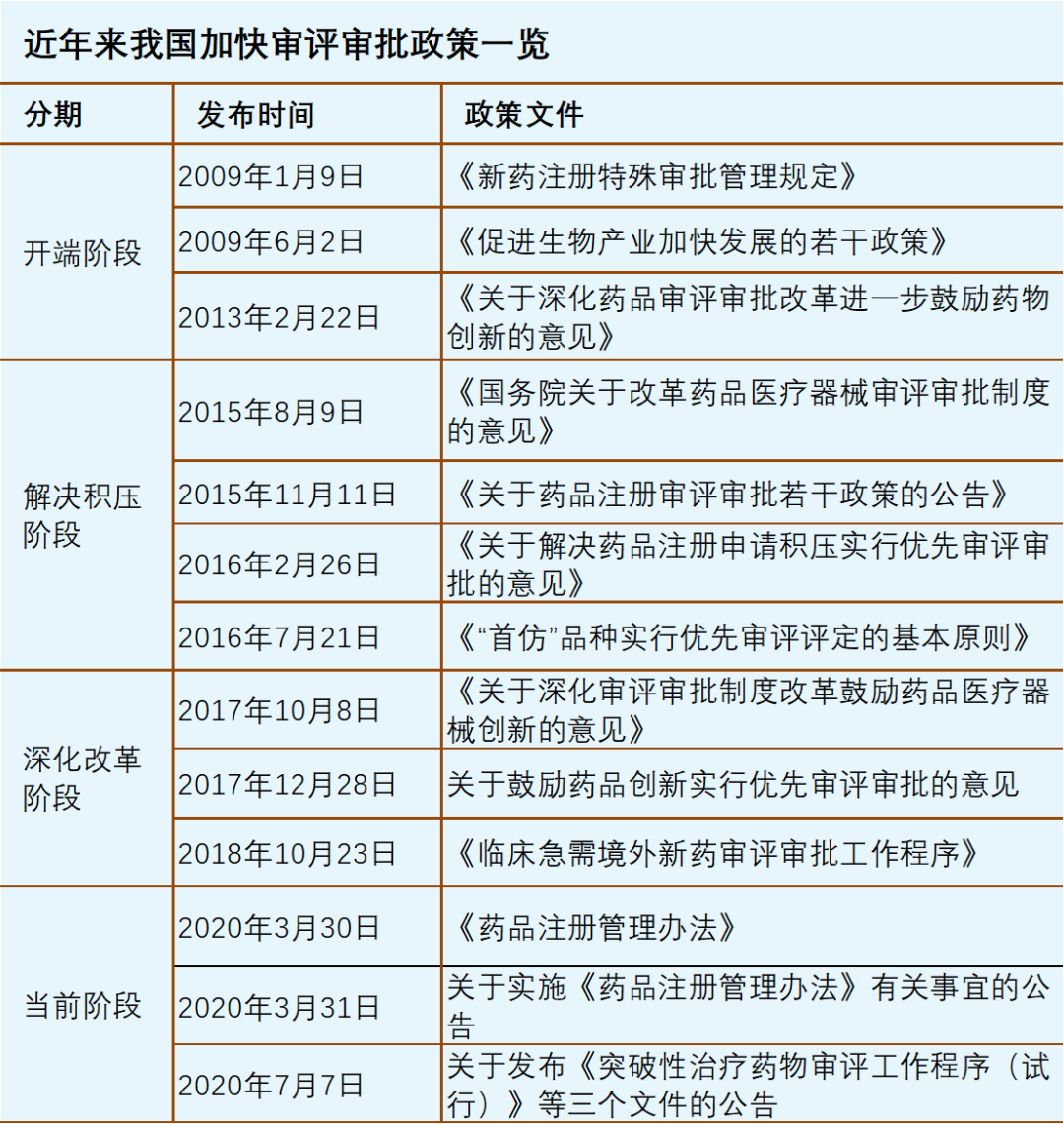
1.开端阶段(2015年8月前)
《新药注册特殊审批管理规定》是在2007版《药品注册管理办法》框架下制订的。这一时期国内已在一定程度上解决了药品短缺难题,开始谋求提高研发水平和层次。《新药注册特殊审批管理规定》规定了4种特殊审批情形,均定位为“新药”,尤其针对尚无有效治疗手段的新药,分别规定了在新药临床试验申请和申报生产时可申请特殊审批的情形。新药特殊审批制度在当时具有鲜明的意义,高瞻远瞩,将其作为我国加快审评审批制度的开端实至名归。
在开端阶段,2013年发布的《关于深化药品审评审批改革进一步鼓励药物创新的意见》对加快审评提出了更高要求,扩展了其内涵,确立了创仿并举和以临床价值为导向的审评理念。对于纳入加快审评的创新药,《关于深化药品审评审批改革进一步鼓励药物创新的意见》要求“早期介入、分段指导和沟通交流”,将沟通交流提高到制度层面,不再局限于审评审批时限的缩短,为当前阶段已实施的“突破性治疗药物程序”积累了宝贵经验。
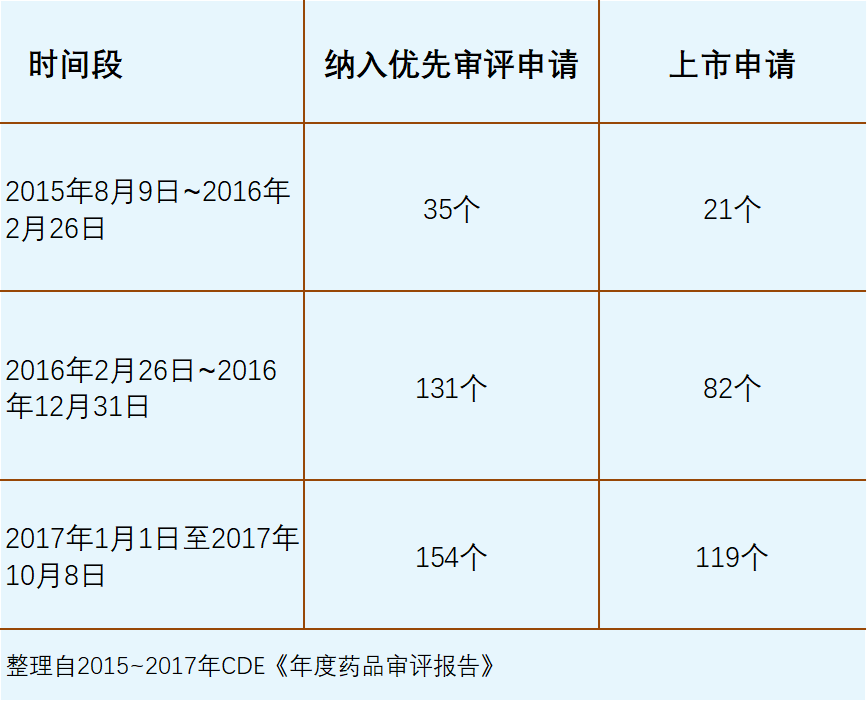
2015年8月《国务院关于改革药品医疗器械审评审批制度的意见》发布,标志着开端阶段结束,新一轮药品审评审批改革启动。在加快审评制度的开端阶段,据不完全统计,自2011年1月至2015年8月累计纳入优先审评申请114个(以下均以受理号计),其中上市申请87个。
2.解决积压阶段(2015年8月~2017年10月)
国内审评审批资源相对紧缺,药品注册申请长期积压,是这一阶段中国制药全领域的痛点。为了解决积压,监管部门抽调社会专家补充审评资源形成专项组,实施“集中审评”。这种工作方式极大考验着监管部门责任和担当。这一时期的加快审评审批政策有着深刻的解决积压的历史烙印。
2016年发布的《关于解决药品注册申请积压实行优先审评审批的意见》延续了对鼓励创新、临床急需的相关条款,保证这一类药品注册申请避开了积压的审评队列影响。这在解决积压的特殊历史时期,非常难能可贵。在药品审评审批改革即将进入高潮期的时刻,监管部门交出了完成解决积压和保障优先审评审批两份满意的答卷。
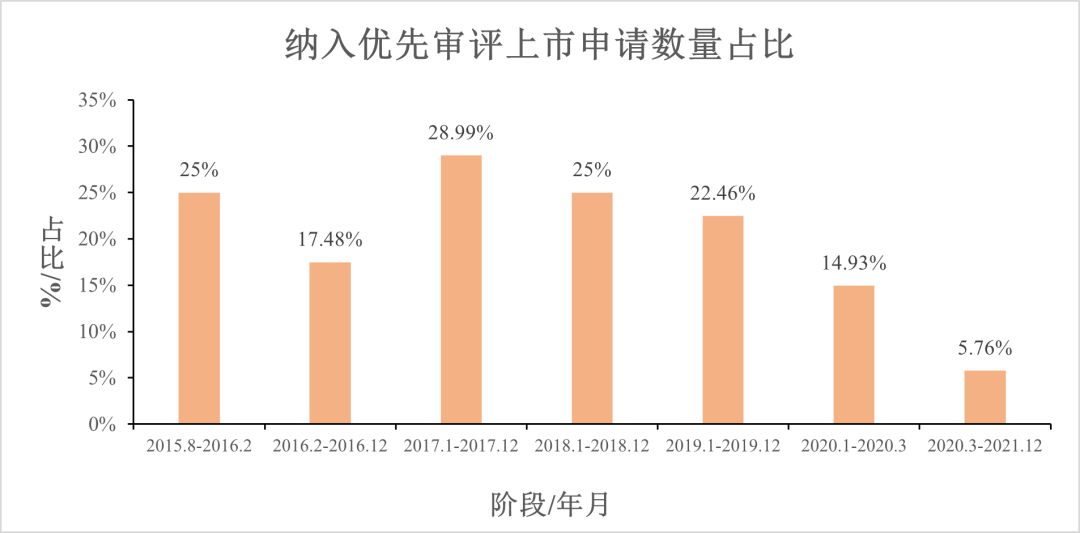
解决积压阶段的优先审评审批范围,相比2015年之前明显扩大(见下图)。
3.深化改革期(2017年10月~2020年1月)
经过监管部门和借调审评专家多年不计辛劳的付出和努力,药品注册申请从2015年高峰期的25,000件削减到2017年10月的7,500件,为按时限审评及其他一系列改革创造了条件。
2017年10月国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,将药政改革推向了高潮。在深化改革阶段,加快审评审批延续了上一阶段的主要制度,并在境内已有实践基础上,将附条件批准正式写入法规。
2018年7月《关于调整药物临床试验审评审批程序的公告》发布,药物临床试验申请的审评时限缩短为60个工作日之内,告别了需要9~18个月左右才能完成临床试验审评审批的年代。加快审评制度的范围也随之相应调整,除艾滋病药物等特殊情形外,药物临床试验申请已无需再被继续纳入优先审评审批范围。
加快审评制度内涵丰富、范围扩大,从2015~2019年每年纳入优先审评的上市申请占全部上市申请数量的约1/4。新的挑战随之而来。审评积压解决后,借调的审评专家回归本职工作,监管部门自有审评资源的建设当时尚未完善。对“快车道不快”的担忧越来越明显,一度有专家和同仁呼吁在快车道之外再建一条“更快”的车道。2018年10月国家药监局《临床急需境外新药审评审批工作程序》发布,对部分临床急需境外新药开辟了更快的程序,在一定程度上回应了这一关切。对优先审评审批制度优化,“让快车道快起来”已迫在眉睫。
4.当前阶段(2020年3月至今)
《药品注册管理办法》(于2020年3月30日发布并于2020年7月1日施行,加快审评制度得到进一步优化,趋向成熟。
当前阶段的加快审评制度,除应对重大突发公共卫生事件的特别审批程序外,主体上确立了“突破性治疗药物程序”、“附条件批准程序”和“优先审评审批程序”三大程序,从临床试验期间到上市许可申请审评审批期间,全方位多渠道的体现加快审评审批政策的优势。
优先审评审批程序与既往相比,(1)对以临床价值为导向的坚持一以贯之;(2)纳入条件有较大调整,门槛提高;(3)仅针对上市许可申请;(4)回归以新药为主;(5)兼顾部分仿制药。
笔者简要对加快审评制度在当前阶段实施实践予以总结分析如下:
4.1 纳入突破性治疗药物程序情况
据不完全统计,截至2021年11月,自修订版《药品注册管理办法》颁布以来,合计63个药品获得了突破性疗法资格认定。
(1)国产药品的数量略多于进口药品获得突破性治疗药物资格认定的数量。这与自2015年药品审批审评改革以来,在大环境利好的情况下,国内创新药物研发呈快速增长趋势是相符的,而且国内创新药物不仅在数量上增长,其质量也在稳步提高。
(2)尽管大分子药物的研发投入持续提升,小分子药物仍有相当数量。
(3)近年来,研发热点肿瘤领域的新药获得突破性疗法资格认定的数量高于非肿瘤领域药物。

4.2 药品附条件批准程序
截至2021年11月,自新版《药品注册管理办法》颁布以来,共有47个药品依据附条件批准程序获得上市批准。具体情况如下:
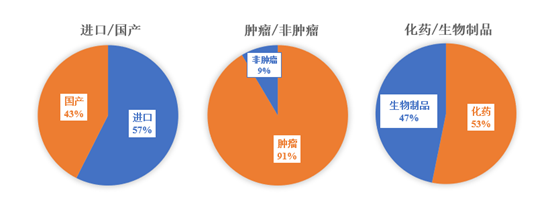
(1)进口药品略多于国产药品获得附条件批准
按照《药品注册管理办法》规定,对于境外获批的治疗罕见病药物,在充分评估种族差异风险后,可以附条件先行批准上市。此类批准并非真正意义上附条件批准程序中所规定之情形,即基于替代终点、中间临床终点或早期临床试验数据附条件批准产品上市。
(2)大分子和小分子获附条件批准数量相当
(3)肿瘤药品占附条件批准数量的绝大多数
肿瘤药品是研发热点,数量高于非肿瘤药品,但目前其所占研发药物比例高达90%还是值得思考。非肿瘤新药难以获得附条件批准可能在于,附条件批准相较突破性疗法,将适用疾病限定为严重危及生命的疾病。按照附条件批准上市指导原则中,对严重危及生命的定义,是指若不尽早进行治疗会在数月或更短时间内,导致患者死亡的疾病或疾病的某个阶段,例如晚期恶性肿瘤等。这极大限制了很多治疗慢性疾病的非肿瘤药物纳入附条件批准。
4.3 优先审评审批程序
(1)门槛提高,数量下降
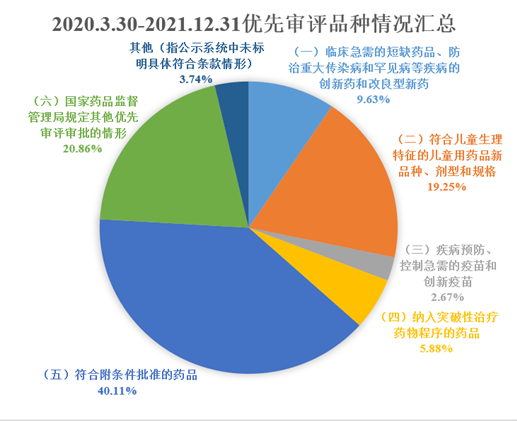
2020年3月至2021年12月底,纳入优先审评审批的注册申请占总上市申请的数量降低到约5.76%,这是优先审评审批门槛提高的直观表现。
(2)以新药为主,兼顾仿制药
当前,优先审评审批制度的六大条款中,纳入优先审评审批程序的仿制药,仅有临床急需的短缺药品、符合儿童生理特征的儿童用药品,和理论上存在的“公共卫生方面急需的药品”等情形,这些情形均需要国家卫健委等部门首先认定,能够获得优先审评审批资格的仿制药微乎其微。
(3)特别说明
自2020年3月至2020年底,CDE网站未标明具体优先审评条款的,纳入“其他”统计后,我们发现以“其他”情形纳入审评审批的占比高达31.43%。
笔者分析,这些高占比的其他情况包括了大量具有明显临床价值但境外已上市的进口原研药品,如:属于CDE发布的三批《临床急需境外新药名单》中的罕见病进口原研药品、境外已上市且在卫健委发布的《第一批罕见病目录》中的进口原研药品、境外已上市防治重大传染病的进口原研药品、境外已上市但疗效突破的进口原研药品,还有部分具有临床优势但在突破性治疗药物程序发布以前已经进入Ⅲ期临床的国产创新药。
这些特殊情形的优先审评审批情形,是监管部门负责任的体现,不因法规过渡期和法规名词解释等问题,阻碍技术上符合条件的注册申请纳入优先审评审批。
未来期望
随着实践的发展,虽然我国药品加快审评审批制度已日臻成熟完善,但依然有部分期望进一步完善的建议:
1.突破性治疗药物、附条件批准程序认定结果反馈
突破性治疗药物、附条件批准程序均为2020年7月发布实施,申请人和监管部门对纳入的突破性治疗药物、附条件批准的具体标准还在摸索和积累过程中。除抗肿瘤适应症发表了部分具体可量化的疗效突破标准以外,其他尚未见权威报道。对于监管部门内部认定的依据,期盼能定向反馈申请人,便于申请人理解,或可进一步积累数据达到标准后,再次申请纳入突破或附条件批准程序。
2.追加突破
当前,优先审评审批纳入的条款之一为“纳入突破性治疗药物程序的药品”,也就是并非达到疗效突破的标准就能按这一条款纳入优先审评审批,而是强调必须首先“纳入突破性治疗药物程序”才可以在上市许可时申请纳入优先审评审批程序,这成为申请人提出纳入突破性治疗药物程序申请的主要动力。
《突破性治疗药物审评工作程序(试行)》规定“申请人可以在Ⅰ、Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前申请适用突破性治疗药物程序”,这直接凸显了“追加突破”程序的重要性。实践过程中存在着两种情形,一方面在《突破性治疗药物审评工作程序(试行)》前已进入Ⅲ期临床试验的新药,另一方面在早期并未观察到但Ⅲ期却证明了足够突破疗效的新药。这些新药也需以“纳入突破性治疗药物程序”纳入优先审评审批。2020年审评专家针对抗肿瘤适应症发表了文章,论述了可以实施“追加突破”认定的情形,但“追加突破”对肿瘤以外其他适应症适用与否,尚未见权威报道和解读。
3.借用境外数据申请纳入突破性治疗药物程序
突破性治疗药物是基于早期临床数据来预测药物是否具有显著临床治疗优势,其本质是预测药物的整体有效性。建议对于尚无中国人数据,但在境外进行的临床研究中已显示显著临床优势的药物,应给予突破性治疗药物认定。后续根据种族敏感性研究和分析,再决定是否继续适用突破性治疗药物程序。
4.严重影响生存质量的疾病可否纳入附条件批准
当前已发布的《药品附条件批准上市技术指导原则》的适用范围与突破性治疗药物程序不同,附条件批准的范围未包括“严重影响生存质量的疾病”,如系统性红斑狼疮、阿尔茨海默症等虽然不是严重危及生命但是严重影响生存质量,且有很大社会和临床需求的疾病,建议进一步探讨附条件批准的适用性。
5.明确附条件批准上市药品,其他在研同适应症药物的“关门”规则
建议在附条件批准上市药品转为正式批准以前,其他在研同适应症药物,可以以同等标准申请附条件批准。已按附条件批准程序受理的上市注册申请,继续按附条件程序审评审批,其技术要求不因同适应症药物转为正式批准而变化。如果其他在研适应症药物不能获得附条件批准,建议CDE能够明确不予批准的标准和要求并提前告知申请人,以减少申请人重复研发立项的可能性。
6.适当丰富优先审评条款
(1)罕见病的认定有其复杂性,往往历程较长,改为“罕见疾病”,符合审评审批需求。现已发布《罕见疾病药物临床研发技术指导原则》等指导原则,建议将罕见疾病创新药和改良型新药纳入优先审评审批范围。
(2)在上市审评期间纳入优先审评审批的,符合临床短缺和罕见疾病条件的药品,将其上市后变更依然纳入审评审批程序。
展望未来,业界期望共同积累经验,提出更加符合新药研发规律的合理化建议,为完善加快审评审批制度建设,推出更多具有明显临床价值的药品。

 产业资讯
产业资讯
 清科研究
清科研究  2025-08-02
2025-08-02
 30
30

 产业资讯
产业资讯
 空之客
空之客  2025-08-02
2025-08-02
 33
33

 产业资讯
产业资讯
 医药魔方
医药魔方  2025-08-02
2025-08-02
 33
33