 产业资讯
产业资讯
 同写意
同写意  2022-07-13
2022-07-13
 3111
3111
几十年来,科学家们一直在研究如何修饰基因,或用健康基因取代有缺陷的基因,以此治疗、预防疾病。为了将新基因直接植入细胞,科学家们使用了一种被称为“载体”的工具,通过基因工程传递基因。
目前,FDA已批准23种细胞与基因疗法。而作为其中最成熟的技术,医学界和投资界均对CAR-T疗法寄予厚望,认为其有望成为继PD-1抗体之后的下一个重磅产品。更有人预言,它可能成为中国生物技术反超海外的重要赛道。
然而,CAR-T疗法总与“天价药”挂钩。国外定价最低的是日本市场,约32万美元,折合人民币近217万元。据报道,诺华推出的Kymriah、吉利德推出的Tecartus定价分别为37万美元、47万美元,但最终病人的治疗可能需要80-150万美元。除了药物本身,相关检查、住院、可能的副作用管理也是一笔费用。
在中国,现阶段向CDE提出IND申请的CAR-T疗法共有70多种,已有两款CAR-T疗法获批上市:复星凯特的阿基仑赛注射液和药明巨诺的瑞基奥仑赛注射液,单价分别为120万元和129万元,大约只有日本市场的一半价格。
尽管如此,同写意获悉,复星凯特和药明巨诺的产品商业化仅做了不到500例,而中国每年大约有3-5万血液淋巴系统肿瘤患者需要进行CAR-T治疗,市场需求很大。但在本土市场,120万元的自费药品,可能只有不到10%的人能负担。
中国以CAR-T为代表的细胞基因疗法商业化仍在起步的探索阶段,我们不妨先把视线转向美国。FDA现阶段批准的CAR-T产品商业化情况如何?
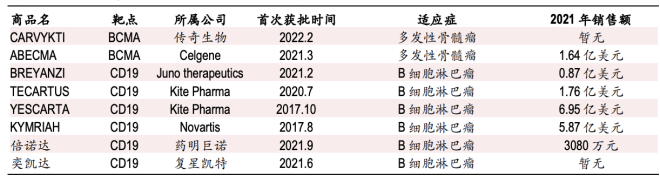
已上市的CAR-T药物2021年销售情况(来源:中银证券)
Carvykti :定价46.5万美元,暂无销售数据
今年2月,Carvykti获FDA批准上市:用于治疗既往接受过4种或4种以上治疗(包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体)的复发或难治性多发性骨髓瘤(R/R MM)患者,上市时定价为46.5万美元。Carvykti是首款获得FDA批准的国产CAR-T细胞疗法,也是全球第二款获批靶向BCMA的CAR-T疗法。
传奇生物与强生于2017年12月签订了全球独家许可和合作协议,以开发和商业化Carvykti。
传奇生物CEO黄颖曾透露,传奇生物与强生之间关于Carvykti的商业化合作模式为“分而治之”。
传奇生物搭建起了一个小而精的营销团队,目标是美国大型医院的多达80个治疗中心。除了销售人员以外,这个队伍还包含了护士教育者和医学联络员,以帮助培训护士和医生关于Carvykti的使用方法以及如何管理副作用。
至于传奇生物的伙伴强生,他们的主要工作集中于社区医疗机构。其销售团队服务于约5000位血科专家,目的是让这些医生将符合Carvykti适用条件的患者转移到治疗中心。不光于此,强生还拥有专门的细胞治疗场地来帮助Carvykti在医院市场的推广。此外,过去一年,强生已经与美国所有大型商保公司有所接触。
成功闯关FDA的Carvykti,使得传奇生物成为本土创新的成功典范。但是Carvykti在中国市场的潜力如何,目前尚不确定。
Abecma:41.95万美元/针,2021年销售额达1.64亿美元
Abecma是BMS和蓝鸟生物共同开发、共同推广和利润分享协议的一部分,双方在美国市场联合开发和商业化Abecma。BMS将全权负责Abecma在美国以外地区的生产和商业化。
作为基于基因改造的CAR-T细胞疗法,Abecma用于治疗多发性骨髓瘤(MM)的特定成年患者群体,曾被FDA授予“孤儿药和突破性疗法”资格认定。
去年3月,Abecma以首个靶向BCMA的CAR-T疗法获得FDA批准上市,定价为41.95万美元/针,2021年销售额达1.64亿美元,2022年第一季度销售额为6700万美元。
Abecma放量还在继续,2021年,蓝鸟生物将肿瘤管线拆分成立独立公司2seventy bio,Abecma也被划入其中。为了应对市场需求,2seventy bio和BMS着手提高整个供应链的能力。此外,Abecma已被批准用于多发性骨髓瘤患者的第四线或更晚的治疗,BMS正计划迅速扩大这一项目以期获得更多市场份额。
根据2seventy bio在1月的一份新闻稿,基于Abecma的临床数据和较高的商业利益,2seventybio和BMS不打算进一步开发下一代抗BCMA CAR-T bb21217,尽管在进行的CRB-402临床研究中证实了其具有更多幼稚T细胞表型的假设,并为实现完全反应的患者提供了令人鼓舞的反应持久性。
公开资料显示,2020年,MM药物全球市场规模约为99亿美元,至2027年,将会达到271亿美元。如此巨大的市场里,强生的Daratumumab单抗几乎占据了半壁江山,势头强劲,Abecma在市场上可能会面临不小的竞争。
Breyanzi:41.03万美元/针,2021年销售额为0.87亿美元
去年2月,Breyanzi成为第四个获得FDA批准的CAR-T疗法,也是BMS的首款细胞疗法,首次获批适应症为B淋巴细胞癌、弥漫性大B细胞淋巴癌、滤泡中心淋巴癌、高级别B细胞淋巴瘤、原发性纵隔大B细胞淋巴癌。
根据BMS官网,今年6月,FDA批准Breyanzi作为复发或难治性大B细胞淋巴瘤(LBCL)的二线治疗。目前,Breyanzi的定价为41.03万美元/针,2021年销售额为0.87亿美元;2022年第一季度销售额为4400万美元。美国的商业和政府保险计划已经覆盖了Breyanzi的报销。
BMS位于华盛顿州Bothell的工厂也已为商业化生产做好了准备,其位于新泽西州的工厂正在进行转型,该工厂原进行早期临床试验用药物生产。
此外,BMS在马萨诸塞州也有一家工厂,另外还有一个新建的欧洲生产基地。BMS表示,其目标是将所拥有的CAR-T疗法生产周期缩短一半以上。BMS位于马萨诸塞州Devens的工厂将于今年底完工,最终将承担其大部分商业细胞治疗制造业务。
Tecartus:37.3万美元/针,2021年销售额为1.76亿美元
2020年10月,吉利德旗下Kite Pharma的CAR-T疗法Tecartus获得FDA批准。截至目前,Tecartus已获批两项适应症:用于治疗先前接受过2种或多种系统疗法(包括一种BTK抑制剂)的复发或难治性套细胞淋巴瘤(R/R MCL)成人患者、用于治疗复发或难治性前体B细胞急性淋巴细胞白血病(B-ALL)成人患者。
Tecartus是第一个被批准治疗复发或难治性套细胞淋巴瘤(R/R MCL)的CAR-T细胞疗法,也是第一个被批准治疗急性淋巴细胞白血病(ALL)成人患者的CAR-T疗法。定价上,Tecartus的费用为37.3万美元/针。
业绩表现上,Tecartus在2020年销售额为0.44亿美元,2021年销售额为1.76亿美元,2022年第一季度销售额为0.63亿美元。
Yescarta:37.3万美元/针,2021年销售额为6.95亿美元
Yescarta也是Kite Pharma的CAR-T疗法,于2017年10月首次被批准用于治疗至少两种其他治疗失败后的成人大B细胞淋巴瘤。
2021年3月,Yescarta还被批准用于治疗经过两线或多线全身治疗的复发性或难治性滤泡性淋巴瘤(FL)成人。今年4月,FDA批准Yescarta用于一线化疗免疫疗法难治或一线化疗免疫疗法后12个月内复发的LBCL成年患者。此次批准也意味着,Yescarta成为全球首款获得FDA批准作为LBCL二线疗法的CAR-T药物。目前,Yescarta的定价为37.3万美元/针。
上市以来,Yescarta的销售额一路攀升,2020年创造了5.63亿美元的销售额,2021年销售额进一步增长至6.95亿美元。尽管成绩骄人,但考虑到吉利德收购Kite高达119亿美元的成本,这样的业绩表现仍使部分业界人士质疑并购的合理性。
去年12月,Kite和第一三共公司宣布,Yescarta将通过第一三共授权的第一个治疗中心向日本的复发或难治性大B细胞淋巴瘤患者提供治疗。Kite和第一三共还将在2017年1月正式签订的日本Yescarta商业化权独家许可协议的基础上进一步加深合作。
目前,复星凯特已从Kite引进该CAR-T疗法,并在国内获批上市,成为国内首款上市的CAR-T疗法。
Kymriah:47.5万美元/37.3万美元,2021年销售额为5.87亿美元
诺华的Kymriah于2017年8月成为FDA批准的首款CAR-T细胞疗法,首次获批适应症为难治或至少接受二线方案治疗后复发的B细胞急性淋巴细胞白血病(ALL),定价高达47.5万美元/针,摘得最贵CAR-T疗法之名。
2018年,Kymriah获批第二项适应症,用于治疗大B细胞淋巴瘤(DLBCL)患者,定价为37.3万美元/针。
可以说,诺华业绩增长点其一来自Kymriah。2020年尽管受到COVID-19的严重影响,Kymriah销售收入仍然实现了68%的较高双位数的增长,达到4.74亿美元;2021年的销售额为5.87亿美元。诺华目前在全球有290家合格的CAR-T治疗中心,有27个国家批准了Kymriah至少一项适应症。
Kymriah上市几年来,一方面为了进一步解决生产制造问题,另一方面也为在全球范围内扩大商业化做准备,诺华已全面在世界范围铺开其CAR-T生产工厂,从美国的生产工厂开始,已扩展到欧洲、中国、日本和澳大利亚等多个地点。
由于COVID-19疫情造成物流方面的挑战阻碍了Kymriah的推广,诺华希望通过上述方法迅速扩大这种疗法的地理足迹。
他山之石:CAR-T疗法的商业化出路
细胞与基因疗法商业化闭环难在哪?
哈尔滨血液病肿瘤研究所所长、CSCO监事会监事长马军认为,制约CAR-T疗法商业化的一大原因在于当前的应用空间。换言之,如果CAR-T疗法能进入实体瘤,突破对晚期的胰腺癌、胃肠和消化道肿瘤、宫颈癌、卵巢癌、肝癌等这些治疗瓶颈,进入泛瘤种才可能会赚钱。
药明巨诺首席商务官兼SVP吴琼指出,CAR-T疗法的销售环节是非常最复杂的,他用Physician、Patient、Provider 、Partner、Policy maker和Payer六个环节来描述这种处境。这意味着,CAR-T疗法的商业化可能比其他药品更多牵涉外部合作。
全球范围来看,目前已上市的CAR-T疗法销售收入呈现出良好的增长趋势。不同产品的商业化过程各不相同,似乎都还在摸索中。但可以肯定的是,创新药的可持续发展,离不开支付方推动。
2019年2月,美国医疗保险和医疗补助服务中心(CMS)宣布,不仅报销CAR-T疗法的费用,还将支付包括药物管理、细胞的收集和处理、细胞的回输、以及门诊或者住院的所有相关服务与治疗费用。
美国之外,2018年9月,英国国家医疗服务体系(NHS)与诺华就Kymriah达成保险覆盖协议,这也标志着欧洲国家首次同意为CAR-T疗法提供资金。同年11月、12月,英国国家卫生与临床优化研究所(NICE)决定推荐Kymriah、Yescarta用于患者治疗,后者可通过癌症药物基金会(CDF)获得相关疗法。
同样在2019年2月中旬,苏格兰药品联合会(SMC)批准Kymriah纳入苏格兰国家医疗服务体系(NHS),以用于25岁以下患有复发或难治性B-ALL患者。
而作为首个批准CAR-T疗法的亚洲国家,日本中央社会保险医疗协议会2019年5月批准Kymriah上市,并于同月起纳入医保,定价约3350万日元(约合人民币210万元)。
中国保险市场虽相对迟缓,但已经看到有所行动。中国保险协会核心专家、国家卫生健康委卫生发展研究中心客座研究员邵晓军分析,商保纳入CAR-T疗法,一方面是将其纳入到百万医疗中的特药险,另外一方面是惠民保。目前,包括浙江、上海的惠民保在内,全国共有18个省市惠民保已覆盖CAR-T疗法,支持院外报销。
未来,在中国长期医疗险推动过程中,或许可以将创新药与相应服务相结合,最大可能减轻患者的支付缺口并满足患者对高质量医疗服务的需求。
参考文章:
1、BMS CAR-T疗法Abecma在欧盟附条件上市;医谷
2、黄金有价,药无价!这个药年费用212万美元!;医药时间no1
3、120万元一针的抗癌“神药”,还不是最贵的,最贵的超过300万一针!;人民日报健康客户端
4、诺华财报:2020净销售额全球增长3% 细胞疗法、基因疗法成业绩有力支撑;新康界
5、写意讨论|CAR-T疗法的商业化之路;同写意
6、首个CAR-T疗法获批后,传奇生物正探索前线治疗和降低成本的创新;同写意

 产业资讯
产业资讯
 MedTrend医趋势
MedTrend医趋势  2025-08-30
2025-08-30
 34
34
 产业资讯
产业资讯
 医药魔方
医药魔方  2025-08-30
2025-08-30
 39
39

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-08-30
2025-08-30
 40
40