 研发追踪
研发追踪
 医药魔方
医药魔方  2022-07-25
2022-07-25
 3817
3817
7月19日,Apellis宣布,美国FDA已受理玻璃体腔注射疗法pegcetacoplan治疗年龄相关性黄斑变性(AMD)继发性地图样萎缩(GA)的新药上市申请(NDA)并被纳入了优先审评,PDUFA日期定为2022年11月26日。另外,FDA表示目前不打算召开咨询委员会会议来讨论该申请。此消息一出,Apellis股价上涨23.61%。

GA是年龄相关黄斑变性(AMD)的一种晚期病变,会导致不可逆转的失明。全球约有500万人患有GA,且目前还没有批准的治疗方法。补体级联反应是一种天然的免疫调节方式,而过度的激活补体系统会导致GA不可逆的病变。C3是精准控制补体级联反应的靶点。Pegcetacoplan是一种靶向补体C3疗法,旨在调节补体级联的过度激活,进而控制疾病的发生发展。
该申请是基于III期DERBY和OAKS研究以及II期FILLY研究的积极结果。DERBY和OAKS分别有621、637例患者入组,分别接受每月、隔月注射pegcetacoplan或假处理对照组(sham组)治疗。主要终点为12个月时眼底自身荧光测量的GA病变总面积较基线的变化。OAKS研究到达了主要终点,与sham组相比,接受每月和隔月注射pegcetacoplan患者的GA病变面积分别减少了22%(p=0.0003)、16%(p=0.0052)。
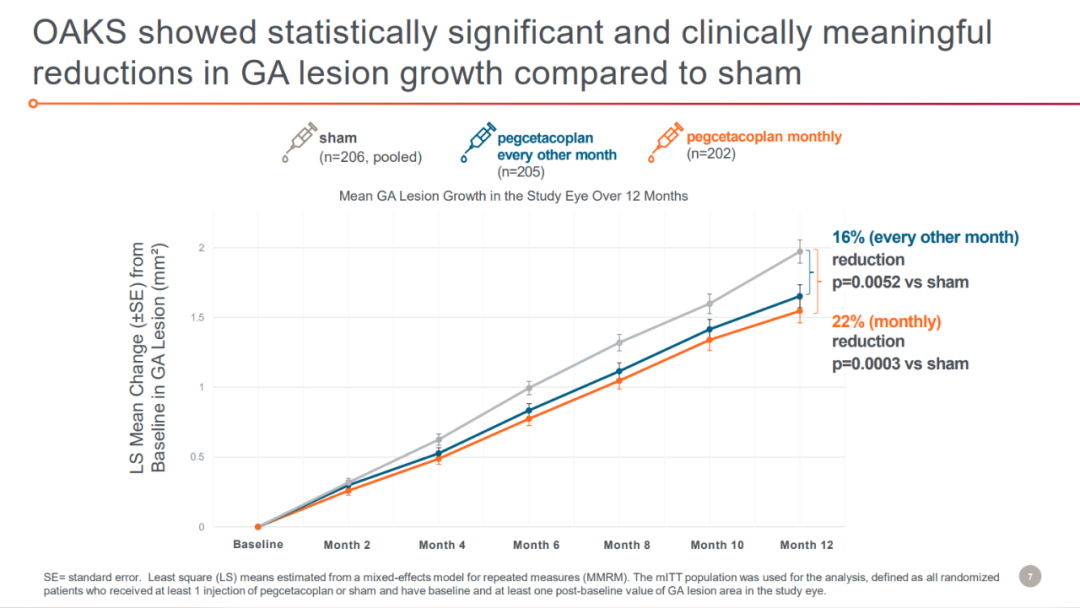
来源:Apellis
而DERBY研究未达到其主要终点。
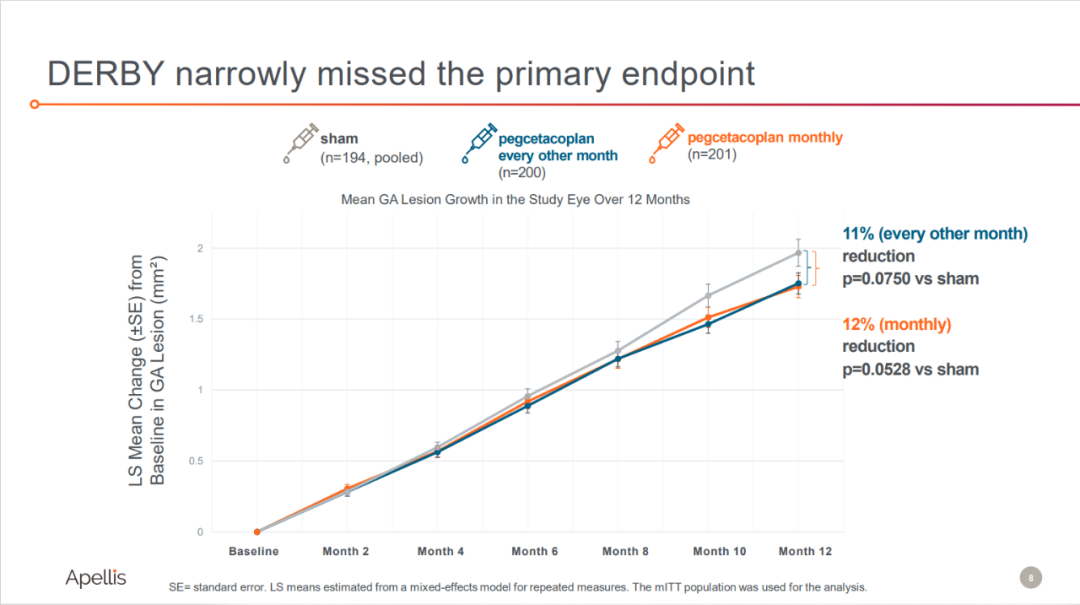
来源:Apellis
但DERBY和OKAS研究汇总结果显示,接受每月和隔月注射pegcetacoplan患者的GA病变面积分别减少了17%(p<0.0001)、14%(p=0.0012);与未经治疗的对侧眼相比,注射pegcetacoplan治疗也显示出减缓GA病变速度的效果。
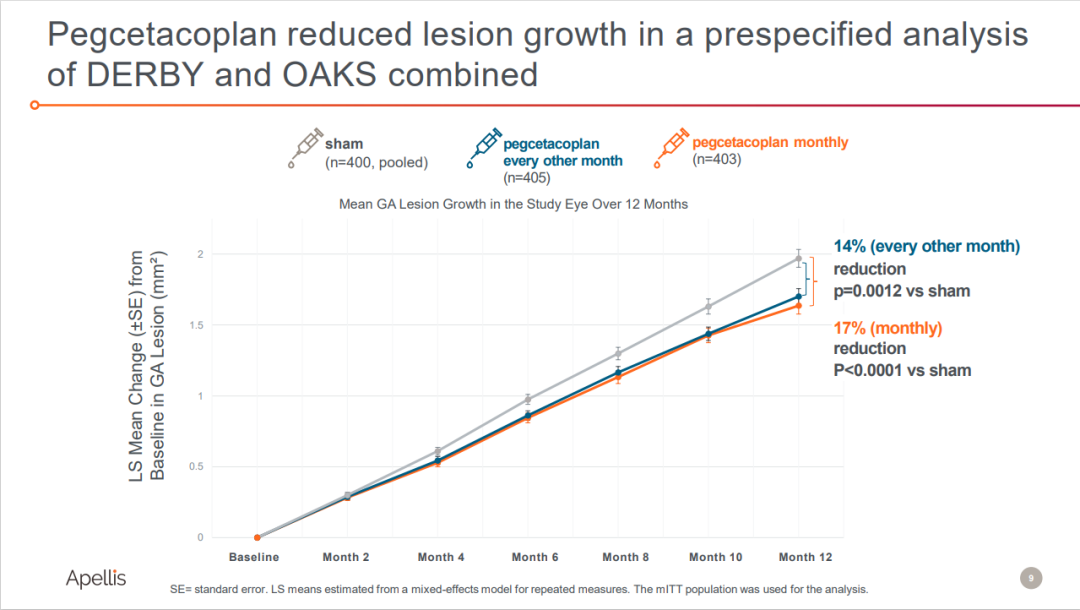
来源:Apellis
Pegcetacoplan已于2021年5月获FDA批准并于同年12月获得欧洲药品管理局(EMA)批准上市,用于治疗阵发性睡眠性血红蛋白尿症(PNH)。Apellis计划在2022年下半年向EMA递交治疗GA的上市申请。
Apellis首席开发官Jeffrey Eisele博士说:“这是一个重要的里程碑,我们在不到两年内第二次让FDA接受pegcetacoplan的NDA,证明了pegcetacoplan针对C3靶向治疗未满足严重疾病的潜力。我们致力于与FDA密切合作,尽快为GA患者带来这种潜在的、前所未有的治疗方法。“
原文链接
Apellis Announces FDA Acceptance and Priority Review of the New Drug Application for Pegcetacoplan for the Treatment of Geographic Atrophy (GA)

 研发追踪
研发追踪
 药时代
药时代  2026-02-13
2026-02-13
 87
87

 研发追踪
研发追踪
 医药魔方
医药魔方  2026-02-13
2026-02-13
 78
78

 研发追踪
研发追踪
 瞪羚社
瞪羚社  2026-02-13
2026-02-13
 74
74