 研发追踪
研发追踪
 医药魔方
医药魔方  2022-08-22
2022-08-22
 2795
2795
8月18日,安斯泰来公告宣布,神经激肽3受体拮抗剂fezolinetant的新药上市申请(NDA)已获FDA受理并获优先审查认定,PDUFA日期定为2023年2月22日。本次申请的适应症为与更年期相关的中度至重度血管舒缩症状(VMS)。一旦获批,fezolinetant将成为首款治疗VMS的非激素疗法。

VMS是最常见的更年期相关症状,常表现为潮热或盗汗,50%以上40至64岁的女性受其影响。三分之一的女性在绝经后的十多年中持续经历中度至重度的潮热症状。目前主要治疗手段仍是激素替代疗法(HRT),已有超过10种激素类单药及组合疗法用于该病。短期内使用激素治疗是有效且安全的,但长此以往会增加静脉血栓栓塞风险。
fezolinetant(非唑奈坦)是安斯泰来自主研发的一款选择性神经激肽3受体(NK3)拮抗剂,主要通过阻断NKB与KNDy神经元的结合,调节下丘脑体温调节中枢的神经元活动,从而治疗与更年期相关的VMS。
FDA此次受理是基于两项关键III期临床试验(Skylight 1和Skylight 2)及一项长期安全性研究(Skylight 4)的结果。
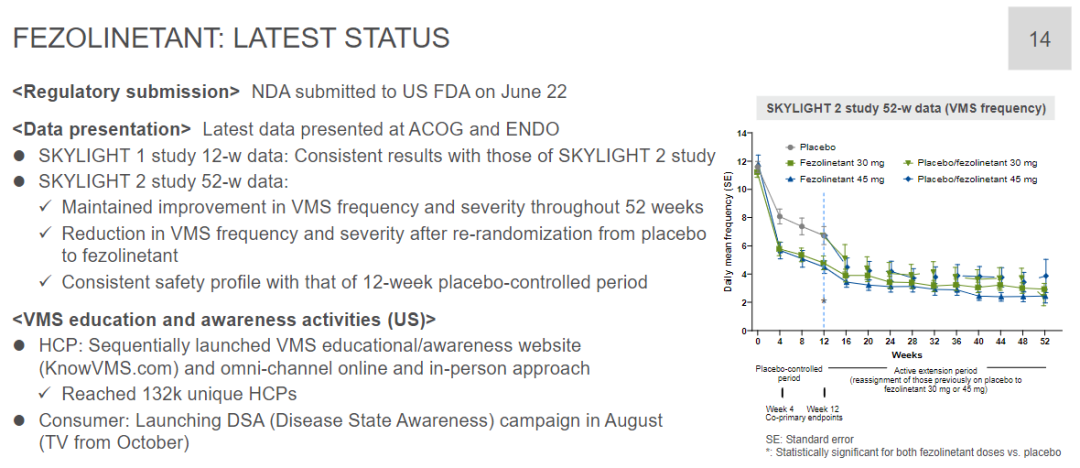
Skylight 1和Skylight 2均是随机、双盲、安慰剂对照研究,分别纳入了527例和507例患者,旨在评估fezolinetant治疗与更年期相关的中度至重度血管舒缩症状女性患者的疗效和安全性。共同的主要终点为第4周和第12周时中度至重度VMS平均频率和严重程度的变化。
结果显示,在第4周和第12周,与安慰剂组相比,fezolinetant组患者发生中度至重度VMS的频率显著降低且严重程度显著减轻。此外,fezolinetant具有良好的安全性,发生严重治疗紧急不良事件(TEAE)的概率较低(不超过2%),最常见的不良反应是头痛。
Skylight 4是一项随机、双盲、安慰剂对照III期临床试验,共纳入1831例患者,旨在评估fezolinetant对患者子宫内膜健康的影响及长期安全性和耐受性。主要终点是第52周时子宫内膜增生和子宫内膜癌的患者比例和第55周时不良反应发生率及其严重程度。结果显示,研究达到评估子宫内膜健康状况的主要终点,最常见的不良事件为头痛和新冠病毒感染,与安慰剂一致。
安斯泰来高级副总裁兼开发治疗领域负责人Ahsan Arozullah博士说:“FDA接受fezolinetant的NDA使我们离为经历VMS的美国女性带来新疗法更近了一步。我们期待FDA对本次申请进行审查,并期待带来首款非激素类药物以减少与更年期相关的中度至重度VMS的频率和严重程度。”

 研发追踪
研发追踪
 医药魔方Info
医药魔方Info  2025-04-28
2025-04-28
 490
490

 研发追踪
研发追踪
 细胞基因治疗前沿
细胞基因治疗前沿  2025-04-28
2025-04-28
 492
492

 研发追踪
研发追踪
 药视点
药视点  2025-04-28
2025-04-28
 499
499