 产业资讯
产业资讯
 GBIHealth
GBIHealth  2022-08-26
2022-08-26
 2633
2633
狂欢之后,终归平静。2021年下半年以来,备受资本市场“宠爱”的中国生物技术公司们遭遇“寒冬”。彼时“风光无限”的biotechs不得不面对产品竞争力较弱、造血能力不足、国内外商业化前景堪忧等现实问题。比坚持更需要勇气的,是果断放弃“沉没成本”及时止损,壮士扼腕的“节流自救”不失为一种英明之举:
如云顶新耀“割肉”核心产品TROP-2 ADC戈沙妥珠单抗以“回血续命”;沃森生物因产品可预见的低社会和经济效益而终止重组EV71疫苗临床研究;三叶草生物暂停对三个临床管线的投入,将资源优先分配给新冠相关产品及早期项目。此外,还有biotechs相继被外媒传出“卖身”意愿,包括天境生物探索出售业务或与另一家公司合并的可能性,以及基石药业或将寻求收购或出售控股权。
时艰之下,审时度势选择“开源造血”的企业有的获得喜人收益,以期为企业的创新项目研发与国际市场拓展做足“后盾”:
如复宏汉霖与多家跨国公司达成License-out交易,其中与Organon就HLX11和HLX14的交易将为公司带来5.41亿美元潜在收入。据最新财报,复宏汉霖2022年上半实现营业收入较去年同期增长约103.5%。再如“ADC领域龙头”荣昌生物26亿美元将维迪西妥单抗海外部分区域授权给西雅图基因,2022年第一季度,荣昌生物营收1.5亿元,大增34倍。
除了要解决自身产品管线和资金问题,biotechs还面临着愈加“严苛”的国际监管环境。系列“出海”遇挫事件已明确释放了美国FDA对创新药审批“高标准、严要求”的信号,而若“美国版医保谈判”落地,则意味着未来历尽波折打入海外市场的国产创新药还将面临竞品降价的威胁,商业化成果大打折扣。一面是资本沉寂之下背负的创新“枷锁”,一面是国际监管环境逐渐趋严,多重压力之下,众多高喊“立足中国,面向全球”、以“出海”作为未来标配战略的本土创新药企们,路在何方?
国际监管趋严,“折戟”事件频发
据GBI近期发布的专题报告(点击相关阅读),2022年上半年,中国公司License-out的产品疗法分布方面,包括单抗、ADCs、其他抗体以及细胞疗法等在内的生物药在对外许可交易中占比69%。这不仅反映出本土生物技术公司研发能力的提升,也证明国产创新正逐步与国际质量接轨。
虽然国产创新药品愈加获得海外公司的认可,并在国际的影响力与日俱增,但从近期美国FDA对新药的审批趋势以及频发的“出海折戟”案例不难看出,国际监管正在趋严,能满足当地未被满足临床需求的差异化创新才是企业“突围”海外市场的关键。
事实上,越是像美国这样创新发达的国家,越会严格地保护其医药创新的立场和制度体系。据公开资料,2021年FDA批准的新药中First-in-class(FIC)药物高达27款,占全年获批新药总数(50款)的54%,创十年来新高1。此外,2022年上半年FDA批准了16款新药,较去年同期的27款已明显减少。
表1. 在美国FDA提交上市申请的国产PD-1药物
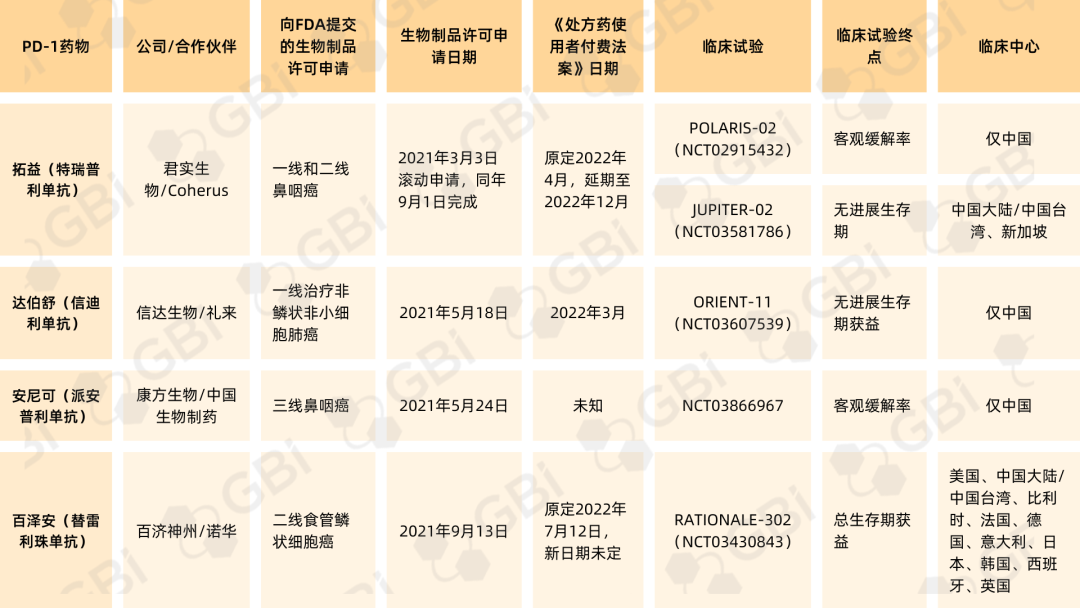
来源:GBI SOURCE 全球药品数据库
趋严的监管也可从国产PD-1的“出海”波折中略窥一二。去年以来,君实生物、信达生物、康方生物、百济神州陆续向美国FDA递交旗下PD-1药物的上市申请(表1),目前除康方生物派安普利单抗外,其他三家均已收到FDA的审评结果或阶段性反馈,然而却都不尽如人意:
2022年3月,礼来和信达宣布,美国FDA就达伯舒(信迪利单抗)用于一线治疗非鳞状非小细胞肺癌的生物制品许可申请(BLA)发布了完整回复函,拒绝达伯舒上市;
2022年5月,因新冠疫情相关旅行限制阻碍了FDA前来完成必要的现场核查工作,君实生物拓益(特瑞普利单抗)的审评日期被延迟。7月,君实重新提交的BLA获受理,新的处方药用户付费法案(PDUFA)日期定于今年12月23日;
2022年7月,百济神州宣布,美国FDA因新冠疫情相关旅行限制,无法如期在中国完成所需的现场核查工作,将延长百泽安(替雷利珠单抗)针对不可切除或转移性食管鳞状细胞癌患者二线治疗的BLA审评时间,新的PDUFA日期未定。
国际多中心临床:绕不过的“坎儿”
关注国产PD-1“出海”遇挫的原因,君实和百济皆因新冠疫情被暂时阻碍步伐,而信达达伯舒则因缺少能代表美国患者的国际多中心临床试验(MRCT)数据而被明确拒批。据相关新闻稿,FDA建议其开展与目前治疗标准(PD-1抑制剂)头对头比较的MRCT,以证明总生存率方面的非劣效性。此前2月,在肿瘤药物咨询委员会(ODAC)会议前夕,FDA也表示用于达伯舒上市申请的ORIENT-11试验结果“不适用于美国患者和医疗实践”,此外,鉴于达伯舒并不能满足美国非鳞状NSCLC患者的未满需求,可接受单一海外临试数据用于新药批准的“监管灵活性”或对其不适用。
值得注意的是,FDA因缺少代表美国人群的临试数据而给出消极反馈已非个例:
2021年3月,Athenex旗下口服紫杉醇制剂Oraxol未能获批上市。虽然与静脉制剂相比,Oraxol显著改善了总体生存数据,但是因其临床研究仅在拉丁美洲开展,FDA对试验期间数据完整性提出了疑问,并要求Athenex开展另外一项“代表美国人口” 的研究。
2022年5月,和黄医药宣布美国FDA延缓了用于治疗胰腺和非胰腺神经内分泌瘤的索凡替尼的上市申请。FDA指出,索凡替尼中国III期研究以及一项美国桥接研究的数据包尚不足以支持在美国获批,需纳入更多代表美国患者的MRCT。
频发的“折戟”事件在向“后来者”们释放一个信号:具有差异化创新产品是前提,进行能代表当地人口学特征的MRCT或将更有利于获批。这也是为何业内对君实和百济PD-1产品的审评结果仍持积极态度。由于美国尚无肿瘤免疫疗法获批用于鼻咽癌治疗,君实特瑞普利单抗治疗鼻咽癌符合“未被满足的临床需求”。而百济替雷利珠单抗用于二线治疗食管鳞状细胞癌适应证,则是基于真正意义上的MRCT,且试验结果也展现了总生存期优势,因此相较于其他国产“出海”PD-1,替雷利珠单抗的临床数据或许更具说服力,有利于其获批。百济神州可谓“自主出海”的代表,公司拥有一支超2900人的研发团队,其中全球临床开发团队达2200 人,强大的自主临床开发能力让其基本实现“去CRO化”。百济神州在全球多个国家和地区开展临床试验,以便更快招募入组患者,并将临床试验的时间和成本减少三分之一。
敏捷准入,美国并非唯一解
事实上,对于追求真正的创新、致力于长线拓展海外“疆土”的国内头部创新药企,国际化研发终究是难以避开的“关卡”,且随着监管趋严,基于“准入加码倒逼研发”的全球临床试验布局的必要性和先发优势日渐凸显。除了如百济般的“领头羊”外,其他志在海外市场的企业也在大步前行。据GBI不完全统计,目前我国约有近60-70家本土生物技术公司已在国际市场积极布局中长期临床研发,包括信达生物、康方生物、诺诚健华、开拓药业、复宏汉霖等。
表2. 部分本土生物技术公司布局多国临床试验的药物
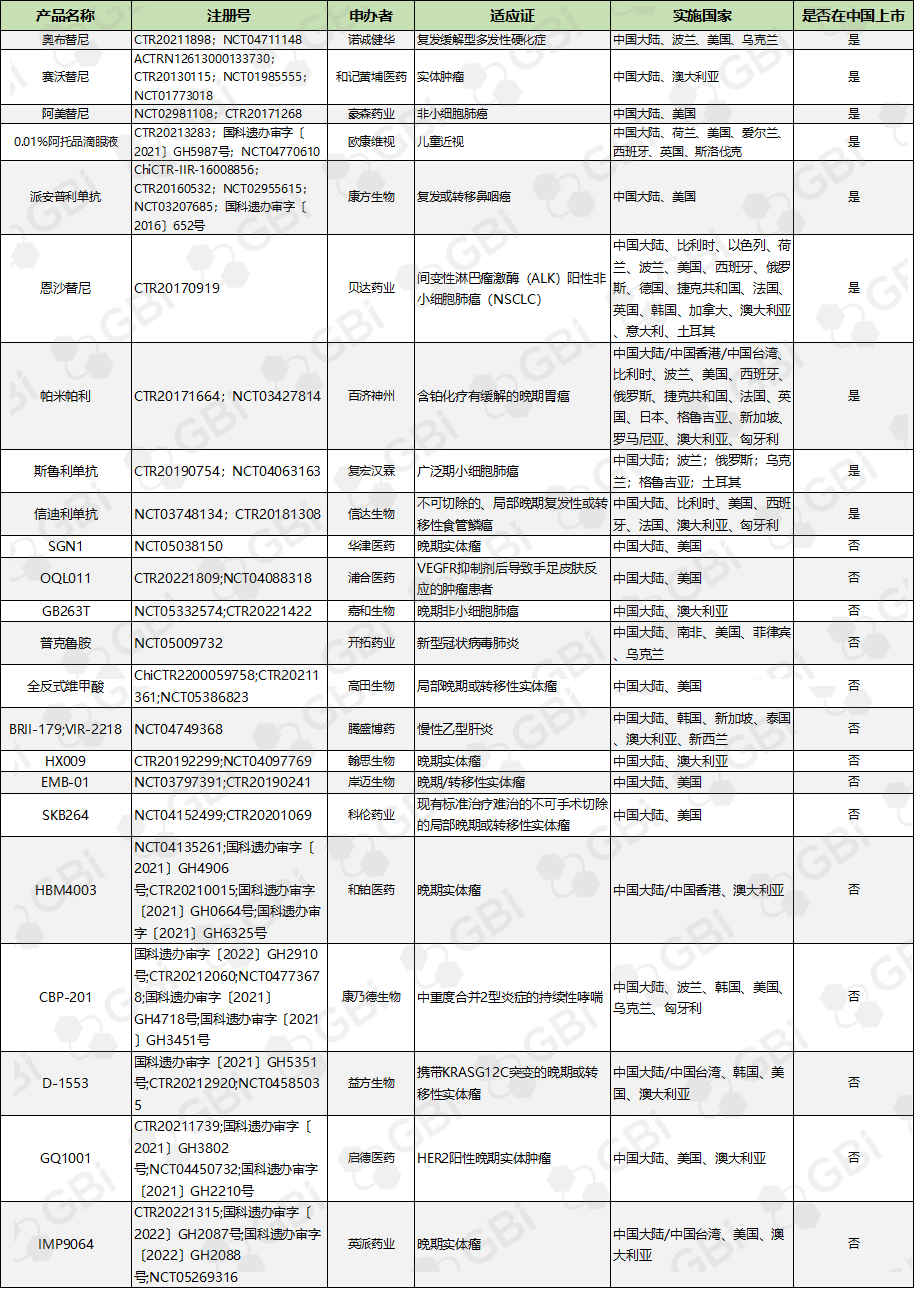
来源:GBI SOURCE 全球药品数据库
值得注意的是,除了美国,药企的国际临床布局正在触及众多欧洲国家以及其他新兴市场。从既往GBI全球准入项目中,我们也发现,虽然美国是“最理想”的准入市场,但对于多数药企,在结合产品自身特点对疾病谱、注册监管、竞争格局、未满临床需求、患者群体、税收环境等进行综合考量后,往往会率先成功准入美国以外的国家。事实证明,美国并非“获胜唯一解”,新兴市场所蕴含的机会与潜力也不容小觑,“曲线救国”市场准入战略也不失为成功“出海“的良策。
据全球药品定价及准入数据库, 同一款药品在不同国家市场的平均报销时间、平均治疗费用存在明显差异。以O药为例,在西班牙的医保平均报销时长与加拿大相同(41个月),而在澳大利亚和德国则相对较短 (36个月和38个月)。基于对商业机会和准入风险的科学分析,企业应综合考量目标国家的商业潜力、准入风险和购买力,以制定科学的准入顺序。适合自己的才是最好的,可优先选择预期试验数据可真实满足其临床需求的市场。以新加坡为例,作为东盟五个创始成员国之一,其经济发展迅速且拥有出色的医疗水平和科研创新能力,此外,较小的语言壁垒也更利于药企与当地监管机构沟通并建立国际化研发体系,若以新加坡为突破口,进而进军东盟更多国家,再冲击欧美发达市场,或许会“弯道超车”。总之,相较于“千军万马”挤在通往美国的“独木桥”,以敏捷的准入策略放眼更广阔的市场,对多数药企或将是更合适的选择。
既已出征,必将远行
已有经验向我们表明,没有国际市场的支撑,高值创新药都很难实现规模效益并发展壮大。因此本土创新企业若想真正缩小与国际先进同行的差距并获得话语权,无论“出海”过程多么漫长波折,都是“开弓没有回头箭”的必走之路。
诚然,并不是所有本土创新药企都有充沛的资源支撑国际化研发,但当低价me-too药物在临床需求不大、同品种或同适应证较多的国际市场“步履维艰”,“出海”便愈加成为“强者们的游戏”。对强者而言,相较于受到国内市场竞争的挤压,“出海”更应是对自家产品竞争力有信心的一种主动选择。这种信心既源于药物的质量可控性、安全性和有效性,也源于其可为目标市场带来的“价值”,包括经济价值、临床价值、社会价值等在内的多维度证据,是药品成功准入与商业化的关键,而能代表更多患者人群的MRCT无疑会为企业的证据准备提供有力支撑。
遇阻不可怕,重要的是在阻碍中吸取经验并沉住气等待一个“柳暗花明”。创新不易,“出海”之路亦非坦途,但既已出征,必将远行。当越来越多企业沉得下心做“源头创新”,并迈开步子布局国际化研发,相信未来将会涌现更多具有国际质量标准并获得国际市场认可的创新药,而踏过一道道“坎儿”的本土创新药企,也终将迎来独属于自己的“海上黎明”。

 产业资讯
产业资讯
 创奇健康研究院
创奇健康研究院  2025-11-05
2025-11-05
 41
41

 产业资讯
产业资讯
 21新健康
21新健康  2025-11-05
2025-11-05
 40
40

 产业资讯
产业资讯
 药时代
药时代  2025-11-05
2025-11-05
 40
40