 研发追踪
研发追踪
 医药魔方
医药魔方  2022-08-29
2022-08-29
 3385
3385
8月22日,Minerva Neurosciences公告宣布已向FDA提交roluperidone的新药申请(NDA),用于治疗精神分裂症患者的阴性症状。

精神分裂症是最严重的精神疾病之一,主要表现为思维、感知、情绪、语言、认知和行为等多方面存在异常,影响全球2000万人。其中,阴性症状指的是精神功能的减退或缺失,主要包括情感迟钝、情绪低落、意志缺乏、性欲减退和社交能力降低。目前,美国尚无针对精神分裂症阴性症状的疗法。
roluperidone是一款5-HT2A受体和σ2受体拮抗剂,最初由Mitsubishi Tanabe公司开发。2007年8月,Minerva Neurosciences与Mitsubishi Tanabe达成许可协议,获得roluperidone在除中国、日本、印度和韩国等亚洲国家以外地区的独家开发和商业化权益。
本次NDA是基于两项III期临床试验(MIN-101C03和MIN-101C07)的积极结果。MIN-101C03研究是一项全球性、多中心、随机、双盲、安慰剂对照试验,共纳入515例患者,旨在评估roluperidone两种剂量规格(32mg和64mg)治疗精神分裂症的中度至重度阴性症状和稳定阳性症状的患者的疗效和安全性。主要终点为第12周时Marder阴性症状因素评分(NSFS)的变化。MIN-101C07研究是MIN-101C03研究的扩展研究,共纳入333例患者,主要终点为第40周时NSFS的变化。
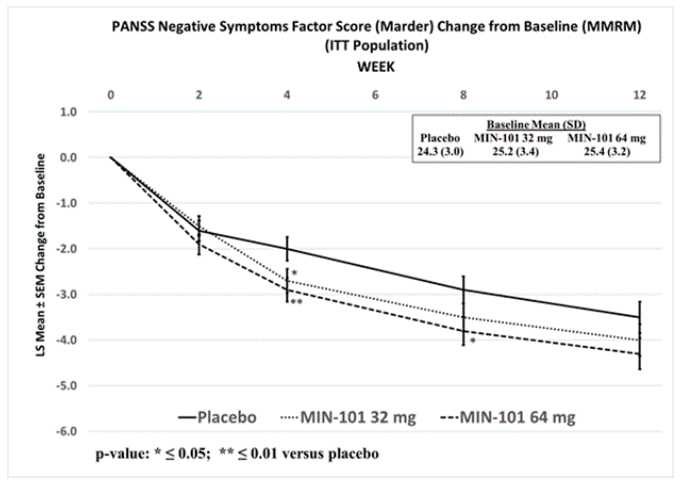
MIN-101C03研究的结果显示,在第12周,roluperidone组患者的NSFS评分改善显著优于安慰剂组。
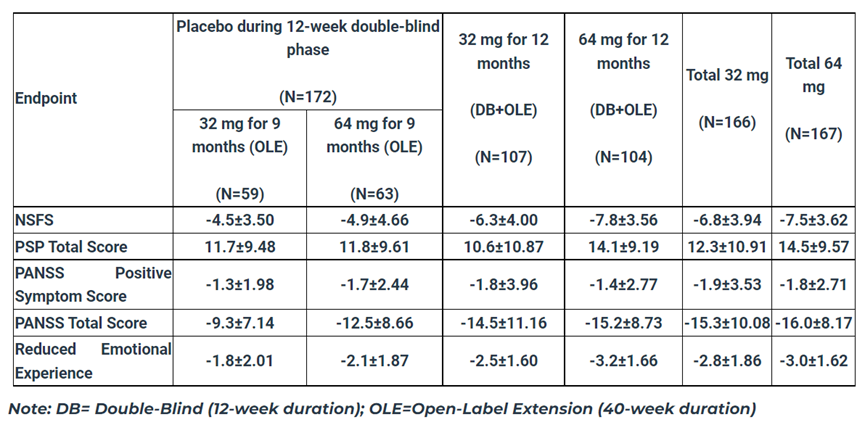
MIN-101C07研究的结果显示,第40周时,在改良意向性治疗(mITT)人群中,roluperidone(64mg)组患者的NSFS评分改善(p≤0.044)和个人和社会表现(PSP)总分改善(p≤0.017)均显著优于安慰剂组。
执行主席兼首席执行官Remy Luthringer说:“我们相信roluperidone可能代表了一种新的治疗选择,用于治疗精神分裂症阴性症状患者。目前美国没有相关疗法获批。精神分裂症的阳性症状通常可以通过服用抗精神病药物得到很好的控制,但阴性症状是该疾病的主要负担且会对患者的职业和社交技能造成负面影响,降低他们的生活质量。我们要向所有参与roluperidone临床研究的患者、护理人员和研究人员以及工作人员表示衷心的赞赏和感谢。在2022年3月召开C类会议后,我们一直在与FDA进行沟通,且期待与FDA在本次审查过程中合作。”

 研发追踪
研发追踪
 医麦创新药
医麦创新药  2025-06-30
2025-06-30
 231
231

 研发追踪
研发追踪
 凯莱英药闻
凯莱英药闻  2025-06-30
2025-06-30
 237
237

 研发追踪
研发追踪
 医药观澜
医药观澜  2025-06-30
2025-06-30
 236
236