 研发追踪
研发追踪
 医药观澜
医药观澜  2025-06-30
2025-06-30
 1670
1670
6月26日,诺和诺德(Novo Nordisk)宣布,皮下注射amycretin的临床试验数据在美国芝加哥举行的第85届美国糖尿病协会(ADA)科学年会上进行了报告。两项旨在评估皮下注射与口服amycretin在超重或肥胖患者中的安全性、耐受性及减重潜力的临床试验完整结果同期发表于医学期刊《柳叶刀》。Amycretin是具有GLP-1和胰淀素受体双重激动作用的单一分子。

已发表和报告的每周一次皮下注射amycretin的1b/2a期临床试验结果显示,与安慰剂相比,接受amycretin治疗的所有受试者剂量组均显示出更大的体重降幅。在ADA会议上报告的数据来自试验的两部分;递增剂量(amycretin
60 mg)以及递增和维持剂量(amycretin 20 mg、5 mg和1.25
mg)。在治疗结束时(20-36周),所有剂量组尚未观察到体重下降停止,意味着延长治疗周期可能使体重继续降低。
每周一次皮下注射amycretin治疗后体重较基线的平均变化估计值:
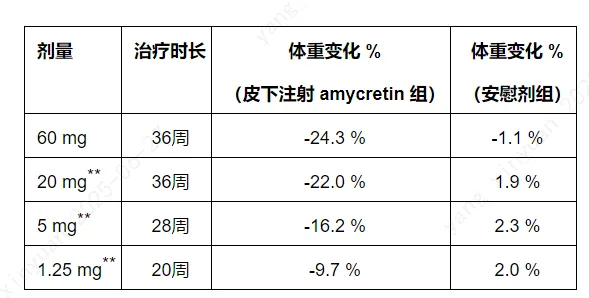
每周一次皮下注射amycretin在剂量递增至60
mg时表现出良好的耐受性,其安全性特征与其他GLP-1和胰淀素受体激动剂类药物一致。治疗期间出现的不良事件呈剂量依赖性增加,且大多数为胃肠道不良事件,其发生率和特征与GLP-1受体/胃抑制肽(GIP)受体及胰淀素受体激动剂类药物的早期研究结果相似。大多数治疗期间出现的不良事件为轻至中度,并在试验结束时缓解。退出研究的受试者大多数是因治疗期间出现的不良事件之外的原因。
已发表的每日一次口服amycretin的1期临床试验数据显示,与安慰剂相比,接受amycretin治疗的受试者的体重显著降低。在接受每日一次最高50 mg amycretin和每日两次最高50 mg amycretin治疗12周后,受试者的平均体重降幅分别为10.4%与13.1%,而安慰剂组为1.2%。在接受amycretin治疗的两组受试者中,12周内均未观察到明显的体重下降停止。
每日一次口服amycretin展现出良好的安全性特征,并在所有试验剂量下均可耐受,其治疗期间出现的不良事件符合GLP-1和胰淀素受体相关的预期特征。所有报告的治疗期间出现的不良事件均呈剂量相关性,为轻至中度,并且大多数为胃肠道不良事件。研究期间未发现新的安全性信号。
Amycretin是诺和诺德正在开发的一种具有GLP-1和胰淀素受体双重激动作用的长效单一分子,旨在通过不同通路在食欲控制方面发挥协同效应,为超重或肥胖成人患者以及2型糖尿病成人患者提供高效便捷的治疗方案。Amycretin的口服和皮下注射剂型均处在开发进程中。
诺和诺德新闻稿表示,其将积极推进amycretin皮下注射与口服剂型的3期临床试验,评估其作为体重管理治疗选择的潜力。
出处:
https://www.prnasia.com/story/494457-1.shtml

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 49
49

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 44
44

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 42
42