 研发追踪
研发追踪
 凯莱英药闻
凯莱英药闻  2025-06-30
2025-06-30
 1902
1902
6 月 23 日,FDA宣布已加速批准第一三共和阿斯利康的 TROP2 ADC 药物德达博妥单抗(Datopotamab deruxtecan-dlnk)第 2 项适应症,用于治疗既往接受过 EGFR 靶向疗法和铂类化疗的局部晚期或转移性 EGFR 突变非小细胞肺癌 (NSCLC) 成人患者。德达博妥单抗亦成为首个获 FDA 批准的非小细胞肺癌适应症的 TROP2 靶向疗法。

本次适应症的获批是基于TROPION-Lung05 和
TROPION-Lung01两项研究结果:TROPION-Lung05为多中心、单臂研究,TROPION-Lung01为多中心、开放标签、随机对照试验。在两项试验中,共
114 名经评估的既往接受过治疗的局部晚期或转移性 EGFR 突变 NSCLC 患者中,确认的客观缓解率 (ORR) 为 45%(95%
CI:35,54)。中位生存期 (DOR) 为 6.5 个月(95% CI:4.2,8.4)。
此外,德达博妥单抗还有卵巢上皮癌、子宫内膜癌、结直肠癌、胃癌等多项临床研究正在进行中。

德达博妥单抗全球研发进展
来源:Insight数据库
关于德达博妥单抗
德达博妥单抗最初由第一三共开发,采用第一三共独有的DXd-ADC技术设计,抗体部分由人源化抗TROP2 IgG1单克隆抗体(与Sapporo Medical University合作开发)通过可裂解四肽连接子与多个拓扑异构酶I抑制剂有效载荷(一种依喜替康衍生物,DXd)连接组成。
2020 年 7 月,第一三共与阿斯利康达成一项超 60 亿美元的合作,在全球(日本除外)联合开发和商业化德达博妥单抗,这也是继 HER2 ADC 德曲妥珠单抗之后,双方在 ADC 领域达成的第 2 项合作。
德达博妥单抗在全球首次获批上市是2024年12月,在日本获批用于治疗既往接受过内分泌治疗和化疗的HR阳性、HER2阴性(IHC 0、IHC 1+或IHC 2+/ISH-)不可切除或转移性乳腺癌成人患者。同样的适应症于今年1月在美获批。随后,4月EMA也批准其上市。
关于TROP2 ADC
Trop2是由TACSTD2基因编码的细胞表面糖蛋白,与肿瘤的发生和发展关系密切。在肿瘤细胞中,Trop2的表达明显升高,并通过调节钙离子信号通路、细胞周期蛋白表达及降低纤黏蛋白黏附作用促进肿瘤细胞生长、增殖和转移。此外,Trop2 也可以与Wnt信号级联中的β-连环蛋白相互作用,因而对细胞核癌基因的转录、细胞的增殖起作用。总结看,Trop2高表达与癌细胞的增殖、侵袭、转移扩散息息相关,造成肿瘤患者生存期大幅缩短。
TROP2 蛋白过度表达与多种癌症有关,包括数种最高发或难治的癌症,如乳腺癌(BC,尤其是TNBC)、NSCLC、胃癌(GC)、卵巢癌(OC)、结直肠癌(CRC)、尿路上皮癌(UC)、胰腺癌(PC)、子宫颈癌(CC)、去势抗性前列腺癌(CRPC)、头颈鳞状上皮细胞癌(HNSCC)和子宫内膜癌(EC),因此创新型TROP2 ADC 具备广谱肿瘤治疗的潜力,国内外对其新药研发布局也十分红火。
据不完全统计,目前全球在研的TROP2 ADC约60余种,除吉利德的戈沙妥珠单抗、科伦博泰的芦康沙妥珠单抗和第一三共/阿斯利康的德达博妥单抗已在不同地区获批上市之外,恒瑞医药、复旦张江、诗健生物的 TROP2 ADC 均已推进到III期临床阶段。
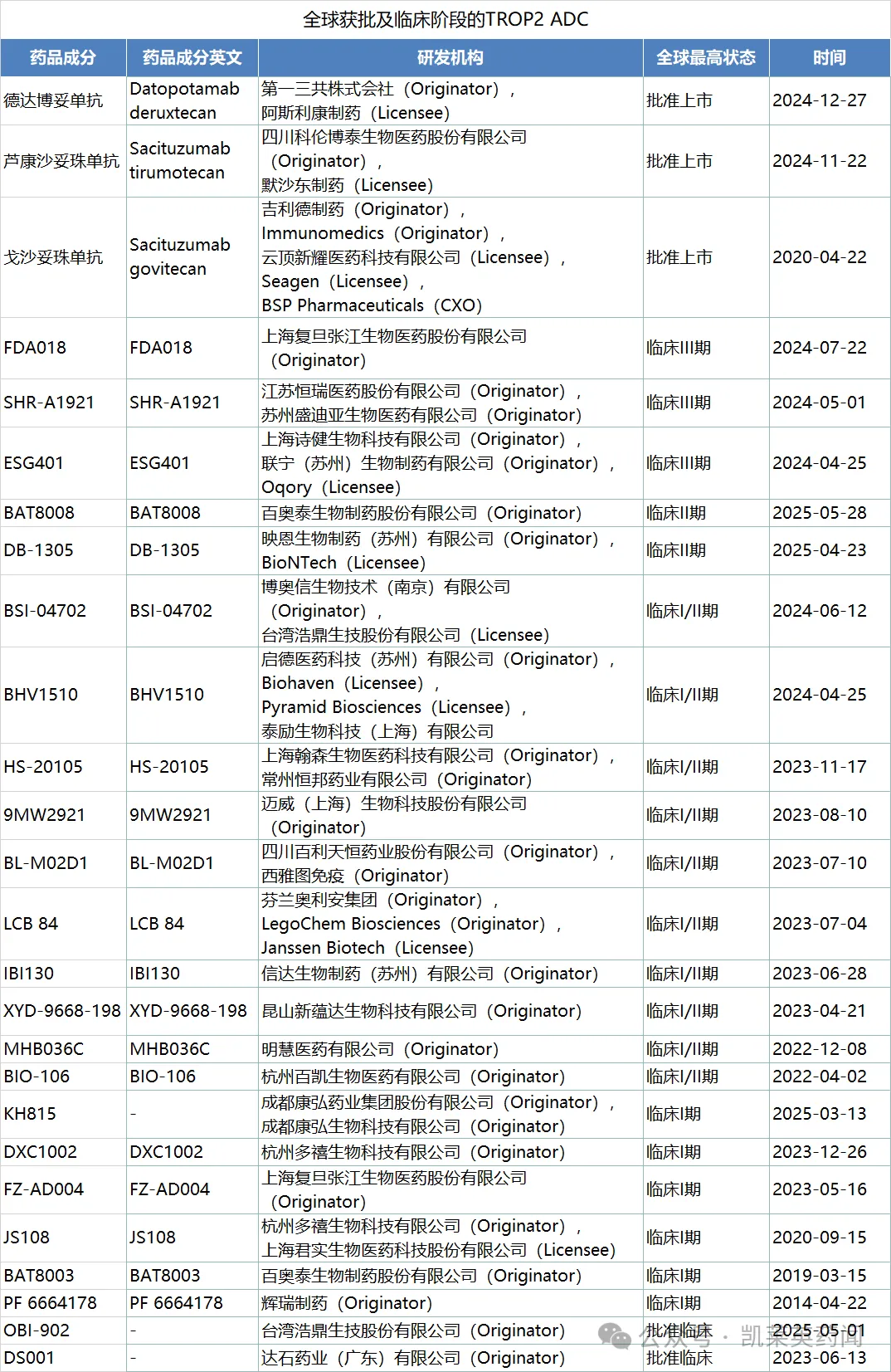
出处:

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 50
50

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 44
44

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 42
42