 研发追踪
研发追踪
 医药魔方Pro
医药魔方Pro  2022-08-29
2022-08-29
 4572
4572
8月22日,武田宣布,登革热疫苗QDENGA(TAK-003)获印度尼西亚国家食品药品监督管理局(BPOM)批准(全球首次批准),用于预防6至45岁因任何血清型引起的登革热疾病。这是BPOM批准的唯一一种用于个人的登革热疫苗,无论以前是否感染过登革热,也无需进行接种前检测。

来源:Takeda官网
登革热是一种蚊媒病毒性疾病,主要由埃及伊蚊传播,其次是白纹伊蚊,在超过125个国家流行,曾被世卫组织列为2019全球十大健康威胁之一。四种登革热病毒血清型中的任何一种均可引起登革热或严重登革热。目前,全球约一半的人生活在登革热的威胁下,据估每年造成3.9亿人感染和2万人死亡。
此次获批是基于一项双盲、随机、安慰剂对照的TIDES III期临床研究,该研究旨在评估两剂TAK-003在儿童和青少年中预防任何严重程度的、由四种登革热病毒血清型中的任何一种引起的有症状的登革热的安全性和有效性。该试验共招募了生活在亚洲和拉丁美洲登革热流行地区的2万多例4至16岁的健康儿童和青少年,以2:1的比例随机分组,在第0和3个月分别接受皮下注射两剂TAK-003 (0.5mL)或安慰剂。
该研究由五个部分组成,第1部分:主要终点为第二剂疫苗12个月内的疗效和安全性;第二部分:随访6个月,根据血清型、基线血清状态和疾病严重程度,评估(包括住院登革热)疗效的次要终点;第三部分:2年半到3年的随访,以评估其疗效和长期安全性;第四部分:评估加强疫苗接种后13个月的疗效和安全性;第五部分:评估第四部分完成后1年的长期疗效和安全性。
结果显示,在12个月的随访中,达到了其对病毒学证实的登革热的总体疗效的主要终点,总体疗效为80.2%。在18个月的随访中,该试验也达到了所有次要终点,预防因登革热住院的发生率为90.4%。第二剂接种四年半后,TAK-003对病毒学证实的登革热的疗效为61.2%,对登革热住院治疗的疗效为84.1%。接种疫苗三年后,该疫苗的疗效为62%,使登革热住院率下降了83.6%。迄今为止,TAK-003的耐受性良好,且没有发现重要的安全风险。
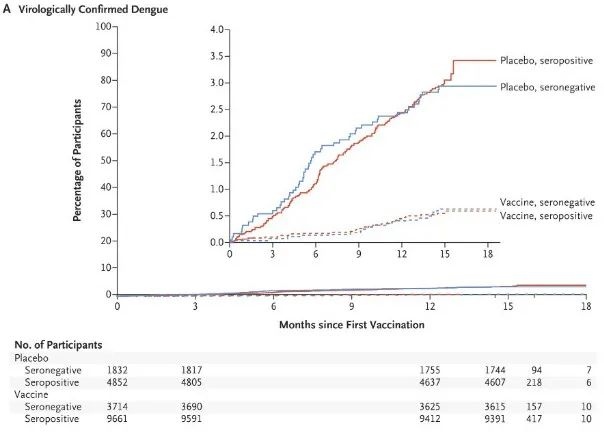
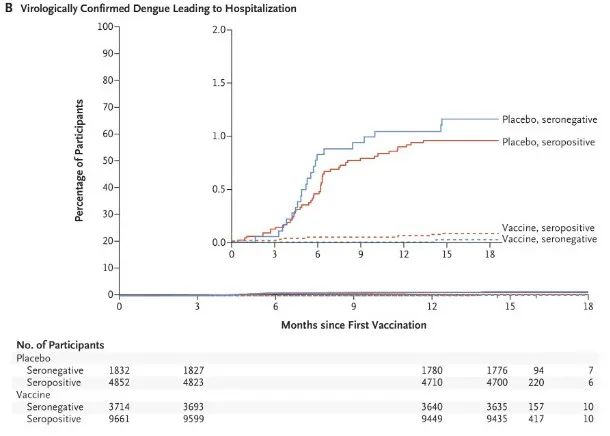
目前,该试验正在登革热流行且预防方面的需求未满足的地区进行,包括拉丁美洲(巴西、哥伦比亚、巴拿马、多米尼加共和国和尼加拉瓜)和亚洲(菲律宾、泰国和斯里兰卡)。
印度尼西亚经历了东南亚几乎一半的登革热疾病负担,是世界上登革热负担最重的国家之一。2022年上半年,印尼报告了超过6.3万例登革热病例,455个城市中有近600例患者死亡。去年12月,武田表示该疫苗的峰值销售额可能达到16亿美元。
武田疫苗事业部总裁Gary Dubin表示:“登革热可以影响任何生活在流行地区或前往流行地区的人。开发这种创新的登革热疫苗是一个令人兴奋的挑战,它在印度尼西亚获得批准是武田制药和公共卫生的一项重要成就。我们很自豪地将QDENGA作为一种新的登革热预防工具介绍给印度尼西亚人民,我们将继续与其他监管机构合作,使QDENGA在全球范围内可用。”

 研发追踪
研发追踪
 药时代
药时代  2026-02-13
2026-02-13
 82
82

 研发追踪
研发追踪
 医药魔方
医药魔方  2026-02-13
2026-02-13
 74
74

 研发追踪
研发追踪
 瞪羚社
瞪羚社  2026-02-13
2026-02-13
 70
70