 产业资讯
产业资讯
 药时代
药时代  2022-09-16
2022-09-16
 2454
2454
前言
2022年9月8日,FDA为Amylyx的“渐冻症”(ALS)新疗法AMX0035召开了第二次专家咨询委员会,专家们最终以7:2的投票结果支持该疗法获批上市,与第一次会议结果形成了鲜明对比。其实早在今年3月30日,药时代就第一次会议进行了报道并持续关注中。
两次会议结果真的是“大反转”吗?其实不然。因为这一切都是“有迹可循”。关于“渐冻症”,我们早已不陌生——几年前火热的“冰桶挑战”、著名物理学家斯蒂芬霍金的逝世、武汉抗疫英雄张定宇院长、京东副总裁蔡磊的自救......接踵而至的信息冲击着大众的神经,也引起了社会对“渐冻人”这一群体的广泛关注。之所以如此,在于ALS的3点恐怖之处:
发病隐匿,早期不易察觉。
发病后进展较快,绝大多数患者在确诊后通常寿命只有3-5年。
也是最重要的一点,目前没有药物可以治愈此病。目前已上市的药物仅能延缓病情进展,且效果都不尽人意。就在患者面临着“无药可治”的灰色阴霾下,焦急的ALS患者看到了一丝曙光——2021年一款ALS新疗法「AMX0035」的出现。
基于这样的“灰色的背景”下,FDA专家咨询委员会从第一次的6:4到第二次的7:2的“大反转”便变得“有迹可循”,因为小编发现了几个“矛盾点”......01FDA玩“变脸”,前后想法的“自相矛盾”
美国FDA于当地2022年9月6日晚,发布将再次审议“渐冻症”创新疗法AMX0035,这样的行为本身就可以称为是“不同寻常”的。值得一提的是,两次议题的变化——从“相关研究数据是否能够确证AMX0035有效”变为“相关临床试验数据,是否支持AMX0035获批上市。”看上去变化不大,但第二次议题还附加了一个“尾巴”:可以将ALS的严重性、未被满足的临床需求以及还没做完的三期临床试验的结果,纳入考量范围。不仅把临床需求加了进去,还劝专家把没做完的试验结果纳入考量,显而易见,FDA态度出现了“180°的反转”,以及改变想法的“自我矛盾”。首先是两次专家咨询委员会的召开多少有些“迫于无奈”。第一次会前,就有专家认为当时Amylyx提交的数据难以支撑AMX0035的有效性,且在统计学上发现了明显问题。并在会议上,指出了相关生物标志物数据只可能表明AMX0035 在阿尔茨海默症患者中具有药效学活性,而非ALS的漏洞。无独有偶,FDA在第二次会议前表明了Amylyx仍无法提供足够的数据来支持其批准。且在第二次会议上还强调了这些数据并非新数据,“只是基于原来申报NDA数据的一种新的分析方法”。即便如此,专家咨询委员会仍以7:2的较大优势赞成批准。FDA如此这般“反复横跳”,是因为存在着一个无法避免的根本矛盾———在特定情况下,监管机构职能与临床需求之间的“矛盾”。
监管机构职能与临床需求之间的“矛盾”
早在第一次会议上,专家咨询委员会就花了近2个小时来讨论公众提出的意见,不难看出公众意见给FDA带来多大的压力,尽管最后还是以6:4反对了Amylyx的申请,但这一决定也将FDA卷入了抨击浪潮之中。
美国ALS患者协会当时发表了一份言辞激烈的声明抨击了投票结果:你们现在有两个选择,第一,批准一款安全的药物帮助ALS患者;第二,推迟批准,等待更多的证据,然后眼睁睁看着更多的ALS患者死亡。如此压力下,第二次会议应声道来。我们可以看到FDA在第二次会前资料中写道,“FDA 处于一个充满挑战的境地,可能会做出随后与正在进行的研究结果不一致的监管决定。”
FDA等来了更多的证据吗?答案是没有,但是ALS患者等不及了......
第二次会议上,无论是支持方还是反对方,都各执一词。
支持方
从临床角度:印第安纳大学医学院教授Liana Apostolova表示,在ALS如此糟糕的预后面前,不希望放过任何可能有效的药物。
从患者角度:一位病人倡导者在电话的公开听证会上表述,ALS 患者没有时间等待试验结果,患者等不起。
反对方
约翰斯·霍普金斯大学降伯格公共卫生学院的教授 Caleb Alexander或许考虑到前段时间的 Covis Pharma 验证性试验失败后的不良案例,表示如果 AXS0035的III 期 Phoenix试验失败后,又该何去何从?
只有FDA处在“模棱两可”的“尴尬”境地。一方面,考虑到amylyx提供的数据本身存在漏洞且III 期 Phoenix 试验未完成;另一方面,FDA指出“ALS 存在大量未竟医疗需求”,可以在应用法定标准下适当的行使“最广泛的灵活性”。
这也就间接促成了7:2的大优势——虽然大多数专家会成员认为 AMX0035 的数据应更稳健,但一些专家在看到 Amylyx 的额外事后分析以及听取临床医生和患者的证词后改变了他们的投票。
其实在FDA的历史上,类似的案例(监管机构职能与临床需求存在“矛盾”)有很多,例如:去年关于Biogen阿尔兹海默病药物Aduhelm的讨论。这让小编不禁想起了前FDA顶级科学家王亚宁博士莅临药时代直播间时,曾对FDA专家咨询委员会的职能做过介绍:每位专家都被要求,必须以手上的资料为依据,不受其他信息影响,做出投票决定。
推荐阅读:翻看了几十篇资料后,前FDA顶级科学家王亚宁博士把这件事捋顺了(附演讲视频+PPT)
在“矛盾”中安身立命
正如王亚宁博士所说,作为一个监管机构本身的义务和准则就是对患者群体负责,对客观事实负责。
但我们也看到了任何事情都存在了多面性,特殊性,作为一个监管机构只能站在客观立场上维持天平的相对平衡。那么接下来FDA对Amylyx的处理可能就成为了处理其他罕见神经退行性疾病的一个“风向标”,重多药企在立项方面又会做出怎样的调整?
回顾一下Amylyx 的做法:Klee在第二次会议上发言称如果治疗无法使患者受益,或数据显示未利于患者就承诺对新疗法AMX0035进行撤销,或与监管机构和医生合作,来确保作出适当的解决。
在唯二的反对票中,约翰霍普金斯大学彭博公共卫生学院教授 Caleb Alexander指出可能发生的一种情况——即尽管 Phoenix 试验失败,该药仍难以撤出市场。但敢于做此承诺的药企并不多,可以见得——
Amylyx以“未被满足的临床需求”下的矛盾产物:“最广泛的灵活性”作为安身之本。又以患者为主要出发点,这与FDA的初衷不谋而合,终点都是为了患者。这便是立命之本。
ALS领域行业动态
目前,全球获批上市的适应症为ALS的药物有四款,其中FDA获批的有2款为EDARAVONE和Riluzole。

尽管ALS领域的研发举步维艰,但目前,全球已经约有67款药物进入临床阶段(不含中药),其中进展较快的Tofersen正在FDA申请上市、Alsitek正在EMA申请上市。9款药物已经进入临床3期,2款药物进入临床2/3期,25款药物进入临床2期,6款药物进入临床1/2期,其余均为临床1期。
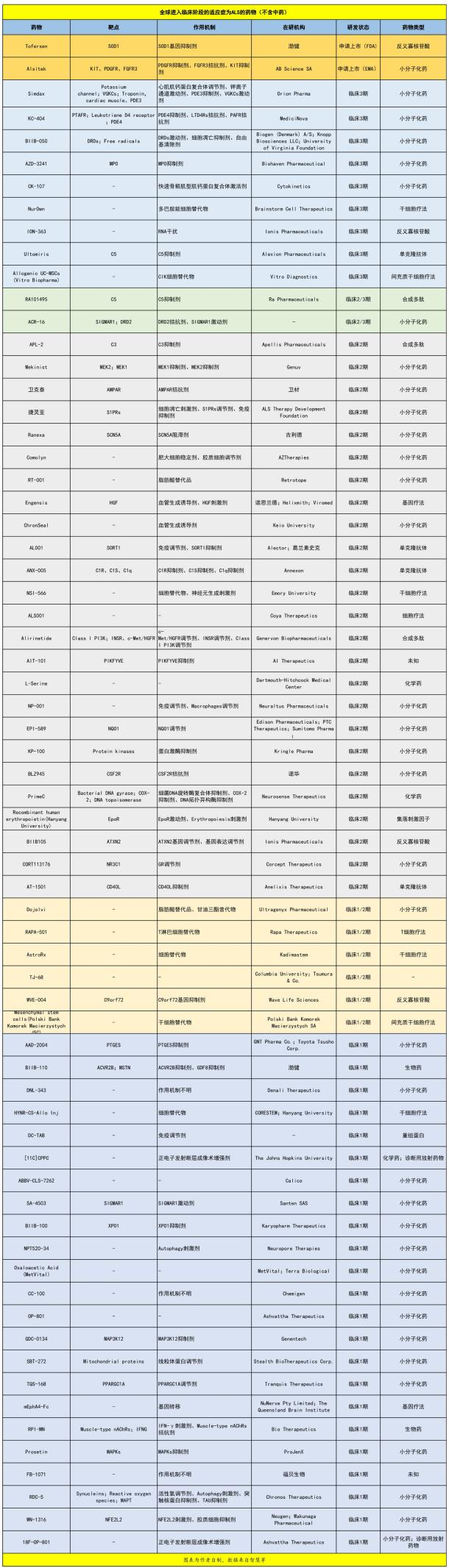
从以上图表中,我们可以看出,ALS领域的药物研发具有较大的差异化,药物类型非常丰富,有小分子化药、生物药、干细胞疗法、细胞疗法、基因疗法、反义寡核苷酸、单克隆抗体、合成多肽、化学药等。
结语
矛盾是人赋予的,只有把“矛盾”凸显出来,我们才能更好的发现问题,解决问题。至于Amylyx的Phoenix试验结果,成功当然是皆大欢喜,失败后Amylyx是否又能兑现承诺?药时代在持续关注中......关关难过关关过,事事难成事事成。药时代与君共勉。
参考资料:
1.Amylyx 肌萎缩侧索硬化症治疗药将第二次上专家会,似仍缺乏足够数据支持批准
2.ALS 治疗药获专家会投票赞成批准,后续临床试验若不成功承诺自愿撤销
3.6:4反对!开了7个半小时的会,FDA这次能扛住公众的压力吗?
4.Adcomm votes 7-2 in favor of Amylyx’s ALS drug on second take. But first the co-CEOs had to make a pledge – Endpoints News (endpts.com)
5.智慧芽官网
6.其他公开资料

 产业资讯
产业资讯
 清科研究
清科研究  2025-08-02
2025-08-02
 40
40

 产业资讯
产业资讯
 空之客
空之客  2025-08-02
2025-08-02
 42
42

 产业资讯
产业资讯
 医药魔方
医药魔方  2025-08-02
2025-08-02
 42
42