 研发追踪
研发追踪
 药明康德
药明康德  2022-09-26
2022-09-26
 4668
4668
今日,辉瑞(Pfizer)公司公布了两款口服GLP-1受体激动剂danuglipron和PF-07081532的最新临床试验结果。试验结果显示,两款口服GLP-1受体激动剂均在服用几周内,就开始显著降低患者的体重和血糖指标。辉瑞表示,这两款在研疗法具有成为潜在“best-in-class”口服GLP-1受体激动剂的潜力。
肥胖症和2型糖尿病代表着全球性的未竟医疗需求。据估计,到2030年,全球肥胖症患者将达到11.2亿,而2型糖尿病患者达到6.43亿。肥胖症会显著提高多种合并症的风险,包括超过200种慢性疾病。
胰高血糖素样肽1(GLP-1)是肠道细胞分泌的一种多肽类激素,它通过与GLP-1受体相结合,刺激胰岛素的分泌,并且抑制胰高血糖素的分泌,从而促进葡萄糖的新陈代谢。同时,它还能够能起到延缓胃排空和抑制食欲的后果。因此,它是治疗肥胖症和2型糖尿病的有力靶点。
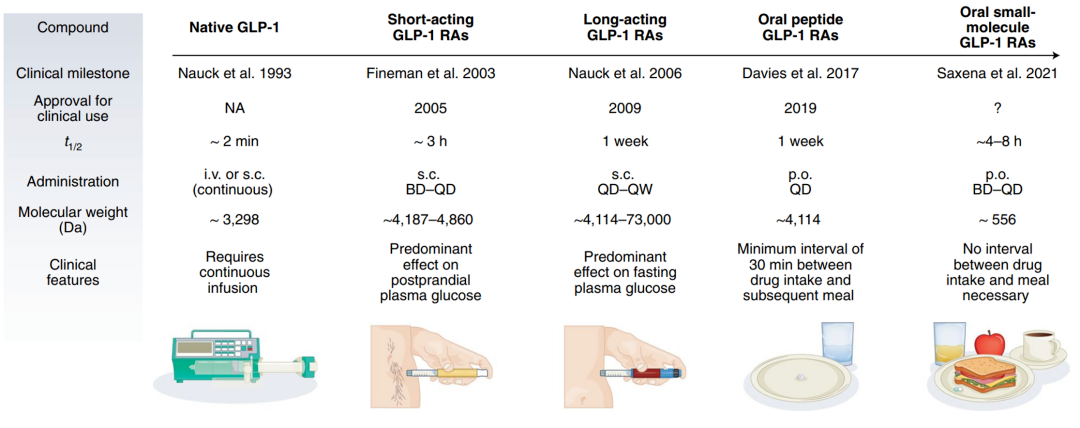
目前,已经有多款GLP-1类似物获批上市,它们通过对多肽结构的改造,不断延长GLP-1类似物的半衰期。比如诺和诺德的司美格鲁肽(semaglutide)的半衰期延长到了165个小时,它在2017年底获得FDA批准,成为每周注射一次的GLP-1受体激动剂。
不过这些药物均需要患者接受注射使用,患者更为倾向便捷的口服药物。2019年,诺和诺德的口服司美格鲁肽获得FDA批准上市,成为口服GLP-1受体激动剂开发的重要里程碑。这一配方将司美格鲁肽和吸收增强剂结合,在促进多肽吸收的同时防止它们被胃中肽酶降解。然而它仍然需要在特定时间服用来维持有效的吸收剂量。
▲GLP-1受体激动剂的不断演变(图片来源:参考资料[2])
辉瑞公司开发的danuglipron和PF-07081532是两款小分子GLP-1受体激动剂,与大分子GLP-1类似物不同的是,它们的服用更为简便,不受食物或者服用时间的限制。在danuglipron基础上优化的PF-07081532具有更长的半衰期,支持每日一次的口服使用。
今天辉瑞公布了PF-07081532在2型糖尿病和肥胖症患者中进行的1b期临床试验结果。试验结果显示,接受治疗6周后,接受每日一次PF-07081532治疗的2型糖尿病患者的空腹血糖水平显著下降,接近正常水平的阈值。

▲PF-07081532显著降低2型糖尿病患者的空腹血糖水平(图片来源:辉瑞官网)
同时,在2型糖尿病和肥胖症患者中,PF-07081532剂量依赖性降低患者的体重。接受最高剂量治疗的患者在接受治疗4-6周后体重平均比基线降低约10斤。
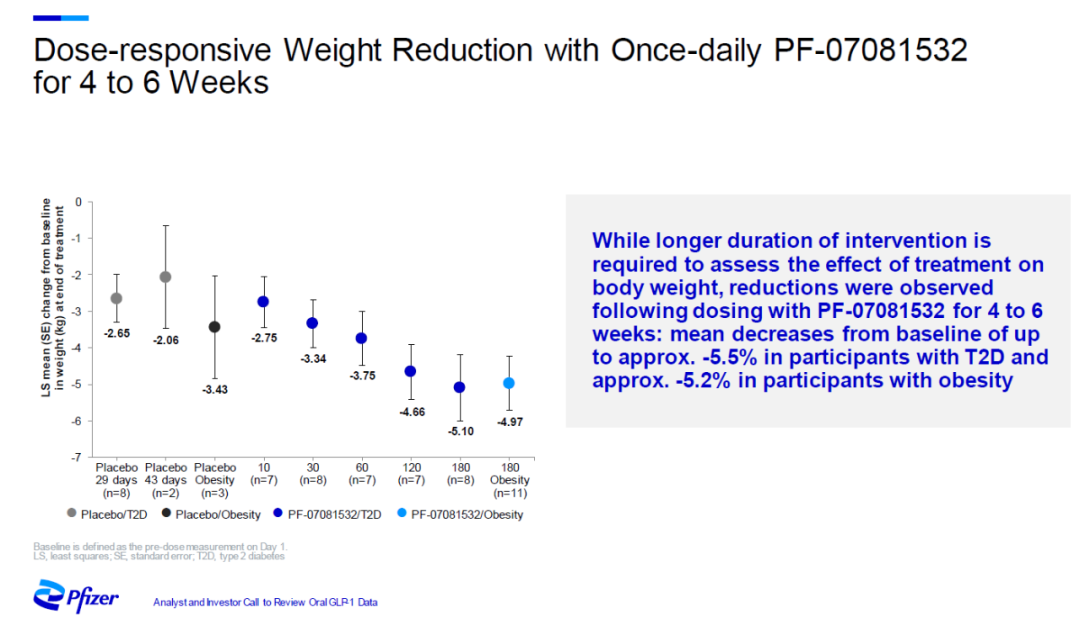
▲PF-07081532剂量依赖型降低患者体重(图片来源:辉瑞官网)
今天公布的试验结果还包括danuglipron在治疗2型糖尿病患者的2b期临床试验的16周结果。试验结果显示,在接受治疗16周之后,所有剂量组患者的糖化血红蛋白(HbA1c)水平与安慰剂相比均显著降低。在最高的两个剂量组(80 mg每日两次和120 mg每日两次),HbA1c水平与基线相比降低0.96和1.18个百分点。
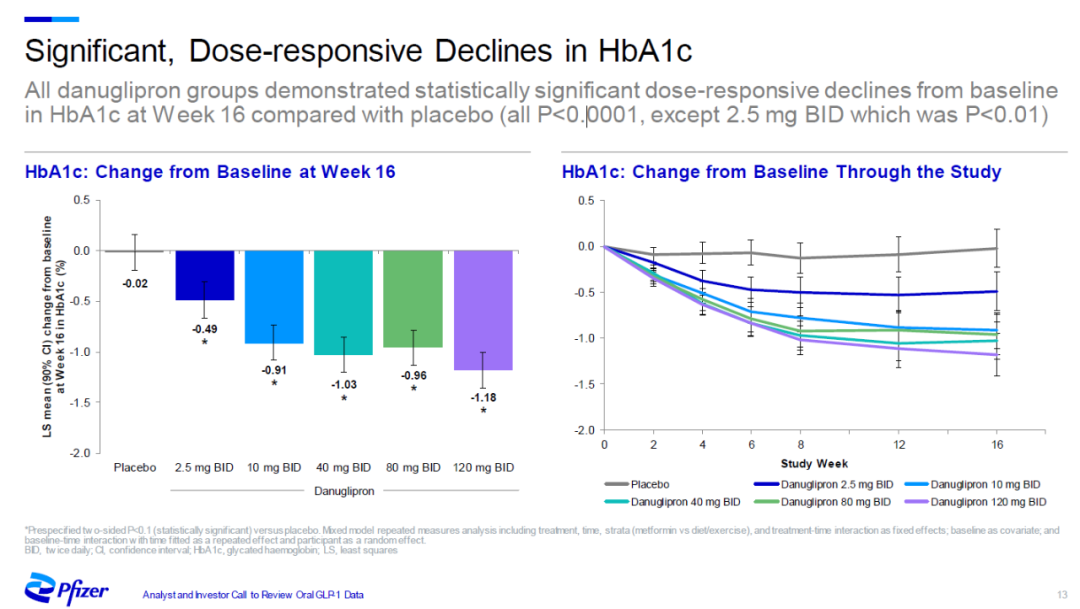
▲Danuglipron显著降低HbA1c水平(图片来源:辉瑞官网)
在降低患者体重方面,danuglipron也取得良好的效果,最高的两个剂量组患者的体重在16周后与安慰剂相比显著降低,最高剂量组平均体重降低接近10斤,并且没有达到平台期。

▲Danuglipron显著降低患者体重(图片来源:辉瑞官网)
安全性方面两款药物的耐受性和安全性与已有GLP-1受体激动剂相似,主要不良事件为轻度,最常见的不良事件为胃肠道反应,包括恶心、腹泻和呕吐。
基于这些积极结果,辉瑞计划开展2b期临床试验,进一步评估两款口服GLP-1受体激动剂的效果和安全性,并且根据综合结果,选择一款在研药物进入3期临床试验。
从第一款GLP-1受体激动剂药物获得FDA批准到口服司美格鲁肽上市。GLP-1受体激动剂已经经过了数次迭代,如今小分子口服GLP-1受体激动剂的进展,有望为2型糖尿病患者和肥胖症带来了更有效、更便捷的治疗手段。我们期待医药生态圈成员的共同努力,能够为广大患者带来更多更好的疗法。
出处:https://s28.q4cdn.com/781576035/files/doc_presentation/2022/09/2022-EASD-IR_Presentation_FINAL.pdf

 研发追踪
研发追踪
 药时代
药时代  2026-02-13
2026-02-13
 80
80

 研发追踪
研发追踪
 医药魔方
医药魔方  2026-02-13
2026-02-13
 71
71

 研发追踪
研发追踪
 瞪羚社
瞪羚社  2026-02-13
2026-02-13
 68
68