 产业资讯
产业资讯
 医药魔方
医药魔方  2022-10-28
2022-10-28
 4131
4131
10月26日,FDA就GSK的口服慢性肾病贫血(CKD)药物达普司他(daprodustat)召开了咨询委员会议,混合投票结果喜忧参半,一半支持,一半反对。

FDA心血管和肾脏药物咨询委员会(CRDAC)给出了两种投票结果。
针对透析依赖(DD)患者,投票结果为13票支持,3票否决,专家们认为,使用达普司他治疗的疗效可观,同时用药便利性可以大大减轻患者负担;另外与促红细胞生成素(ESA)相比,达普司他的心血管风险没有增加。
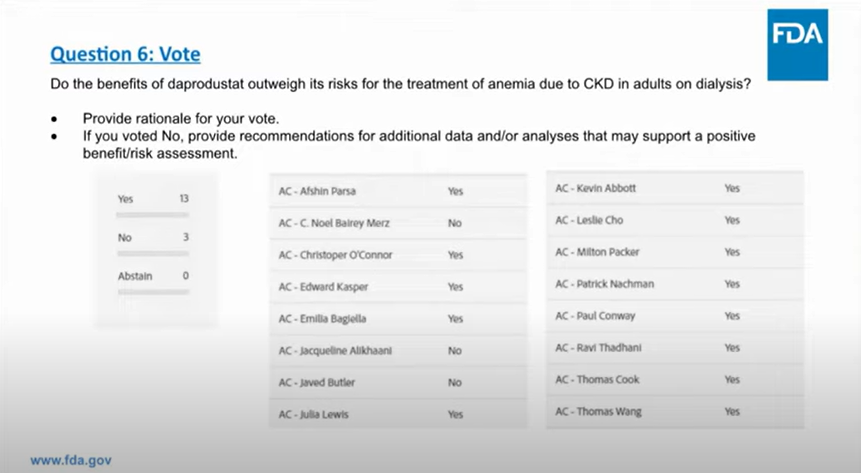
针对非透析依赖(NDD)患者,投票结果为11票否决,5票支持,专家们认为达普司他治疗风险太高,不仅会出现心力衰竭和胃糜烂出血(透析患者组也存在),还包括心脏病发作、中风,以及其他潜在并发症,治疗益处无法抵消其风险。
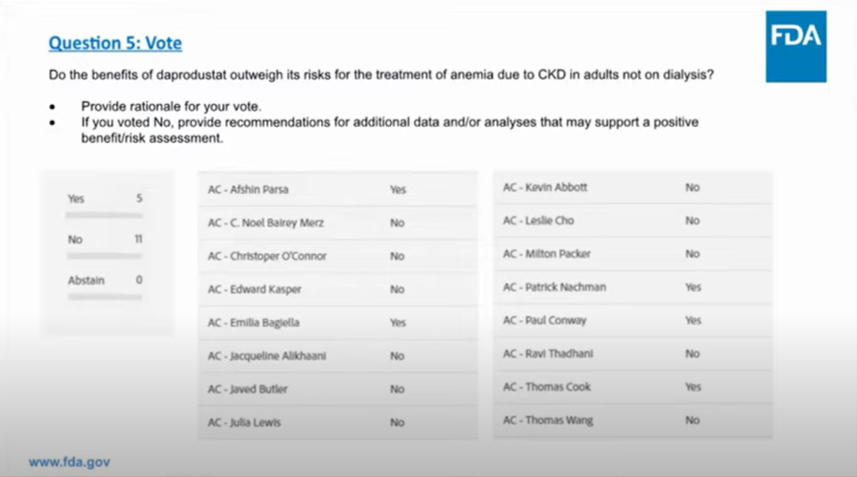
GSK收到投票结果后,表示对此感到高兴。
达普司他是一种新型口服缺氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI),于2020年6月在日本首次批准上市,用于治疗成人慢性肾病贫血。
全球首个上市的HIF-PHI类药物是阿斯利康/FibroGen的罗沙司他,目前已在中国、日本、欧盟等多个国家地区获批用于治疗NDD和DD成人慢性肾性贫血。但2021年8月,FDA因安全性问题(增加血栓、严重感染、死亡等风险),拒绝批准罗沙司他上市。
2022年3月底,另一款HIF-PHI类药物vadadustat的上市申请也遭到了FDA的拒绝,同样是安全性问题,获益-风险评估不能支持其上市。
至此,还没有HIF-PHI类药物在美国获批上市治疗慢性肾病贫血。
当投票结果一半支持一半反对的情况下,很难预测FDA会偏向哪一边。达普司他PDUFA日期为2023年2月1日,如果投票最终在FDA的决定中发挥作用,达普司他至少可以弥补之前两种HIF-PHI口服类药所遭受的挫折。
目前,全球已有6款用于慢性肾病贫血的HIF-PHI类药物,而国内上市的仅有罗沙司他。据阿斯利康财报,2021年罗沙司他销售额达到1.8亿美元,主要来源于中国市场。除罗沙司他,国内进展较快的有信立泰的恩那司他(已申报上市)以及康哲药业的德度司他(III期临床)。

 产业资讯
产业资讯
 医药财经
医药财经  2025-09-05
2025-09-05
 15
15

 产业资讯
产业资讯
 动脉网
动脉网  2025-09-05
2025-09-05
 15
15

 产业资讯
产业资讯
 新猎药人笔记
新猎药人笔记  2025-09-05
2025-09-05
 17
17