 产业资讯
产业资讯
 同写意
同写意  2022-10-28
2022-10-28
 3484
3484
过去两个月,蓝鸟生物接连在美国推出两款基因疗法,定价更是一路走高,最贵达到300万美元。受此影响,蓝鸟生物萎靡不振的股价终于有了一点起色。
但值得注意的,无论是Skysona还是Zynteglo,此前皆已在欧洲市场获批,商业化却并不理想。去年,蓝鸟生物由于跟支付方的谈判失败等因素,决定撤出欧洲市场,转道美国。蓝鸟生物的困境并不是个案,数据显示,不少基因疗法的制造商也相继在欧盟受挫。
在这篇文章中,Research Partnership回顾了为什么过去几年欧洲六项批准的基因疗法商业化之路并不顺利,并分享从其支付网络收集到的关于欧洲基因治疗市场准入前景的反馈。
2022年成为创纪录之年?
今年1月,再生医学联盟(ARM)的《细胞和基因行业状况》简报,将2022年指定为罕见疾病基因疗法批准的创纪录年份。但这并没有发生。截至今年9月,ARM名单上仅有三种基因疗法获得了EMA的批准,其中三种有望在2023年进入市场。
、
基因疗法的开发、制造和给病人使用都是复杂而昂贵的。基因疗法与高昂的材料成本相关,因此需要一个能反映其治疗价值的价格。对于超罕见病,受益的患者数量少,意味着需要高昂的价格来确保盈利,而事实证明,实现这一点具有挑战性。
虽然该行业仍然积极开发包括血液病和眼疾在内的罕见疾病领域的先进疗法(包括基因疗法),但从整个先进疗法部门向更普遍的疾病转移的趋势越来越明显。
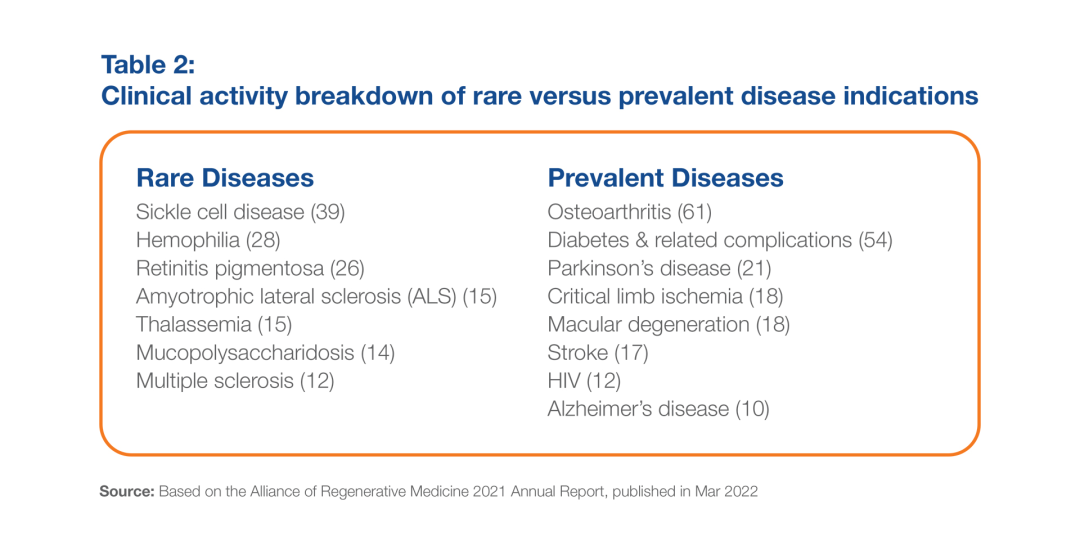
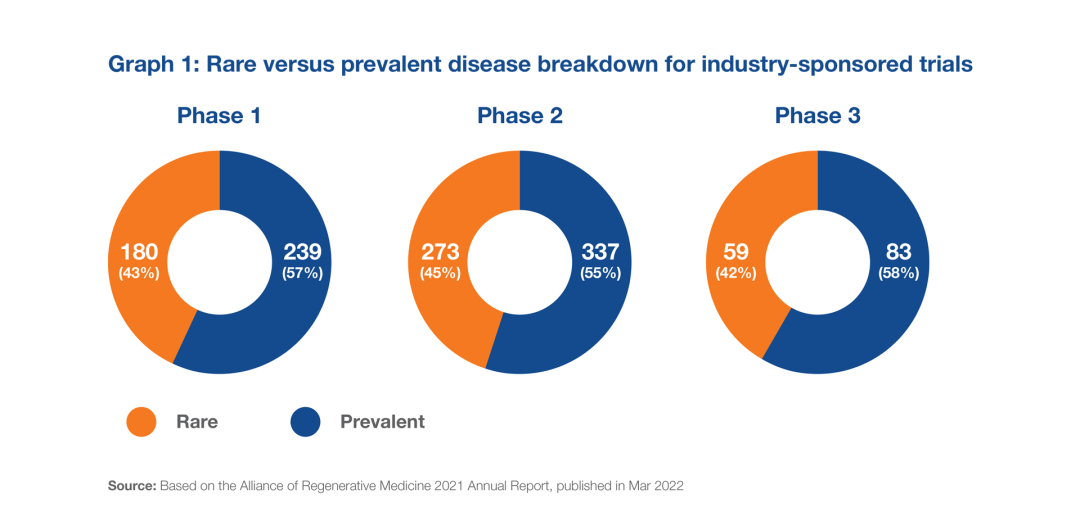
根据ARM的数据,在2405项先进治疗临床试验(包括行业和学术/政府资助的研究)中,只有59%的研究对象是ARM定义为“常见”的疾病。
基因疗法在路上“颠簸”
关于基因疗法的最新积极消息中,夹杂着一系列“又来了”的时刻。
2022年7月,意大利非营利组织Telethon基金会关于腺苷脱氨酶严重联合免疫缺陷症(ADA-SCID)的Strimvelis的决定,再次突显了一种超罕见病基因疗法商业化带来的经济挑战。当前许可证持有者Orchard Therapeutics由于缺乏经济可行性而选择退出该项目后,基金会决定独自负责Strimvelis的商业化。
下图显示了细胞和基因治疗在欧洲市场开拓的曲折历史。
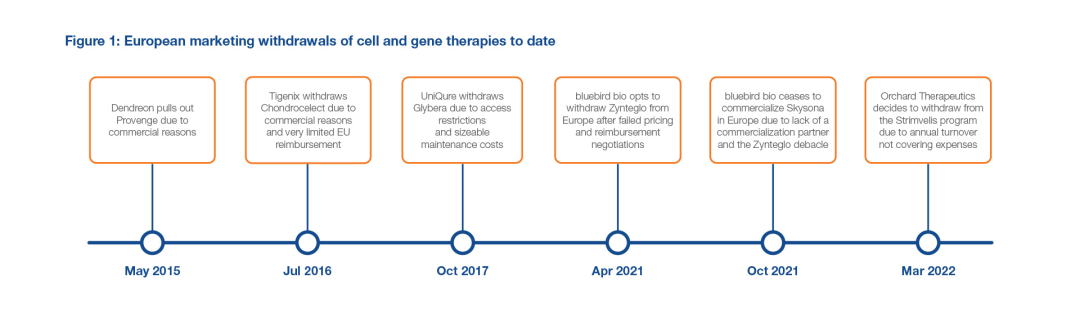
在Strimvelis开发之前,美国蓝鸟生物高调决定停止在欧洲的业务,原因是该公司与报销当局就其β-地中海贫血基因疗法Zynteglo进行了两年的谈判失败。
Zynteglo未能获得适当的价值认可,且无法确定商业化合作伙伴,导致该公司还撤回了其在欧洲的脑肾上腺脑白质营养不良(ALD)基因疗法Skysona的市场监管许可。Skysona是2021年EMA批准的唯一一种基因疗法。
当Telethon基金会介入拯救Strimvelis时,它回应了许多开发者的想法,称考虑到基因疗法与传统药物相比的独特性,科学进步还没有与基因疗法的监管、市场准入过程的充分发展相匹配。
基因疗法面临着一系列的证据生成挑战,包括治疗效果的大小和持续时间的不确定性、定义不清的患者群体、试验持续时间和规模的限制以及对单臂试验和替代终点的依赖。
与表征价值相关的挑战,使Research Partnership对卫生技术评估(HTA)机构和支付方应对即将涌入的具有固有高标价的基因疗法的准备情况感到好奇。从Research Partnership的全球网络中,研究人员联系了来自英国、法国、德国、西班牙和意大利的七个拥有基因治疗专业知识的支付方,以征求他们的看法。
当被问及他们国家的定价和补偿(P&R)系统的准备情况时,大多数支付方都认为,他们在一定程度上做好了准备。这种准备程度,部分与其对收集真实世界证据(RWE)的重要性的认识有关,这可以在启动时解决证据的不确定性。
受访者普遍觉得,RWE有一定的重要性。然而,一个法国支付方强调,这取决于目标和背景。法国卫生咨询机构Haute Autorité de santé’s (HAS’s )对基因疗法的最新评估,要求RWE收集作为重新评估的一部分,包括监测数据作为早期访问计划的一部分。
德国支付方指出,德国联邦联合委员会(G-BA)会选择某些EMA有条件批准的产品和孤儿药,即必须作为强制RWE数据收集注册的一部分的产品。虽然预计只针对选定的产品,但注册要求旨在帮助克服上市时证据不足带来的不确定性。在第一个测试案例后,治疗脊髓性肌肉萎缩的Zolgensma和A型血友病的Roctavian是下一个接受注册的基因疗法。
Zynteglo退出欧洲的影响
大多数接受采访的支付方预计,Zynteglo的挑战将对未来其他基因疗法的P&R评估产生中度至高度的负面影响。
只有三个受访者(其中两个来自法国)认为此举不会产生影响。一个法国支付方强调,对于12岁以上至35岁以下的患者,HAS授予Zynteglo III级临床疗效改善状况(ASMR)评级。这意味着它处于有利地位,可以从法国卫生产品经济委员会(CEPS)获得高价,直到谈判因上市许可撤回而停止。
德国支付方认为,Zynteglo的标价是157.5万欧元,这是导致该公司商业化失败的主要原因之一。在德国《医药产品市场的改革法案(AMNOG)》仲裁委员会的审理过程中,考虑到每年输血的成本非常低,这个价格是不合理的。
在蓝鸟生物无法与德国国家法定健康保险基金协会(GKV-SV)就最终补偿价格达成一致后,仲裁委员会召开了会议。根据欧洲制药企业家联合会(EUCOPE)的说法,这不是G-BA的错,而是GKV-SV在不承认基于绩效的担保方面采取的强硬路线。
年金支付在某些地区落地
关于创新的付费模式以更好地反映基因治疗的价值,已经有了相当多的讨论,但讨论的数量没有与实施相匹配。找到一种方法来真正实现它们的价值并克服不确定性,这一点仍然具有挑战性。
随着更多基因疗法的涌入,与下表中列出的其他模式相比,Research Partnership调查的支付方对以下模式更加开放,包括基于结果的支付(非年金)、年金支付(基于结果)和价格数量协议。

基于结果的支付(非年金)模型,在德国已被个人疾病基金用于迄今商业化了的基因疗法。GKV-SV层面上,对通过强制注册表数据收集进行证据开发的产品,更常见的是使用一次性支付。
在德国和法国,年金支付(基于结果)模式正在成为可能,这种模式将允许基因治疗的高额前期费用在多年中分摊。
截至2022年3月,德国国内围绕修改GKV-FKG法案2021年高成本治疗风险池机制(取消分期付款合同的激励机制)展开了争论。而法国方面,2021年3月出台的CEPS-创新药品行业协会LEEM框架协议,包括了合同修正案,可能会在几年内实现分摊支付,但这些修正案尚未落实到立法中。
开发跨境通道的重要性
除了国家市场准入挑战外,特别是在超罕见领域,制造商还必须通过欧盟的跨境报销途径。根据该途径,欧盟公民有权在任何欧盟国家获得医疗保健服务,并由其母国报销医疗费用。
由于患者管理的复杂性和所需的临床专业知识,这一途径正在成为治疗严重遗传和超罕见疾病的产品的关键市场准入途径,对于这些疾病,往往需要优质的专家中心。尽管英国脱欧,但在2022年2月,Orchard宣布,患者将能够利用跨境途径从英国的中心(欧洲五个中心之一)获得其基因疗法Libmeldy。
尽管像Orchard这样的药企在使用这个框架,但业界认为它并不适合。关键障碍是复杂性和不透明的自由裁量批准过程,特别是对于在患者所在国没有良好P&R结果的产品。
行业似乎还需要更好的规划。在Research Partnership的研究中,七个支付方中只有两个(分别来自德国、法国)表示,他们的国家为管理这一途径做好了充分准备。
有趣的是,欧盟新的联合临床评估计划于2025年开始对先进疗法进行评估,但接受采访的支付方并不指望这能够帮助跨境途径充分发挥其潜力。一个法国支付方称,这是因为P&R决策将继续在全国范围内进行。
需要政策回应的思维转变
在跨境考虑方面,制药产业有必要继续进行游说,要求提高透明度和理解,以便简化罕见病的基因疗法的指导,作为另一种市场准入途径。尽管为2025年欧盟HTA先进疗法的节点做准备是至关重要的,但国家P&R决定将继续左右着基因疗法的商业命运。
Strimvelis的案例也强调,需要一个政策环境来支持在罕见疾病的基因治疗方面取得的进展。这离不开有关该领域的经济挑战的认识,此类挑战对定价有影响。重要的是,基因治疗的前景可以在罕见病适应症中得到满足,尽管最终价值可能更多地取决于常见疾病的适应症。
在追求这些适应症的过程中,基因治疗商业化代表着一场“极端风暴”,因为经济可持续性的问题变得尖锐。Research Partnership认为,除了潜在的高预算影响之外,β-地中海贫血和血友病等疾病的未满足需求,并不比“天价药”Zolgensma治疗的脊髓性肌肉萎缩症更高。此外,在这种情况下,对照药物的价格通常要低得多。
这意味着,HTA机构和支付者将继续要求更多的数据,来证明报销这类基因疗法的合理性。因此,正如英国的一项调查所强调的那样,对于药企而言,从这些利益相关者那里寻求数据要求和期望的早期反馈是很重要的。这些反馈应该涉及一系列方面,包括临床试验设计、经济建模计划、额外的数据收集要求和合适的支付模式。
为了提高启动时的HTA/P&R结果,关键是要加强证据生成计划,以显示潜在的药效终生持久性和获取额外的价值元素。承诺长期持续提交上市后数据、后续关键临床试验数据和RWE收集,可以支持这方面的工作。临床试验中与健康相关的生活质量的直接测量,也有助于证明生活质量的改善。
持续进行HTA机构和支付方教育,对改变思维方式是必要的,特别是在涉及常见疾病的治疗时。这将有助于增加支付意愿和支持,推动更大的HTA/P&R流程调整,同时减少对预算影响、卫生系统可持续性和行政负担的担忧。
创新的支付模式,例如基于结果和年金的模式,是确保收集相关数据的潜在解决方案,以减少支付方对这些疗法有效性的长期不确定性,同时提供合理的投资回报。然而,这种模型的开发和实现是复杂的。支付方还可以通过将其费用分摊到与成果展示相关的几年,进而解决可负担性/预算影响问题,但这有赖于更大的灵活性和立法改革。在获得EMA有条件批准后,所有人都在关注Roctavian如何在欧盟P&R领域取得成功。
参考文献:
1.定价300万美元!全球最贵基因疗法会让蓝鸟生物再次腾飞吗?
2.风口起飞:基因疗法的价格会越来越高吗?
3.写意讨论|基因治疗药物开发的未来之路
41.Gene therapies for prevalent diseases in Europe – the perfect storm of economic sustainability?;pharmaphorum

 产业资讯
产业资讯
 创奇健康研究院
创奇健康研究院  2025-11-05
2025-11-05
 39
39

 产业资讯
产业资讯
 21新健康
21新健康  2025-11-05
2025-11-05
 38
38

 产业资讯
产业资讯
 药时代
药时代  2025-11-05
2025-11-05
 39
39