 产业资讯
产业资讯
 IQVIA艾昆纬
IQVIA艾昆纬  2022-11-10
2022-11-10
 2922
2922
尽管目前用于成人癌症的靶向和免疫肿瘤疗法众多,但针对儿童癌症这一未满足的需求,新药开发却一直进展缓慢。例如,在2018年FDA批准用于成人肿瘤适应症的36种药物(包括生物类似药)中,64%涉及已完成或正在进行的儿童人群试验。然而,在最终获得FDA批准的肿瘤药物中,从首次人体试验到首次儿童试验的中位滞后时间为6.5年,且仅5%获批药物的初始批准包括了儿童。
导致儿童癌症药物开发滞后的原因有两个:首先,在儿童中进行研究的药物很大程度上是根据成人适应症选择的,导致开发模式是基于和成人相似的适应症,而不是基于成人和儿童都会出现的病症;其次,需要很长的时间才能在儿童中开始临床试验,并且能否开始还通常取决于成人适应症的监管批准。
本文将摘录IQVIA Institute报告《推进儿童癌症研究:的影响和意义》。

1 《RACE法案》的目标
美国《加速儿童治疗及平等法案》(RACE法案)于2017年获得美国国会通过,并于2020年8月18日颁布。这项立法旨在加速对正在研究的成人癌症疗法进行早期儿科评价,并“最终促进为儿童患者开发合适的新疗法”。这项立法要求根据分子作用机制而非临床适应症对某些具有新活性成分的成人癌症靶向药物进行儿科研究。这适用于针对FDA确定的“与儿科癌症发生或进展实质性相关”的分子靶标的治疗。一些证据表明,部分成人癌症的遗传和其他分子生物脆弱性也存在于儿童癌症中,而高达一半的儿童癌症可能涉及分子异常,可通过已获批用于成人的靶向药物进行治疗,这项法案对这些证据进行了回应。
2 《RACE法案》的影响
IQVIA Institute的一项分析指出,近一半的晚期癌症药物临床试验具有RACE定义的分子靶标。
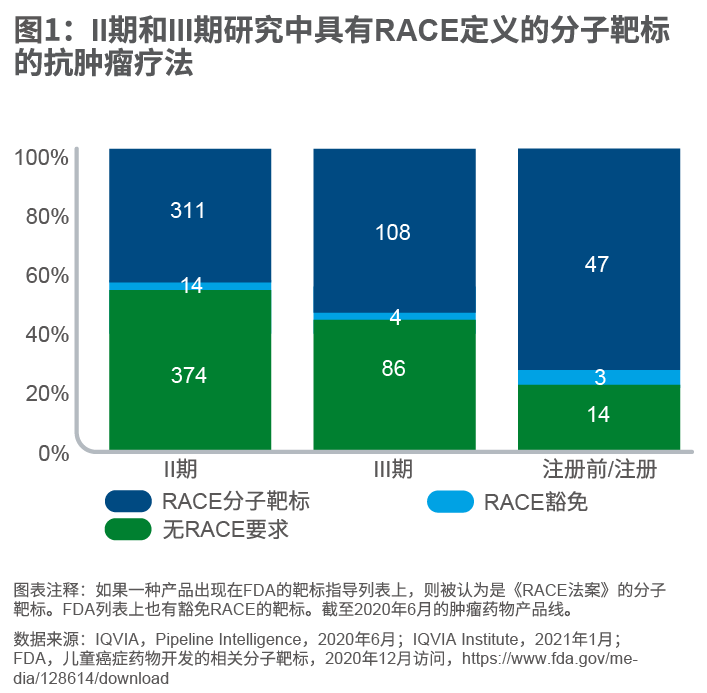
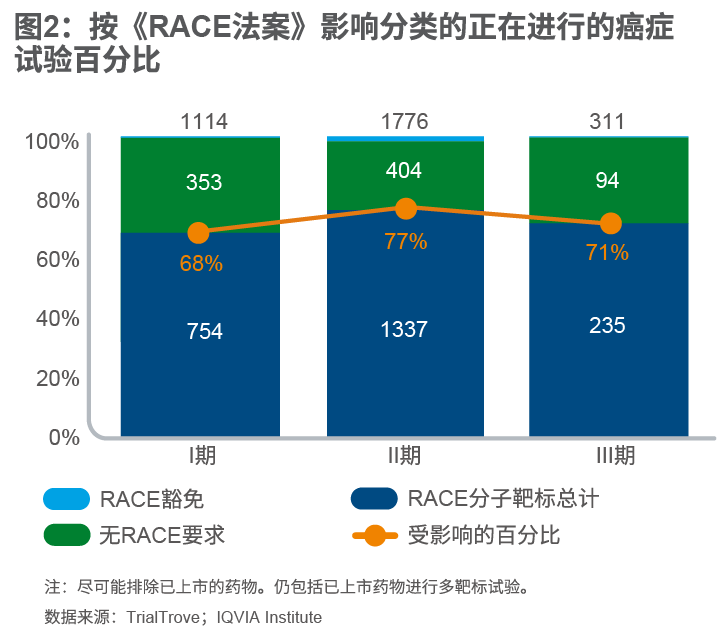
此外,超过70%正在进行的癌症试验涉及具有RACE定义的分子靶标的药物。
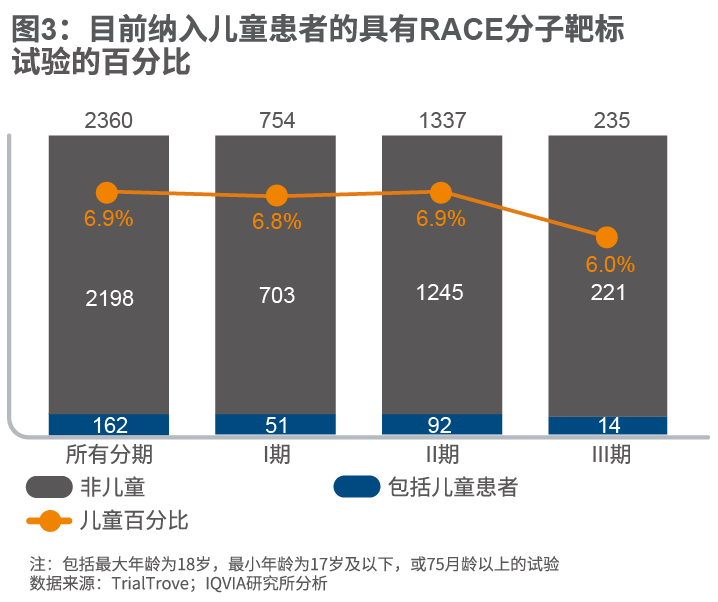
在使用具有RACE定义的分子靶标的药物进行的试验中,仅6.9%包括儿童年龄组参与者。
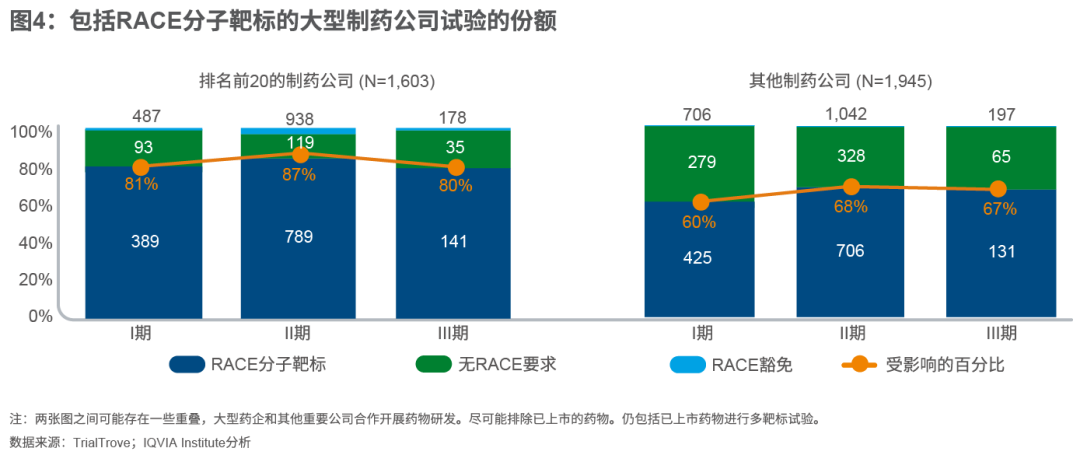
最后,IQVIA Institute的分析发现,在大型(前20大)制药公司申办的试验中,约85%是针对具有RACE定义的分子靶标的药物,而在小型公司申办的试验中,则为65%。
3 满足RACE要求的儿童抗癌药物研发所面临的挑战
由于儿童癌症患者数量较少、存在脆弱性、分子靶标列表和豁免要求的复杂性以及儿科药物研究延迟和不能完成的可能性,满足《RACE法案》要求也会面临一些挑战,如儿童癌症较为罕见;儿童患者有特定的脆弱性和发育问题;必须了解儿科分子靶标列表和豁免以及有可能出现儿科研究延迟或未完成的情况。
4 所有利益相关方均可助力《RACE法案》
所有临床试验利益相关方-包括监管方、患者和家长、肿瘤药物研发人员、药企和政策制定者,都将在实现《RACE法案》的目标方面发挥关键作用。
《RACE法案》促进了肿瘤学和儿科科学研究系统地进一步合作、推广、共享和连接。迄今为止,《RACE法案》的最大影响是改变了人们对儿科肿瘤临床发展范式的期望,强调所有利益相关方之间需要建立伙伴关系,包括患者和家长群体、制药公司、FDA、儿科肿瘤研究者和国内外的合作团体。《RACE法案》已在这方面取得了成功。推动立法取得成功的其他因素包括:
扩大科学证据基础,以确定儿童癌症中生物学相关的分子靶标,并确定正在开发的用于成人的新靶向肿瘤药物对儿童的潜在适用性。
让癌症儿童有公平的机会可以获得精准肿瘤治疗,包括新的靶向药物、小分子、免疫肿瘤药物、单克隆抗体、抗体药物偶联物、双特异性抗体以及细胞和基因治疗。
缩短首次人体试验到首次儿童试验的时间。
5 下一步行动和优先级
作为FDA的一项倡议,《RACE法案》代表了儿科肿瘤学向前迈出的重要一步,全球合作框架将推动这一法案的成功。这项立法可以为临床试验带来益处,特别是平台和篮子试验等主方案;克服利益相关方之间共享数据的障碍;推进儿科肿瘤药物分子靶标的优先次序和次级优先次序。
①协调国际监管的一致性
FDA将在确定儿童药物发展的优先次序方面发挥重要作用,基于预期的获批水平,可能授权试验同时研究多种疗法。从行业角度来看,国际监管机构之间的合作将颇有裨益。这可能有助于改变目前监管机构对同一问题给出不同答案的现状。据报道称,这种情况正在改善,但除非能够直接接触到世界各地的立法者和决策者,否则监管意义上的完全统一是不太可能实现的。
②所有利益相关方“力往一处使”
对于征求所有利益相关方的意见而言,协调一致对于设计更优的临床试验非常重要。通过纳入所有利益相关方的观点,可以向临床医生提供尽可能最佳的试验方案。这也为设计可成功有效完成的试验提供了最大的机会,并将提供足够的数据来表征药物,设计具有意义的终点,从而避免了由于数据不足而需要在未来进行重复试验。即使结果试验未达到某个缓解率或预定终点,试验结果也能提供信息,也可以帮助回答为什么研究没有达到终点;下一次应该采取什么不同的方法;以及这个结果可能对该类其他药物或同一类型、同一诊断类别的其他肿瘤有什么启示。
③增强患者及组织、学术界和CRO的作用
患者和家长的观点对今后的发展至关重要,包括什么是最迫切的需求,以及可以接受何种程度的风险等观点。学术界也有机会在推动临床试验方面发挥更大的作用,包括定义和优先考虑能够满足最大未满足患者需求的药物。这可以逐渐取代目前单家公司为特定药物试验寻找患者人群的做法。此外,CRO可以帮助弥合临床试验网络和合作方的努力、公司需求和提供监管级数据以支持新药注册要求之间的差距;其他利益相关方可能资源不足,无法进行必要的研究中心监测和数据质量检查。CRO还可以帮助协调合作决策,决定在特定的罕见患者群体中进行哪些试验,避免重复工作,优化效率,并可以降低成人数据被破坏的可能性。
④主要目标:帮助癌症患儿
所有利益相关方都有一个共同的目标,那就是改善癌症患儿的现有治疗方法。通过早期参与和合作,每个利益相关方团体的专业知识都可以尽可能高效和有效地推进儿科肿瘤学。除了通过激励来帮助这些缺医少药的患者群体外,在候选药物早期初步评估之后也可以实施诸如排他性等监管激励措施,或其他刺激药物开发的潜在措施。一旦药物进入I期试验,应尽快开始与专家进行早期讨论。这将为公司提供足够的时间来生成关于药物的息,然后与专家讨论决定是否申请豁免。《RACE法案》的立法目的不是增加试验的数量,而是在早期评估的基础上更仔细地确定试验目标。

 产业资讯
产业资讯
 同写意
同写意  2025-05-17
2025-05-17
 40
40

 产业资讯
产业资讯
 一度医药
一度医药  2025-05-17
2025-05-17
 38
38

 产业资讯
产业资讯
 Being科学
Being科学  2025-05-17
2025-05-17
 34
34