 产业资讯
产业资讯
 智银医药
智银医药  2022-11-29
2022-11-29
 4609
4609
一、A“X”C概况
1.1.定义与分类
根据2022年7月发布的《抗体偶联药物非临床研究技术指导原则(征求意见稿)》,抗体偶联药物(Antibody-DrugConjugate,ADC)是指通过连接子将小分子化合物偶联至靶向性抗体或抗体片段上的一类生物技术药物,旨在增强药物靶向性和稳定性、减少临床毒副反应、提高治疗指数,临床上主要应用于抗肿瘤或者其它疾病的靶向治疗。
A“X”C是将抗体的偶联对象范围扩大,得到的一系列偶联产物。包括:抗体-生物聚合物偶联物(ABC),抗体-寡核苷酸偶联物(AOC),抗体-细胞偶联物(ACC)等。
1.2.发展历程
据世界卫生组织公布的《2020年全球最新癌症负担数据》,2020年全球有36种癌症,总发病率高达1930万,死亡人数接近1000万。可见,癌症是危害人类健康的重要疾病。一直以来,人们致力于癌症治疗的研究,从中发现了细胞毒性药物与单克隆抗体。
1940年,细胞毒性药物出现;1970年,单克隆抗体技术出现。细胞毒性药物具有足够的攻击性,但同时杀灭骨髓、胃肠道等中正常增殖的细胞,造成严重的全身不良反应;与之相反,单克隆抗体能够与肿瘤细胞表面的抗原特异性结合,这个特点决定了它高度的靶向性,但其效果较弱,难以独自完成杀灭肿瘤细胞的任务。
如何令二者优劣互补,合作共赢?早在1913年,德国诺奖得主保罗·埃尔利希(PaulEhrlich)便提出“魔法子弹”一设想,即将毒素安装在特异性载体上实现精准攻击。单克隆抗体和细胞毒性药物的出现,恰恰促使这一设想成为现实。以二者为基础,人们发展出抗体偶联药物(ADC)。至今,ADC展现出巨大的潜力,成为肿瘤治疗领域继化学治疗、靶向治疗、免疫治疗后一颗冉冉升起的新星。
2000年Mylotarg上市,成为第一款上市ADC,但由于不良反应,于2010年撤市;2011年Adcetris上市、2013年Kadcyla上市,二者取得很大成功,使得ADC重回人们视野;2017至今,ADC爆发性增长,5年上市了11个新药。
目前,ADC可以分为三代:
(1)第一代ADC采用鼠源抗体,与长春碱、阿霉素等载荷通过不可裂解连接子进行随机偶联,DAR不可控,具有抗原特异性低、载荷不够强、连接子不稳定等特点,代表包括:Mylotarg;
(2)第二代ADC采用人源化抗体,与微管蛋白抑制剂等载荷通过可裂解或不可裂解连接子进行随机偶联,DAR为4-8,与第一代相比抗原特异性增强、载荷毒性更强、连接子更稳定,但由于采用随机偶联,DAR不够均一,治疗窗口狭窄,代表包括:Adcetris、Kadcyla、Besponsa等;
(3)第三代ADC采用人源化抗体或全人源抗体,与微管蛋白抑制剂、DNA抑制剂等载荷通过可裂解或不可裂解连接子进行定点偶联,DAR为2-4,与第二代相比采用定点偶联,均一性提高,载荷毒性更有效,药物的稳定性和药效更好,代表包括:Povily、Padcev、Enhertu等;
图表1:三代ADC的特点

数据来源:美柏医健、智银医药资料库
(4)目前研究人员正致力于发展第四代ADC,以提高DAR、降低毒素毒性、减少不良反应、解决连接子脱落问题。
随着相关技术的不断发展,这一概念的适用领域不断扩大,人们改变偶联对象,组合出不同的偶联产品,比如:小分子偶联药物(SMDC)、多肽偶联药物(PDC)、抗体片段偶联药物(FDC)、病毒药物偶联物(VDC)等。其中,以抗体作为一个偶联对象,得到一系列A“X”C产品。
1.3.A“X”C分类
A“X”C中抗体的偶联对象包括:小分子药物、细菌外毒素、放射性核素等。目前,A“X”C正处于发展期,其中ADC占据主流。
图表2:A“X”C的分类
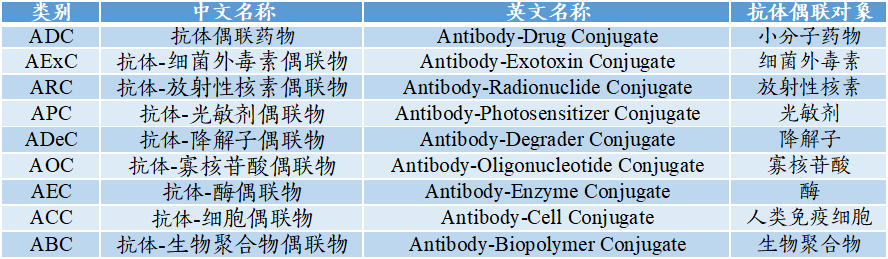
数据来源:凯莱英药闻、智银医药资料库
1.4.ADC技术分析
ADC由三部分组成,结构精巧,分工明确,有“生物导弹”之称。抗体负责特异性识别癌细胞表面的抗原,是精准的“制导系统”;药物载荷负责杀灭癌细胞,是强力的“弹头”;连接子则是负责连接抗体和药物的“弹体结构”。抗体、连接子、药物各司其职、各尽其才,使得ADC集结了单克隆抗体的高靶向性、小分子载荷的高杀伤力,成为名副其实的抗癌药物黑马。
1.4.1.抗原
与正常细胞相比,癌细胞表面部分细胞表面蛋白、糖蛋白或糖类出现过表达或突变现象,这些特异性物质为癌细胞的靶向识别提供基础,即为抗原。
理想的ADC抗原满足以下标准:(1)在肿瘤细胞表面均匀表达,在健康组织中低表达;(2)能够诱导内吞,使载荷在细胞内释放。
在ADC中,针对不同类型的癌症抗原靶点分布如下。
图表3:ADC中抗原靶点
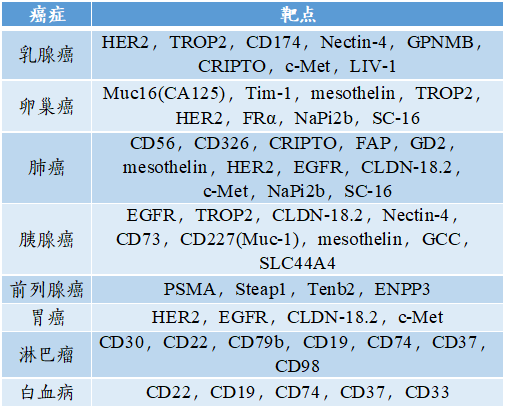
数据来源:健康界、智银医药资料库
1.4.2.抗体
抗体是能够与抗原特异性结合的免疫球蛋白,具有靶向抗癌的作用,机理包括:(1)免疫介导功能,如抗体依赖的细胞毒性(ADCC);(2)补体依赖的细胞毒性(CDC);(3)抗体依赖的吞噬作用(ADCP);(4)干扰肿瘤细胞的信号调节通路;(5)消灭循环肿瘤细胞;(6)细胞凋亡;(7)T细胞功能的免疫调节。
抗体的选择需要考虑:(1)靶向性;(2)合适的亲和性,既能够在肿瘤靶向部位富集,又不至于亲和性过大与ADC造成靶点竞争(DAR不均一导致可能存在无载荷或低载荷抗体,这些抗体与正常药物竞争靶点,影响药效)。
★能够产生免疫作用的几类主要免疫球蛋白包括:IgD、IgM、IgA、IgE、IgG。
图表4:能够产生免疫作用的免疫球蛋白类型
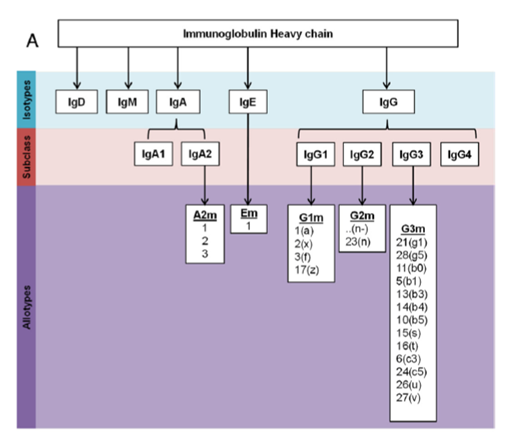
数据来源:V.Irani,A.J.Guy,A.Dean,etal.,Mol.Immunol.2015,67,171-182.、智银医药资料库
IgG在抗体治疗中最常见。该蛋白的分子量为150kDa左右,由两条重链与两条轻链组成,包括IgG1、IgG2、IgG3、IgG4四种:
(1)IgG1产生的ADCC和ADCP的效果好,半衰期长,与FcγR的亲和性强,应用最广泛;
(2)lgG2产生ADCC和ADCP的效果很弱,与FcγR的亲和性弱,应用少;
(3)lgG4产生ADCC和ADCP的效果欠佳,与FcγR的亲和性强,与IgG1相比,会进行动态Fab臂交换,造成脱靶效应,应用较少;
(4)IgG3产生ADCC和ADCP的效果好,与FcγR的亲和性强,但无应用,原因如下:1)有一条延长的铰链,容易被蛋白酶解;2)人群差异性大;3)纯化困难;4)血清半衰期短,大概7天,其余三者均能达到21天。
在目前上市的ADC中,仅2款药物(Mylotarg,Besponsa)使用了IgG4,其余均使用IgG1。
图表5:四种IgG性质比较
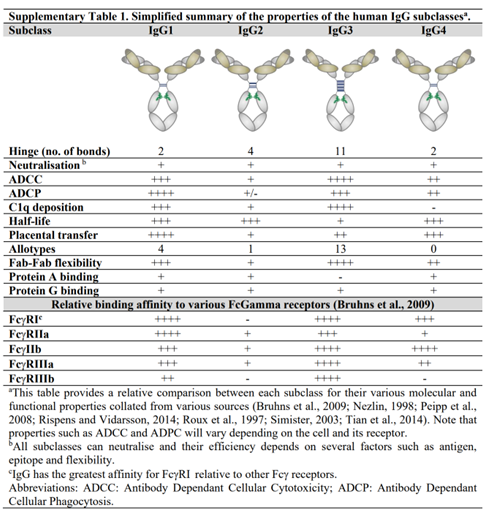
数据来源:V.Irani,A.J.Guy,A.Dean,etal.,Mol.Immunol.2015,67,171-182.、智银医药资料库
★目前,抗体的主要制备方法为单克隆抗体技术。
1975年,杂交瘤细胞技术逐渐成熟,以此为基础,科学家们制备出单克隆抗体。最早用于临床的是鼠单克隆抗体,但该抗体属于异体蛋白,免疫原性强,循环消除现象严重。随着重组DNA技术等的发展,科学家们发展并使用嵌合单抗(65%人源)、人源单抗(95%人源)和全人单抗(100%人源)。嵌合单抗保留鼠源抗体的链可变区(Fv),用人源抗体的链恒定区代替鼠源抗体的链恒定区,降低了排斥反应;人源抗体仅保留了必要的鼠抗原识别基团(CDRs),再次降低了排斥反应;全人源抗体即抗体的全部氨基酸序列都源于人类,排斥反应更低。
图表6:不同单克隆抗体的结构
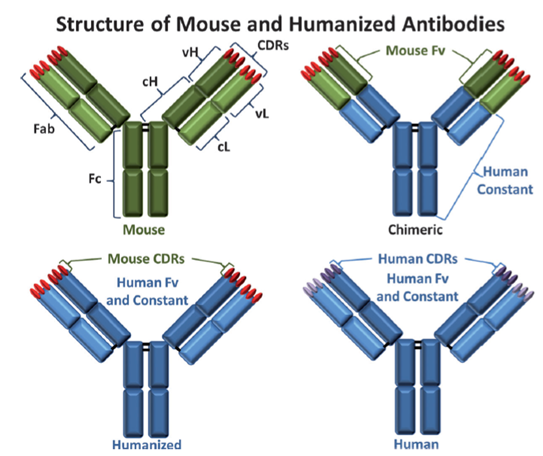
数据来源:R.V.J.Chari,L.M.Michael,C.W.Wayne,Angew.Chem.Int.Ed.2014,53,3796-3827.、智银医药资料库
1.4.3.药物载荷
药物载荷应满足:(1)高细胞毒性。由于只有2%左右的注射ADC能分布在肿瘤中,载荷的IC50应达到纳摩尔或皮摩尔级别;(2)存在可以用于偶联的官能团;(3)生理环境下稳定;(4)半衰期短。减少脱落引起的不良反应。
目前常用的药物载荷包括微管蛋白抑制剂和DNA抑制剂。
图表7:ADC药物载荷分类
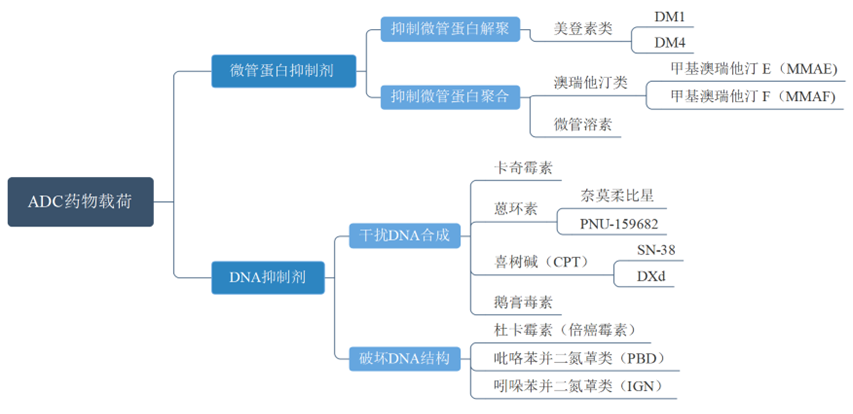
数据来源:P.Zhao,Y.Zhang,W.Li,etal.,ActaPharm.Sin.B2020,10,1589-1600.、智银医药资料库
★微管蛋白抑制剂通过抑制微管蛋白解聚或聚合,起到抗癌作用,包括:美登素类、澳瑞他汀类、微管溶素等。
(1)美登素类:从非洲灌木中分离出来的天然产物,能够抑制微管蛋白解聚。IC50能够达到皮摩尔,血液中稳定,治疗指数高。通过结构修饰可以得到含有巯基的衍生物(DMs),包括DM1和DM4等,用于进一步的偶联;
(2)澳瑞他汀类:包括甲基澳瑞他汀E(MMAE)和甲基澳瑞他汀F(MMAF),二者是从海兔中分离出来的海兔毒素10的衍生物,能够抑制微管聚合。MMAE能够穿透细胞膜,产生旁观者效应;MMAF亲水性强,不穿透细胞膜,因此MMAF的药效更弱、毒性更小。二者均可以通过末端胺基修饰,进一步偶联到抗体上。MMAE是目前使用最广泛的ADC载荷;
(3)微管溶素:可以抑制微管聚合,是Mep,Ile,Tuv,Tut或Tup组成的四肽,Mep、Tut或Tup部位可以修饰用于偶联。
★DNA抑制剂通过干扰DNA合成或破坏DNA结构,起到抗癌作用,包括:卡奇霉素、喜树碱、杜卡霉素等。
(1)卡奇霉素:从放线菌中分离出来,和DNA小沟结合导致双螺旋断裂,该类物质的毒性过高,难以直接用于治疗癌症。通过调整偶联方式、优化剂量,基于该药物的ADC效果很好;
(2)喜树碱(CPT):从喜树中分离得到,DNA拓扑异构酶Ⅰ抑制剂。喜树碱水溶性较低,生理环境不稳定,可以转化为水溶性的前药CPT-11,CPT-11的活性代谢物是SN-38。CPT也可以经过修饰得到DXd;
(3)杜卡霉素(倍癌霉素):从链霉菌中分离得到,是DNA烷基化试剂。经过不同的结构修饰,可以得到结构更稳定、引入连接子的模块,如:DC1、DC4、DC44等。
1.4.4.偶联过程
偶联过程应考虑:(1)保证ADC在血液循环过程中保持稳定,减少不良反应的产生;(2)保证药物到达靶向区域内化后可以快速裂解,发挥杀灭作用;(3)平衡亲脂性和亲水性,使药物保持一定的溶解度同时能够进入细胞膜;(4)调整合适的DAR。
药物-抗体偶联比(DrugAntibodyRatio,DAR),即组成ADC的药物载荷分子与抗体分子的个数比。DAR是ADC的重要指标,影响ADC的均一性、药理药动学性质、耐受性等。对ADC来说,DAR过低很难有效杀伤肿瘤细胞,DAR过高容易被人体的免疫系统发现而被清除。目前,研究普遍认为DAR=2-4是ADC药物的最优选,随着技术发展,优选DAR可能会进一步提高。
1.4.5.连接子
连接子包括:可裂解连接子和不可裂解连接子。
图表8:ADC药物连接子分类
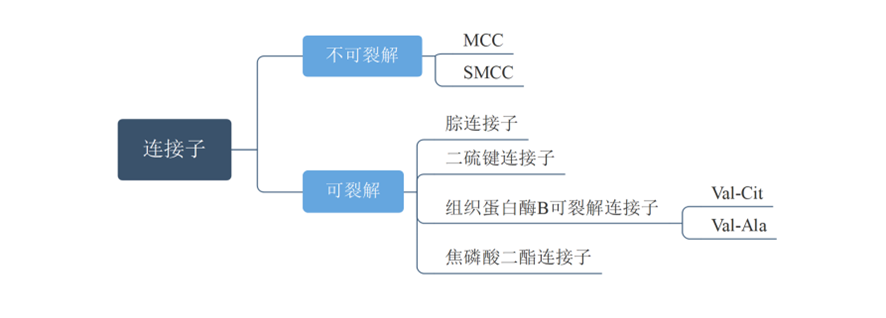
数据来源:T.Kyoji,Z.An,ProteinCell2016,9,33-46.、智银医药资料库
★可裂解连接子是指ADC内化后,连接子由于胞内外环境差异而裂解,包括:化学裂解和酶裂解。可裂解连接子能够产生旁观者效应,是目前的主流。
“旁观者效应”是指ADC内化后裂解,释放出药物载荷,这些药物载荷可以透过细胞膜进入周围细胞,进一步杀灭周围抗原不表达或低表达的细胞。但该效应可能使药物载荷进入血液循环,产生不良反应。
(1)腙连接子:酸不稳定,ADC进入肿瘤细胞的酸性内体(PH=5.0-6.0)或溶酶体(PH=4.8)中后裂解;
(2)二硫键连接子:肿瘤细胞中的谷胱甘肽浓度是血浆中的1000多倍,二硫键通过谷胱甘肽等进行二硫键转化进而裂解;
(3)组织蛋白酶B可裂解连接子:包括Val-Cit,Val-Ala等。组织蛋白酶B在肿瘤细胞中过表达,同时可以优先识别相关序列,使连接子裂解;
(4)焦磷酸二酯连接子:是一种阴离子连接子,通过内体-溶酶体通路裂解。该连接子于2016年新发现,水溶性更好,循环稳定性好,具有一定的潜力。
图表9:可裂解连接子。(A)腙连接子;(B)组织蛋白酶B可裂解连接子;(C)二硫键连接子;(D)焦磷酸二酯连接子
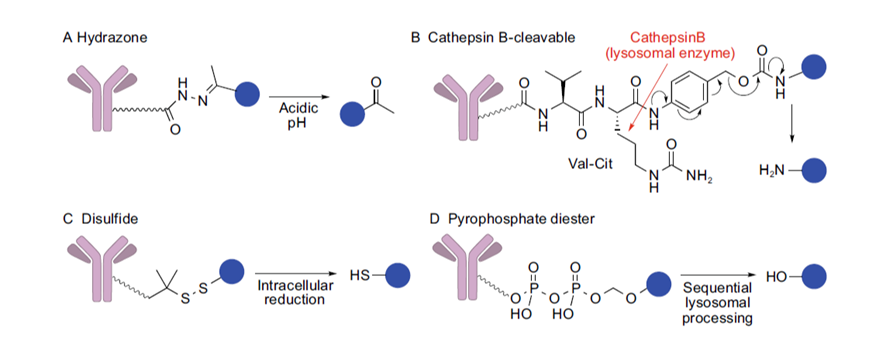
数据来源:T.Kyoji,Z.An,ProteinCell2016,9,33-46.、智银医药资料库
★不可裂解连接子指内化后ADC由胞质和溶酶体蛋白酶的完全裂解,得到连有一个氨基酸残基的载荷分子。相比可裂解连接子,使用不可裂解连接子使ADC在血液循环中更稳定,但不具有旁观者效应。常用的不可裂解连接子包括:MCC、SMCC等。
图表10:不可裂解连接子。上为SMCC,下为MCC
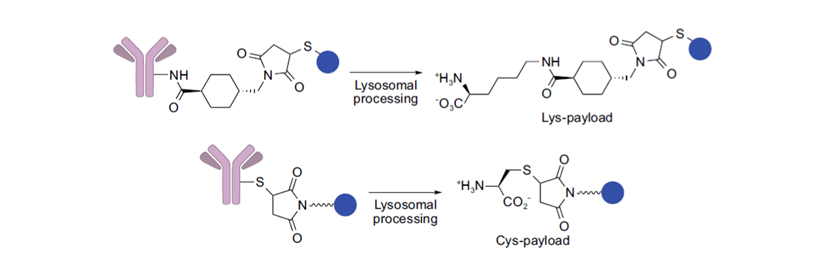
数据来源:T.Kyoji,Z.An,ProteinCell2016,9,33-46.、智银医药资料库
1.4.6.偶联方法
偶联方法可分为化学偶联和酶偶联,也可分为定点偶联和非定点偶联。
图表11:ADC药物偶联方法分类
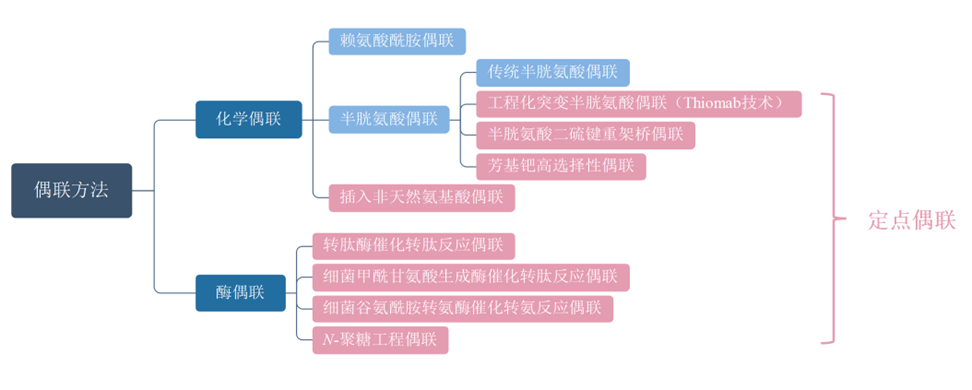
数据来源:T.Kyoji,Z.An,ProteinCell2016,9,33-46.、智银医药资料库
★化学偶联包括:赖氨酸酰胺偶联、半胱氨酸偶联、引入非天然氨基酸偶联。
(1)赖氨酸酰胺偶联:赖氨酸残基上的氨基可以与含有活性羧酸酯的连接子以酰胺键连接,进一步实现与药物偶联。由于抗体表面赖氨酸残基数量众多,该方法得到的ADC中将包含不同DAR和多种偶联部位的偶联物,优化后得到的最佳均值DAR为3.5-4,实际分布为0-7,均一性差。同时,一些赖氨酸残基在抗原抗体相互作用中很重要,该方法会降低抗体的亲和性;
图表12:赖氨酸酰胺偶联示意图
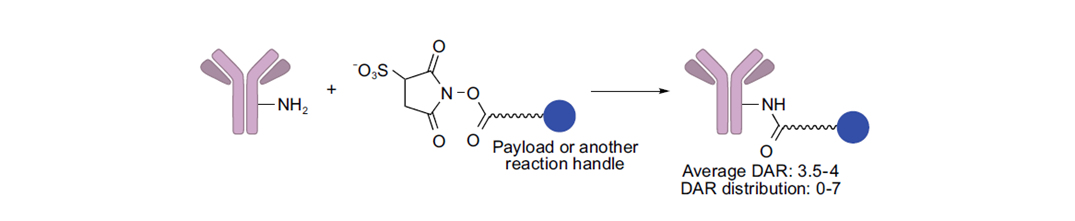
数据来源:T.Kyoji,Z.An,ProteinCell2016,9,33-46.、智银医药资料库
(2)半胱氨酸偶联包括:
1)传统半胱氨酸偶联:半胱氨酸残基通过巯基与药物偶联。一般情况下,抗体中半胱氨酸残基链间和链内都有巯基,以二硫键形式存在,链间的二硫键对抗体性质基本没有影响,可以采用温和的还原方法使其断裂,得到游离巯基。在IgG1中,有4个链间二硫键和12个链内二硫键,可以将链间二硫键选择还原为2、4、6或8个二硫键,进一步进行偶联。由于可偶联部位少,该方法优于赖氨酸酰胺偶联,但均一性仍有待提升;
2)工程化突变半胱氨酸偶联(Thiomab技术):通过定点诱变,在单抗中人工引入半胱氨酸残基用于偶联。这样得到的ADC的DAR均值为1.9,抗体均一性大于90%,体内外都有活性;
3)半胱氨酸二硫键重架桥偶联:利用二溴马来酰亚胺等试剂,可以在还原后的链间巯基之间形成重架桥,实现定点偶联,得到的DAR主要为4;
4)芳基钯高选择性偶联:利用芳基钯进行高选择性偶联,得到的DAR主要为4.4。该方法不需要连接子,产物对酸、碱、氧化稳定,但是用到钯催化剂,需要考虑毒性、价格、钯残留等问题。
第一种方法为非定点偶联,后三种方法为定点偶联。
图表13:半胱氨酸偶联示意图。(A)马来酰亚胺与半胱氨酸巯基偶联;(B)半胱氨酸二硫键重架桥偶联;(C)芳基钯与半胱氨酸巯基的高选择性偶联
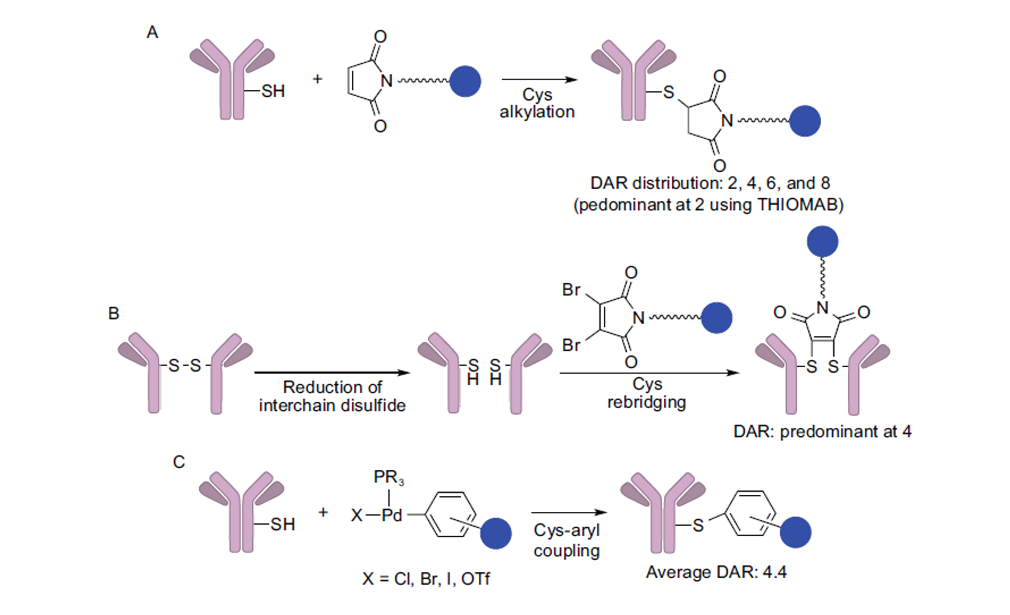
数据来源:T.Kyoji,Z.An,ProteinCell2016,9,33-46.、智银医药资料库
(3)插入非天然氨基酸偶联:引入非天然氨基酸,利用其上的特征官能团进行偶联,方法包括:
1)通过一种特殊的密码子-tRNA合成酶可以在蛋白质中引入含有羰基的p-乙酰基苯丙胺残基,利用该羰基与烷氧胺生成肟,进一步与药物偶联;
2)引入含有叠氮基团的非天然氨基酸残基,如p-叠氮甲基苯丙胺等可以与炔基通过叠氮-炔环化反应连接,通过改变炔的结构,该反应在铜催化条件存在与否的情况下都可以进行。
插入非天然氨基酸偶联属于定点偶联技术,得到的ADC具有较好的均一性,但该方法需要特殊的技术,且这些非天然氨基酸的免疫原性未知,需要考虑安全性。
图表14:插入非天然氨基酸偶联示意图。(A)p-乙酰基苯丙胺残基与烷氧胺生成肟;(B)、(C)含有叠氮基团的非天然氨基酸残基与炔基发生叠氮-炔环化反应
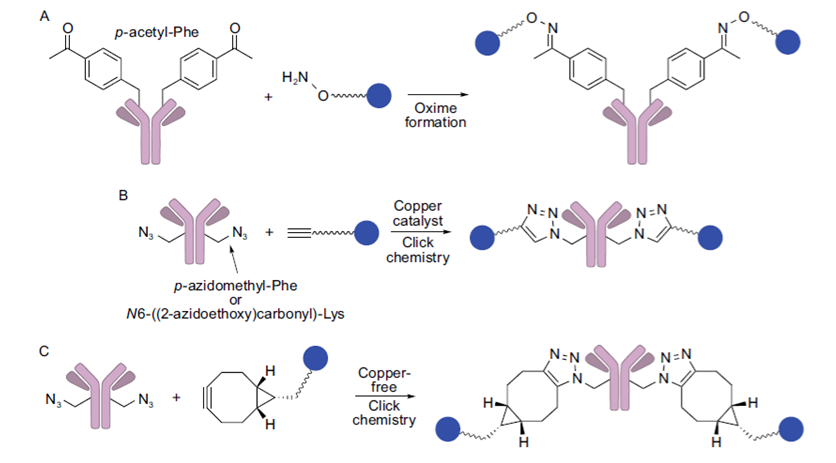
数据来源:T.Kyoji,Z.An,ProteinCell2016,9,33-46.、智银医药资料库
★酶偶联包括:转肽酶催化转肽反应偶联、细菌谷氨酰胺转氨酶催化转氨反应偶联、N-聚糖工程偶联、甲酰甘氨酸生成酶催化反应偶联等。
(1)转肽酶催化转肽反应偶联:转肽酶A从金黄色葡萄球菌中分离得到,识别LPXTG(X:任意氨基酸),裂解TG键,连接含有寡甘氨酸的底物;
(2)细菌谷氨酰胺转氨酶催化转氨反应偶联:细菌谷氨酰胺转氨酶从茂原链轮丝菌中分离得到,特异性识别抗体中的Q-tag;
(3)N-聚糖工程偶联:抗体Fc区的N297残基上存在N-聚糖,该位点位于恒定区,可用于ADC偶联,方法包括:
1)利用GaIT和SiaIT及NaIO4可以在N-聚糖末端插入醛基,进一步与烷氧胺生成肟。但NaIO4氧化会同时导致FcRn结合位点附近的甲硫氨酸残基氧化,增大DAR,影响FcRn结合,降低血浆中的半衰期;
2)在抗体中插入能进行正交反应的非天然糖,如GlycoConnect技术。
N-聚糖工程技术适用于各种免疫球蛋白。
图表15:酶偶联示意图。(A)转肽酶催化转肽反应偶联;(B)细菌谷氨酰胺转氨酶催化转肽反应偶联;(C)、(D)N-聚糖工程偶联
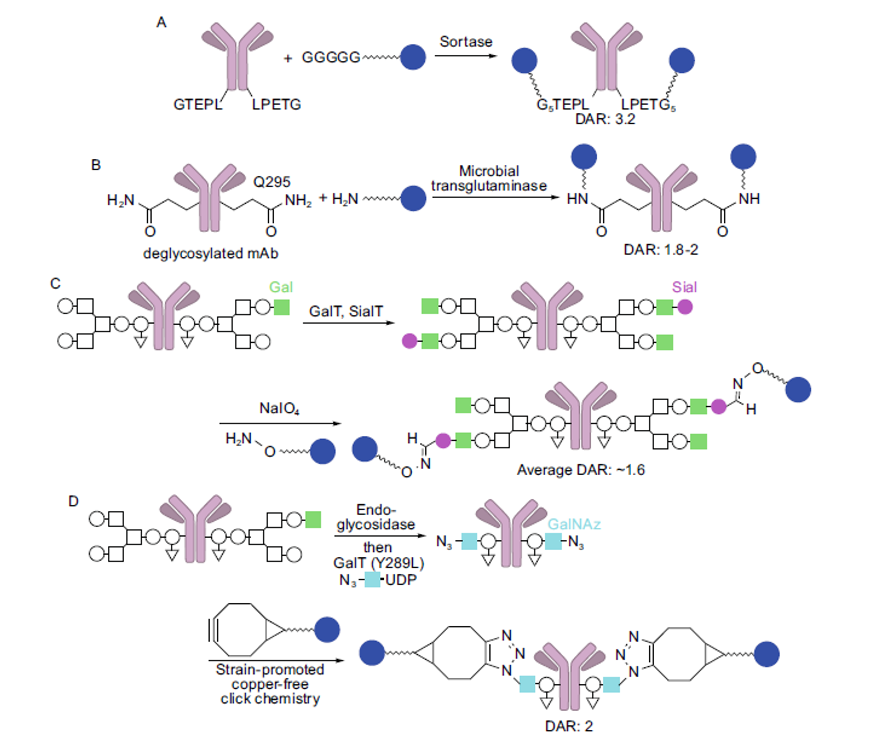
数据来源:T.Kyoji,Z.An,ProteinCell2016,9,33-46.、智银医药资料库
1.4.7.偶联过程对比
★不同偶联方法的优缺点对比:
(1)定点偶联得到的DAR更均一,如:Thiomab技术、插入非天然氨基酸偶联、细菌谷氨酰胺转氨酶催化转氨反应偶联、N-聚糖工程偶联的DAR在2左右,半胱氨酸重架桥偶联的DAR在4左右。相比之下,随机偶联DAR难以精确控制,可能造成药物清除速率加快,结合力降低,如:赖氨酸酰胺偶联的DAR为0-7,传统半胱氨酸偶联的DAR为0、2、4、6、8;
(2)定点偶联需要基因工程等技术,或需要抗体上存在特殊的结构。相比之下,随机偶联操作更简单,技术门槛更低。
★不同连接子优缺点对比:
(1)可裂解连接子裂解后得到单纯的载荷,不具有免疫原性,可以产生旁观者效应。相比之下,不可裂解连接子在完全裂解后,得到连有一个氨基酸残基的载荷分子,可能具有免疫原性,不能产生旁观者效应;
(2)可裂解连接子可能在循环过程中裂解,造成不良反应。相比之下,不可裂解连接子在循环过程中更稳定。
图表16:不同偶联方法和连接子的优缺点对比
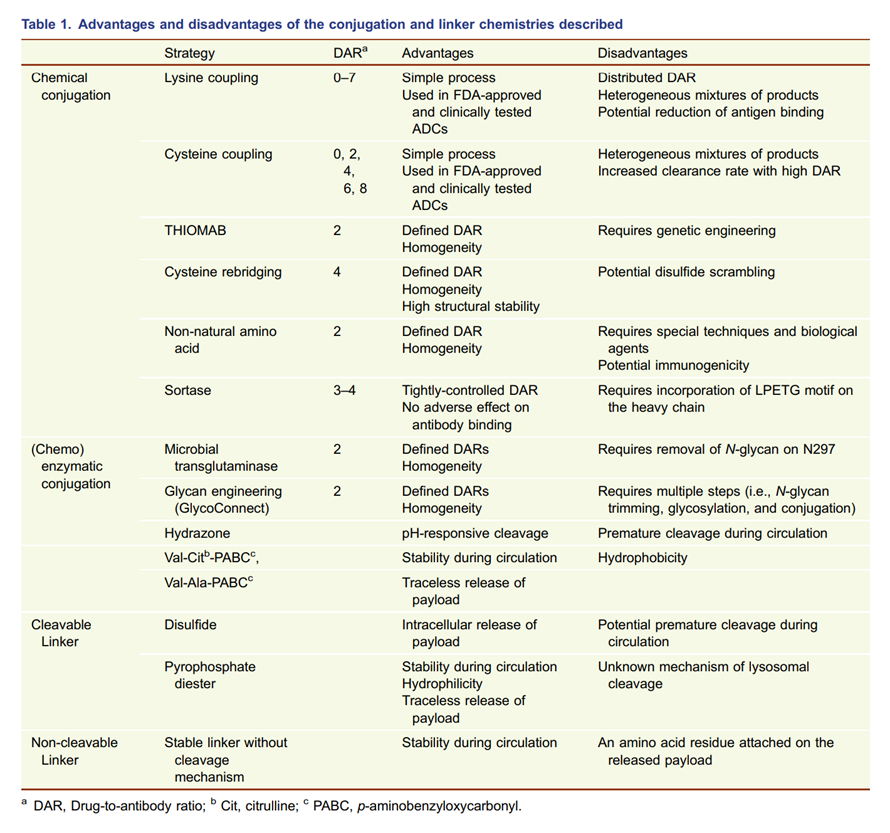
数据来源:T.Kyoji,Z.An,ProteinCell2016,9,33-46.、智银医药资料库
1.5.其余A“X”C技术分析
1.5.1.AOC技术分析
AOC由抗体和寡核苷酸通过连接子偶联得到。RNA治疗过程中存在降解、免疫反应、低靶向性等问题,采用与抗体偶联的方法可以改善这些问题。
AOC采用的抗体类型包括:全长单克隆抗体(mAb)、抗原结合片段(Fab)、可结晶片段(Fc)靶向的单克隆抗体等;目前主要采用靶向TfR1抗体。
图表17:AOC采用抗体的特点对比

数据来源:A.Mullard,Nat.Rev.DrugDiscov.2022,21,6-8.、智银医药资料库
AOC采用的载荷类型包括:小干扰核苷酸(siRNA)、反义寡核苷酸(ASO,包括磷酰二胺吗啉代寡核苷酸(PMO))、核酸适配体等。
AOC采用的连接子类型包括:可裂解和不可裂解连接子,除此之外,GennaoBio在探索无连接子的情况。
1.5.2.ABC技术分析
ABC由抗体与生物多聚物通过连接子偶联得到。目前该技术的研究平台很少,以KodiakSciences为代表。
该技术采用800kDa分支状磷酸胆碱多聚物为生物多聚物,该多聚物可以与水结合,在抗体外形成一层水屏障,避免其受到非特异性相互作用干扰,直达靶点。二者通过不可裂解连接子定点偶联,稳定到达作用部位。
与同类药物相比,ABC的当量摩尔剂量更大,当量组织特异性半衰期更长,当量组织特异性浓度更高,作用时间长且效果好。
图表18:ABC与同类药物对比
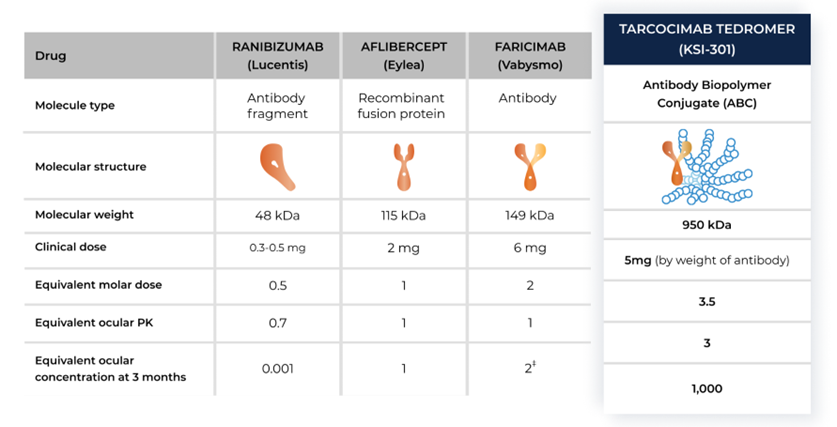
数据来源:KodiakSciences官网、智银医药资料库
ABC可以设计为一药多靶点。单靶点ABC采用单靶点抗体与生物多聚物偶联得到;双靶点ABC采用双特异性抗体与生物多聚物偶联得到;三靶点ABC采用双特异性抗体与负载小分子药物的生物多聚物偶联得到。
图表19:ABC类型
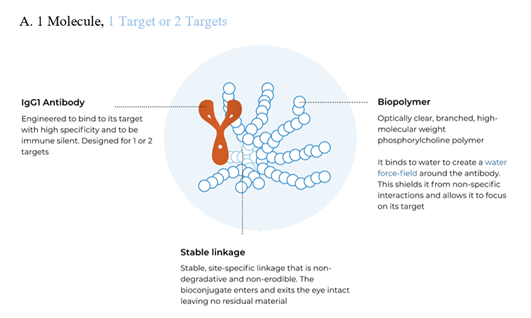
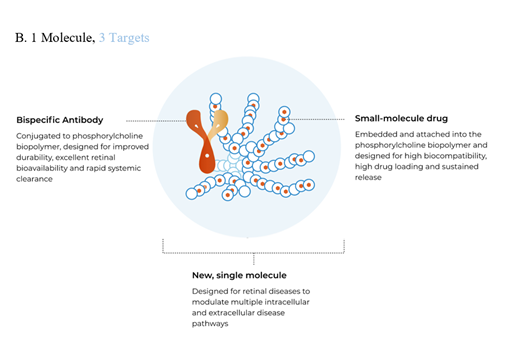
数据来源:KodiakSciences官网、智银医药资料库
1.5.3.ACC技术分析
ACC由抗体与细胞通过连接子偶联得到。目前该技术的研发平台很少,以Acepodia为代表。
该技术采用免疫细胞作为偶联对象,如:自然因子诱导的杀伤细胞(CIK)、自然杀伤细胞(NK)、T细胞等,起到增强靶向性、提高抗癌效果的作用。
将单链DNAs(ss-DNAs)连接到细胞表面蛋白上,将互补ss-DNAs连接到单抗上,二者通过互补链杂交相连。以CIK作为偶联对象,得到的产物在体外实验中效果显著。
图表20:ACC技术示意图。(A)ss-DNAs与细胞连接;(B)互补ss-DNAs与抗体连接
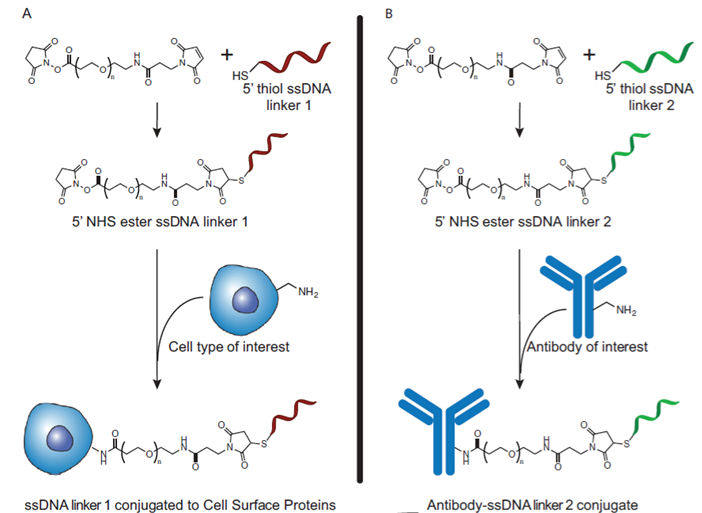
数据来源:M.J.Frank,N.Olsson,A.Huang,etal.,Cytotherapy2020,22,135-143.、智银医药资料库
1.6.产业链分析
ADC生产包括:单克隆抗体、小分子药物的制备,ADC原液生产、纯化、制剂等过程。
图表21:ADC生产流程示意图
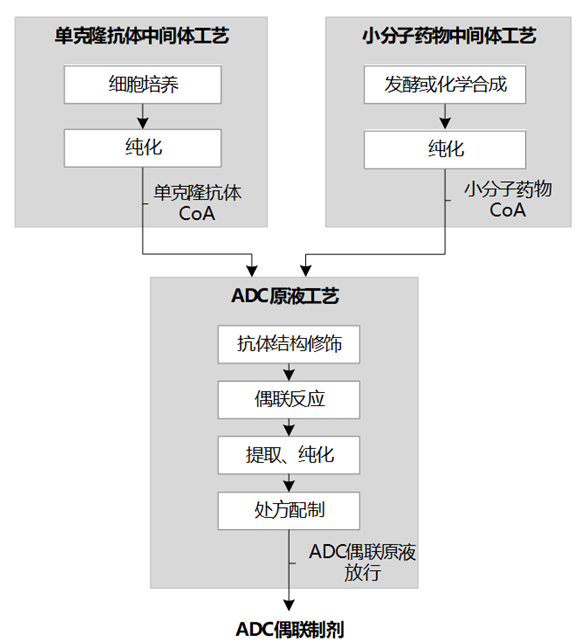
数据来源:抗体类药品现场检查指南(征求意见稿)、智银医药资料库
上游包括:试剂、仪器、耗材、包装等的供应商;中游包括:ADC研发生产厂商;下游包括:医院及患者。
图表22:ADC产业链分析

数据来源:智银医药资料库
1.6.1.上游
上游为试剂、仪器、耗材、包装等的供应商。
ADC生产包括单克隆抗体和小分子药物的研发与商业化,此类仪器、试剂、耗材具有一定的技术壁垒。国内起步较晚,诸多企业目前处于发展期,总体国产化率不高,低端产品以国产为主,高端产品以进口为主,存在一定卡脖子问题。
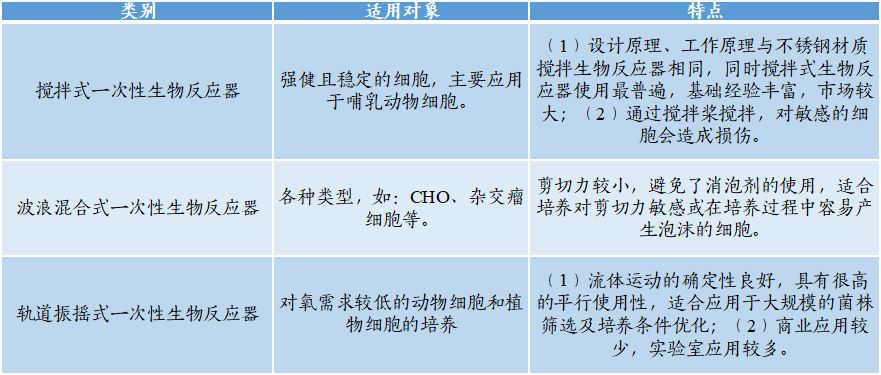
★较关键的仪器设备包括:生物反应器、层析系统与柱层析、超滤与纳滤等。
(1)生物反应器为微生物的生化反应提供环境。目前主要采用一次性生物反应器系统,包括搅拌式一次性生物反应器、波浪混合式一次性生物反应器、轨道振摇式一次性生物反应器等。与不锈钢生物反应器相比,一次性生物反应器存在产品调整灵活、后处理方便、污染减少、成本降低等优点。
据ResearchandMarkets等机构测算,2020年全球一次性生物反应器市场约为12亿美元,2027年可达35亿美元,复合年均增长率为16.6%;2027年中国的一次性生物反应器市场可达7.9亿美元,复合年均增长率为21.1%。
目前一次性生物反应器的国产化率较低,进口品牌包括:Cytiva、Sartorius、Thermofisher等,全球份额超过80%;国内厂商包括:金仪盛世、乐纯生物、东富龙、楚天科技等。
图表23:三种一次性生物反应器特点
数据来源:动脉网、智银医药资料库
(2)层析系统和柱层析的国产化率为20%-30%。进口品牌包括Cytiva、Merck等,国内厂商包括利穗科技、荣捷生物、东富龙等;
(3)超滤和纳滤的国产化率为30%-40%,进口品牌包括Sartorius、Cytiva、Merck等,国内厂商包括利穗科技、东富龙等。
★较关键的耗材包括:一次性生物反应袋、色谱填料、细胞培养基等。
这些耗材的主要市场主要由外企占据。2022年2月,药明生物上海、无锡工厂被美国商务部列入“未经核实名单”(UVL名单),从美国进口的用于一次性生物反应器的控制器和中空纤维过滤器(超滤膜包)将受到管制。由此可见,目前国内医药行业急需上游耗材企业的发展。
进口耗材在国内具有供货稳定性不够好、供应周期长、价格昂贵等问题,存在较大的可替代性,如乐纯生物的一次性反应/储液/搅拌袋已经占据了国内20%-30%的市场。
目前国内一次性生物反应袋的产商包括:东富龙、乐纯生物等;色谱填料的产商包括:纳微科技、博格隆、赛分科技等;培养基的产商包括奥浦迈、臻格生物、东富龙等。
★较关键的包材包括:西林瓶、预灌封注射器等。
预灌封注射器给药准确、操作简便,逐渐受到生物制品厂商的青睐。2019年,预灌封注射器的全球市场规模为46亿美元,在包材中增速最快;中国市场规模为50.64亿元,同比增长9.8%。
目前,预灌封注射器的全球龙头企业为美国BD公司,约占70%市场份额。国内的龙头企业为威高普瑞,是我国最大的预灌封注射器生产企业,占75%市场份额,BD中国位居第二。
总体来说,目前国内外的上游市场主要受海外龙头企业控制,国内企业正在积极发展,但短期内无法取代。在国内,外企产品存在供货、价格等问题,因此具有可替代性,同时,国内的市场处于不断增长的状态,因此国内上游市场企业的发展前景很有潜力。
1.6.2.中游
中游为ADC生产厂商,包括:技术型、引进型、CDMO/CMO型。
(1)技术型:具有专用的ADC技术平台。如:第一三共、西雅图遗传学、ImmunoGen、荣昌生物、多禧生物等;
(2)引进型:通过引入技术、引入管线甚至收购的方法进军ADC领域。如:阿斯利康、默沙东、罗氏、华东医药、云顶新耀等;
(3)CDMO/CMO企业:具有ADC研发、生产、商业化条件,帮助其它企业完成相关任务。如:迈百瑞(荣昌生物)、东曜药业、药明合联等。
总体来说,国外企业起步较早,发展较快,目前上市14个ADC药物,仅1款为中国原研药物。
1.6.3.下游
下游为ADC销售流通,包括:医院与患者。
目前,国内共有五款药物上市,分别为赫赛来、安适利、爱地希、贝博萨、拓达维,其中只有爱地希列入医保。
二、全球行业市场情况
2.1.全球肿瘤药物市场规模
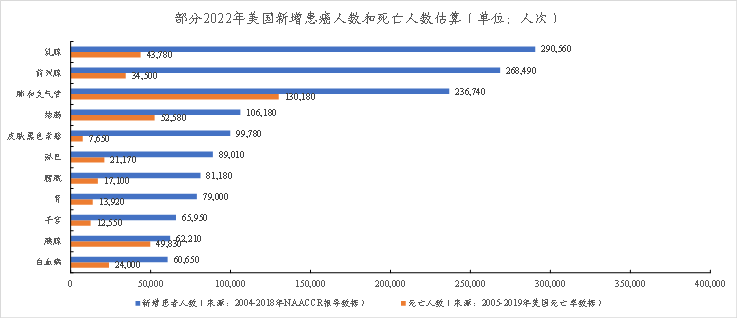
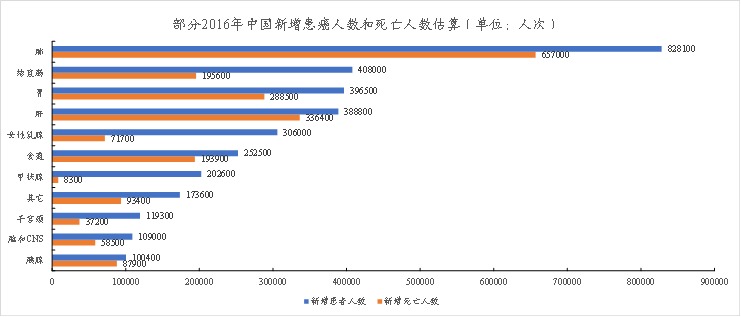
目前,A“X”C的适应症集中在肿瘤领域。根据2022年发布的《CancerStatistics,2022》和《CancerIncidenceandMortalityinChina,2016》,美国2022年确诊癌症病例共1918030人次,新增死亡人数为609360人次;中国2016年确诊癌症病例共4064000人次,新增死亡人数为2413500人次。占比较大的如下:
图表24:部分2022年美国新增患癌人数和死亡人数估算
数据来源:R.L.Siegel,D.M.Kimberly,E.F.Hannah,etal.,CACancerJ.Clin.2022,72,7-33.、智银医药资料库
图表25:部分2016年中国新增患癌人数和死亡人数估算
数据来源:R.Zheng,S.Zhang,H.Zeng,etal.,J.Natl.CancerInst.2022,2,1-9.、智银医药资料库
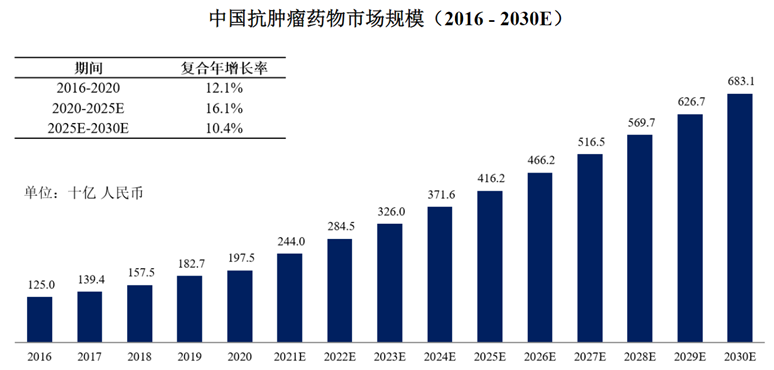
根据弗若斯特沙利文,2020年中国肿瘤药物市场为1975亿元人民币,以化疗药物为主(63.4%);预计2030年达到6831亿元人民币,以生物药物为主(靶向治疗45.9%,免疫治疗39.9%)。2020年美国肿瘤药物市场为705亿美元;预计2030年达到2219亿美元。
图表26:中国、美国抗肿瘤药物市场规模
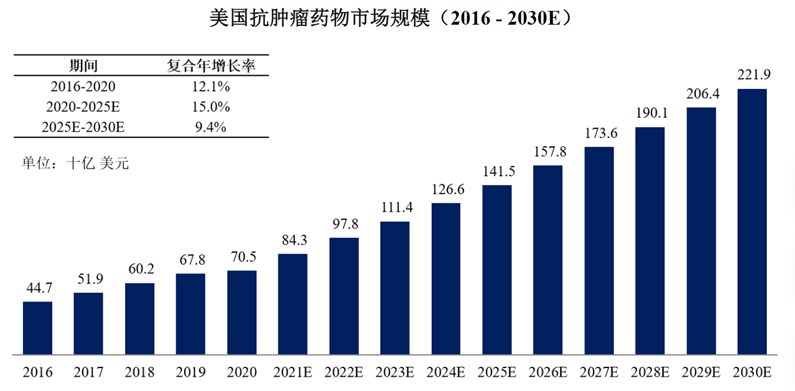
数据来源:荣昌制药招股书、弗若斯特沙利文报告、智银医药资料库
2.2.A“X”C市场分析
2.2.1.A“X”C研发情况
至2022年8月,全球共有14款A“X”C批准上市。其中,Lumoxiti属于AExC,Akalux属于APC,其余12款药物均属于ADC。
图表27:全球A“X”C药物批准情况(2022年8月)
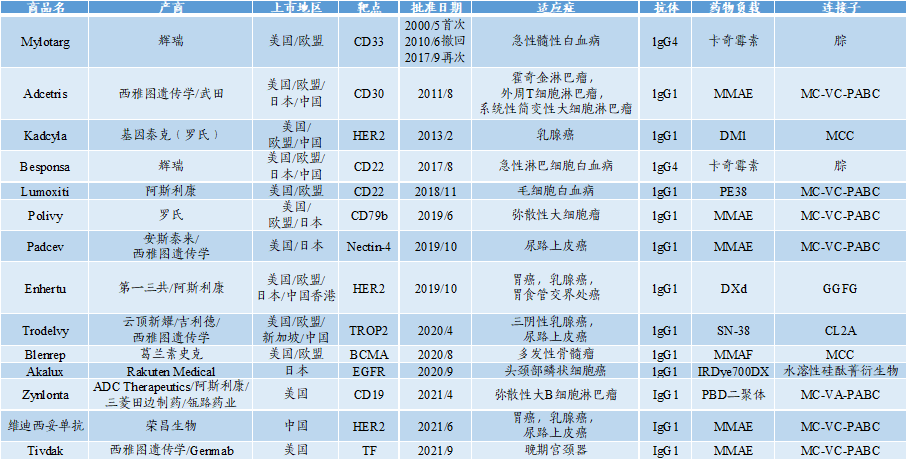
数据来源:医世象、智银全球生物医药项目库
至2022年4月,全球有近500个A“X”C管线在研。其中,ADC管线占据主流:发现期及临床前期328款、临床Ⅰ期58款、临床Ⅱ期39款、临床Ⅲ期8款、上市12款;其它类型各阶段管线数量基本为个位数,差异悬殊,其中发展较多的是AExC、ARC、APC等。
图表28:A“X”C的研发情况(2022年4月)
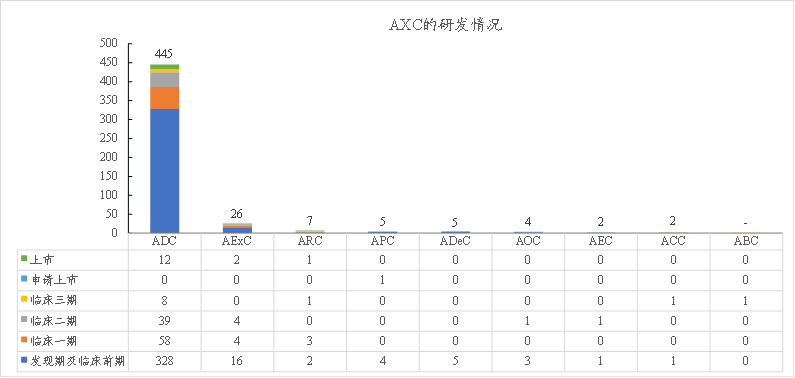
数据来源:凯莱英药闻、智银医药资料库
2.2.2.A“X”C代表公司
据FiercePharma,2021年ADC排名十强公司如下。其中,西雅图遗传学在研ADC管线8条、上市2款,均位于世界首位;第一三共在研ADC管线7条、上市1款,位于世界前位;ADCTherapeutics在研ADC管线6条、上市1款,位于世界前位。
图表29:2021年ADC排名十强(2021年9月)
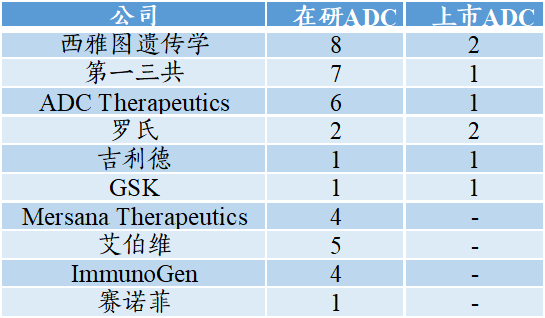
数据来源:FiercePharma、药融云、智银全球生物医药项目库
其余类型A“X”C的代表公司及产品如下。这些公司基本为技术型公司,具有专用的A“X”C技术平台。
图表30:其余类型A“X”C的代表公司及产品(2022年4月)
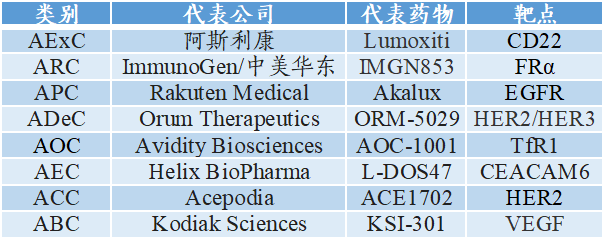
数据来源:凯莱英药闻、智银全球生物医药项目库
2.2.3.ADC在研靶点
目前,ADC在研靶点对应管线数量如下。
图表31:目前部分ADC靶点对应管线数量(2022年8月)
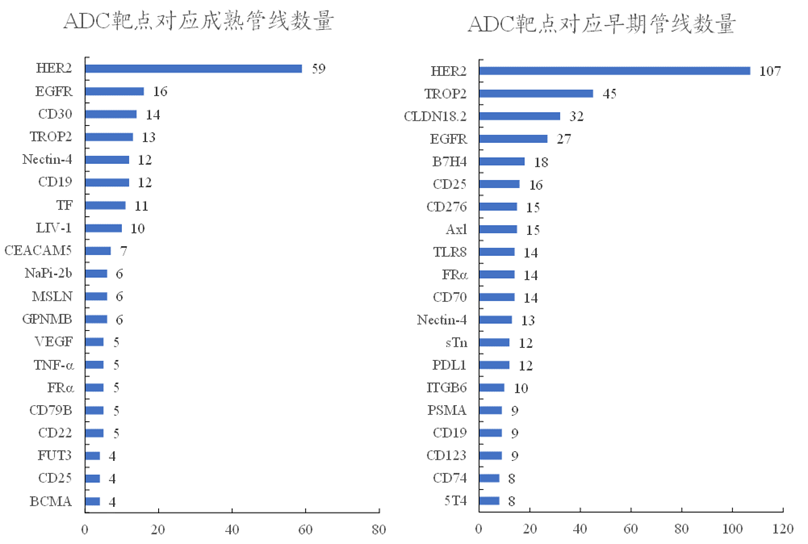
数据来源:医世象、智银医药资料库
★HER2、EGFR、CD30、TROP2等为热门靶点,发展时间长、竞争管线多。其中,HER2靶点成熟管线数量59条,早期管线数量107条,均远远大于其它靶点;另如EGFR、TROP2靶点成熟管线、早期管线均位于前列。
(1)HER2:属于表皮生长因子受体(EGFR)家族成员,通过激活信号调节通路促进增殖、抑制凋亡。该受体在肿瘤组织中高表达,在正常组织中低表达,位居ADC靶点管线数首位。上市药物中的Kadcyla、Enhertu、维迪西妥单抗,即以HER2为靶点;
(2)EGFR:即HER1,与HER2类似,属于EGFR家族成员,在多种实体瘤增殖、转移等过程中扮演重要角色,在正常组织和肿瘤组织中表达程度差异明显。上市药物中的Akalux,即以EGFR为靶点;
(3)CD30:属于肿瘤坏死因子受体(TNF)超家族成员,通过激活信号调节通路促进增殖、抑制凋亡。该受体在肿瘤组织中高表达,在正常组织中不表达,仅在T细胞、B细胞中低表达。上市药物中的Adcetris,即以CD30为靶点;
(4)TROP2:属于GA733基因家族成员,通过调节钙离子信号通路等促进增殖和转移。该受体在肿瘤组织中高表达,在正常组织中低表达或不表达。上市药物中的Trodelvy,即以CD30为靶点。
★其它新型靶点,如FRα等,竞争对手少,潜在收益较大,具有一定的潜力。
(1)FRα:属于叶酸受体家族,能够运送叶酸至细胞质中,并转移到细胞核中调节癌细胞基因的表达,促进肿瘤的增殖。该受体在实体瘤中过度表达,在正常组织中低表达。但目前该靶点药物均失败,ADC有望改变这一命运。IMGN853即以FRα为靶点,处于临床阶段。
2.2.4.ADC市场份额
2021年ADC市场份额已超52亿美元。2016-2020年,美国上市11款ADC药物,复合年均增长率为45%,销售额从3.28亿美元增长至14.7亿美元;欧洲上市7款ADC药物,销售额年均增幅13%,2020年销售额为5.81亿美元;日本上市4款ADC药物,复合年均增长率为21%,2020年销售额为2.22亿美元。
根据《NatureReviews》2021年发布的《TheOncologyMarketforAntibody–DrugConjugates》统计,2026年,目前上市的ADC的市场份额将达到164亿美元。其中,靶向HER2的Enhertu自2023年呈快速上升趋势,2026年将达到62亿美元,这是由于与竞争药物Kadcyla相比,Enhertu的疗效更好,可用于多种病因的乳腺癌(HER2+,HR+,HER2-),且治疗周期长。
图表32:2026年上市ADC市场份额预测
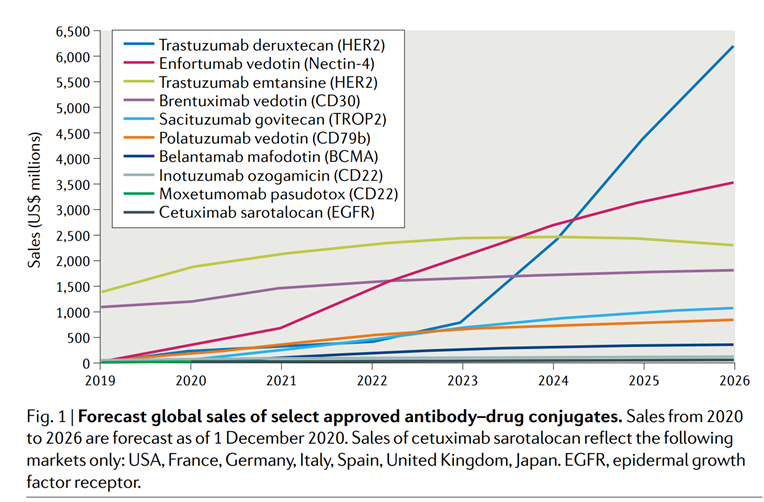
数据来源:C.doPazo,K.Nawaz,R.M.Webster,Nat.Rev.DrugDiscov.2021,20,583-584.、智银医药资料库
三、A“X”C研发情况
3.1.国外ADC研发情况
国外ADC发展较早,企业发展较成熟,可以分为2种类型:
(1)技术型。具有专用的ADC技术平台,其中技术龙头公司如:第一三共、西雅图遗传学、ImmunoGen等,新型技术公司如:MersanaTherapeutics等;
(2)引进型。通过引入技术、引入管线甚至收购的方法进军ADC领域,如:阿斯利康、默沙东、罗氏等。
3.1.1.第一三共
★第一三共于2005年9月成立,总部位于日本东京,至2022年9月3日,日股市值为560亿美元;由三共株式会社和第一制药株式会社合并。
★第一三共具有专用的DXd-ADC技术平台,包括:
(1)开发了DXd药物负载。DXd与SN-38一样,是喜树碱的衍生物,但比SN-38的效果强10倍以上,循环半衰期短,产生旁观者效应;
(2)开发了GGFG连接子。该连接子在细胞内由溶酶体酶裂解,循环稳定,提高了药物的水溶性,能够将DAR提高到8。
★第一三共官网显示,目前有3条ADC管线,均为该技术平台研发的DXd负载ADC,包括:
(1)T-DXd(Enhertu):于2019年10月FDA批准上市,由靶向HER2抗体与DXd通过GGFG偶联,适应症为HER2+乳腺癌、HER2突变的非小细胞肺癌、HER2低表达乳腺癌、HER2+胃癌。
在一项比较Enhertu与Kadcyla药效与安全性的临床Ⅲ期试验中,Enhertu的效果好于Kadcyla,但不良反应发生率更高;
图表33:Enhertu与Kadcyla的临床Ⅲ期试验比较
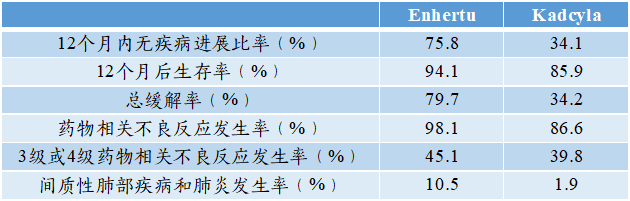
数据来源:J.Cortés,S.B.Kim,W.P.Chung,etal.,N.Engl.J.Med.2022,12,1143-1154.、智银全球生物医药项目库
(2)另两款为靶向HER3的HER3-DXd、靶向TROP2的Dato-DXd,均已经进入临床Ⅲ期,后者与吉利德Trodelvy具有竞争关系。
图表34:第一三共研发管线

数据来源:第一三共官网、智银全球生物医药项目库
★第一三共的合作包括:
(1)2019年,阿斯利康与第一三共达成协议:阿斯利康获得Enhertu在日本市场外的全球开发权利,第一三共获得13.5亿美元的预付款、最高55.5亿美元的里程碑付款;2020年,二者再次达成协议:共同完成Dato-DXd的研发和商业化,第一三共获得10亿美元的预付款、最高50亿美元的里程碑付款。
根据阿斯利康财报:2020年Enhertu收益达到0.94亿美元,2021年Enhertu收益达到2.14亿美元。上市以来,Enhertu的收益逐渐增长,目前在阿斯利康肿瘤领域贡献排名第五;
图表35:阿斯利康肿瘤领域贡献排名前五的药物
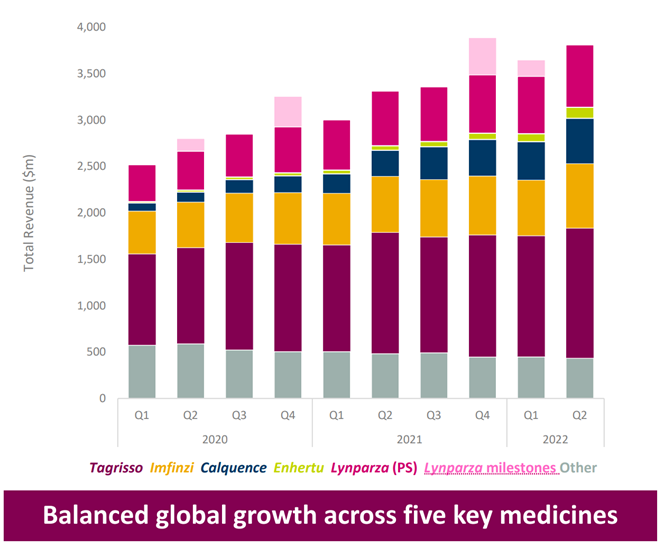
数据来源:阿斯利康年报、智银全球生物医药项目库
(2)第一三共与SarahCannon研究所、默克、GustaveRoussy、百时美施贵宝在ADC研究上具有合作关系。如:与SarahCannon研究所合作开发DS-7300(B7-H3)、DS-6157(GPR20)和DS-6000(CDH6)三种ADC。
★近年来,第一三共的销售额逐渐增长,2018-2021年各季度的同比增长率平均值分别为:5.7%、5.9%、5.0%、4.1%;海外市场占比逐渐增大,2017-2021年由36%逐渐增长到47%,可能和其与跨国公司的合作相关。
图表36:第一三共近年销售额
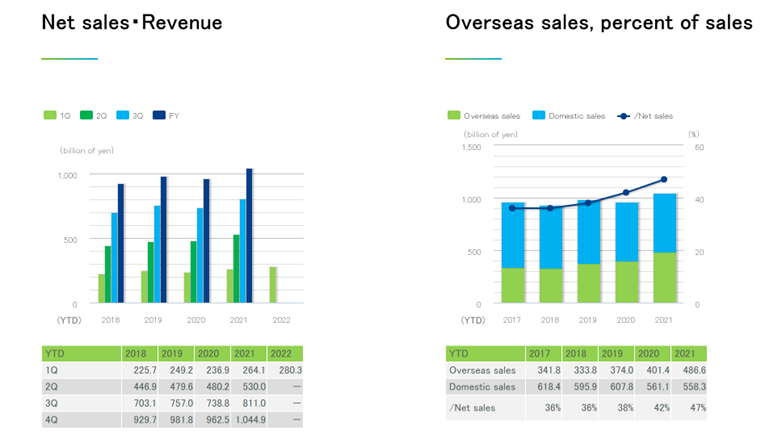
数据来源:第一三共官网、智银全球生物医药项目库
3.1.2.西雅图遗传学
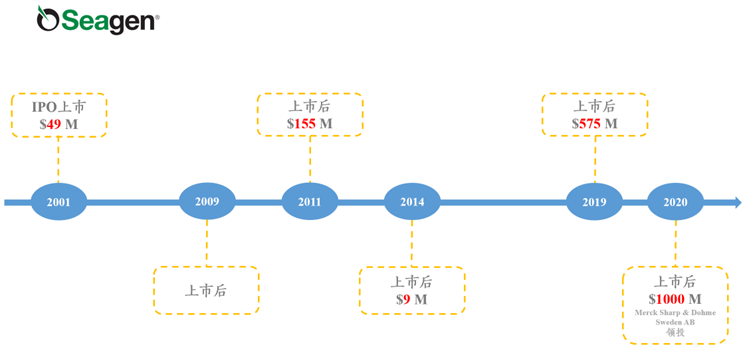
★西雅图遗传学于1998年成立,2001年上市,位于美国特拉华州,至2022年9月3日,美股市值为281亿美元;是一家全球生物技术公司,致力于癌症治疗。
图表37:西雅图遗传学融资历史
数据来源:Crushbase、智银全球生物医药项目库
★西雅图遗传学的主要团队成员包括:
(1)ClayB.Siegall博士:联合创始人,曾任董事长、首席执行官、总裁。曾任UltragenyxPharmaceutical、AlderBioPharmaceuticals等公司董事。马里兰大学动物学学士,华盛顿大学基因学博士;
(2)RogerDansey博士:现任暂时首席执行官兼首席医疗官。具有肿瘤学背景,曾在默克、吉利德任职。威特沃特斯兰德大学医学博士;
图表38:RogerDansey博士

数据来源:西雅图遗传学官网、智银全球生物医药项目库
(3)FelixBaker博士:现任董事长。曾任Synageva、GenomicHealth等公司董事。斯坦福大学免疫学学士、博士。
图表39:FelixBaker博士

数据来源:西雅图遗传学官网、智银全球生物医药项目库
★西雅图遗传学具有专用的ADC技术平台,包括:
(1)开发了MMAE、MMAF药物负载,其中MMAE是目前应用最广泛的小分子毒素;
(2)开发了MC-Val-Cit连接子,独家拥有VC-MMAE、VC-MMAF组合物专利;
(3)靶点包括:Nectin-4、TF、CD30、CD40、CD70等。
西雅图遗传学重视专利布局。具有百余件专利,涵盖治疗靶点、小分子化合物、连接子、组合物等,布局全面,壁垒坚实。同时对外积极维权,如:2022年4月以诉讼的方式裁定Enhertu侵犯其专利,使第一三共向其支付4000万美元赔偿金。
★西雅图遗传学与其它公司合作,总研发管线逾30条。官网显示,目前具有14条ADC管线,其中3款已上市,包括:
(1)Adcetris:于2011年8月FDA加速批准上市,与武田合作研发,由靶向CD30抗体与MMAE通过MC-VC-PABC偶联,适应症为霍奇金淋巴瘤和间变性大细胞淋巴瘤,2018年11月新增适应症外周T细胞淋巴瘤;
(2)Padcev:于2019年10月FDA加速批准上市,与安斯泰来合作研发,由靶向Nectin-4抗体与MMAE通过MC-VC-PABC偶联,适应症为尿路上皮癌。
FDA加速批准Padcev上市,是基于Padcev在局部晚期或转移性尿路上皮癌的临床Ⅲ期数据(NCT03474107):达到主要终点指标时,Padcev疗法与化疗相比,中位生存期更长(12.88个月对比8.97个月);
(3)Tivdak:于2021年9月FDA加速批准上市,与Genmab合作研发,由靶向TF抗体与MMAE通过MC-VC-PABC偶联,适应症为宫颈癌。
FDA加速批准Tivdak上市,是基于Tivdak在宫颈癌的临床Ⅱ期数据(NCT03438396):达到主要终点指标时,总缓解率为23.8%。
这3款药物仍有其它适应症处于临床阶段。另有8款药物处于临床期,包括2021年8月从荣昌制药引入的维迪西妥单抗,用于实体瘤的治疗。
图表40:西雅图遗传学三款上市药物管线
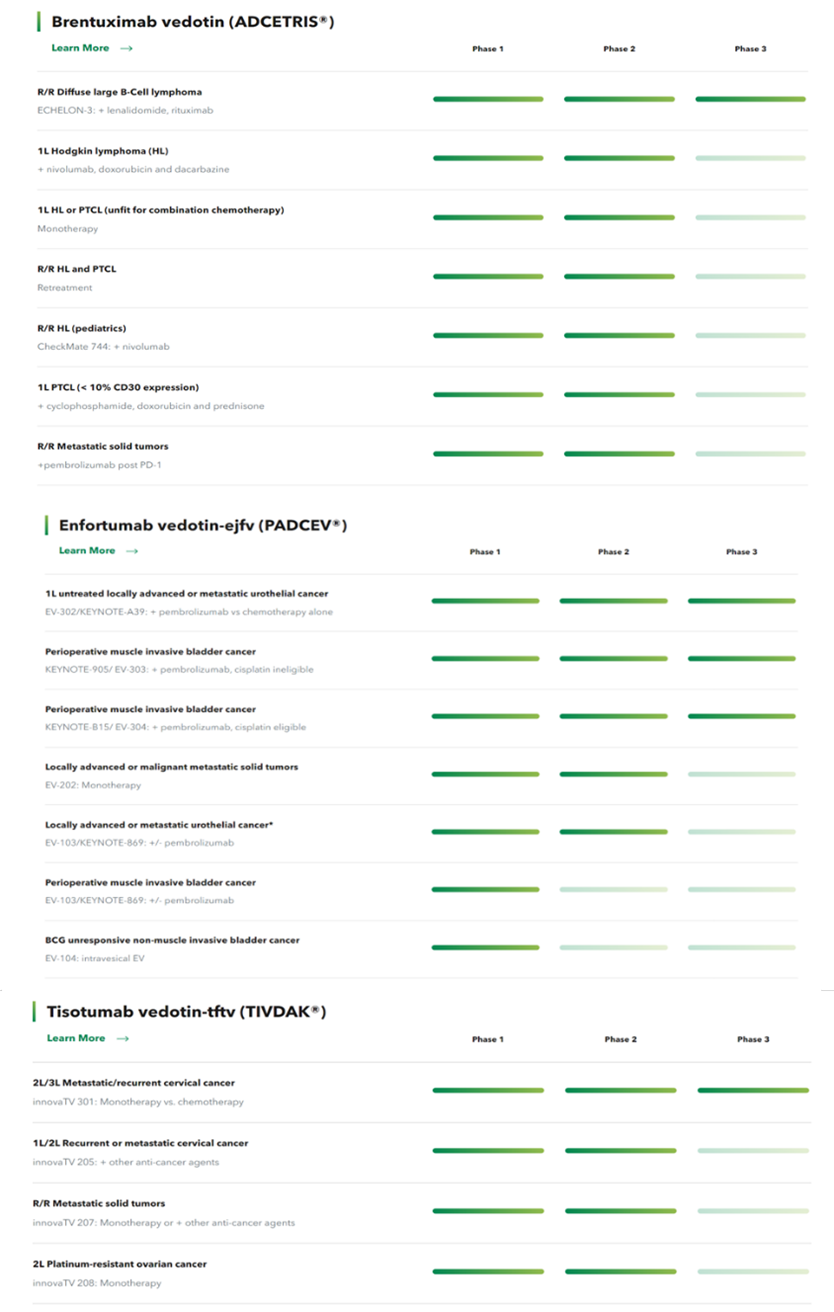
数据来源:西雅图遗传学官网、智银全球生物医药项目库
★根据西雅图财报:2021年,Adcetris的销售额为7.1亿美元,Padcev的销售额为3.4亿美元。由于Tivdak在2021年9月上市,下图对比了三种药物的近年来H1的销售额,可见均处于逐年增长的趋势。
图表41:西雅图遗传学上市ADC销售额
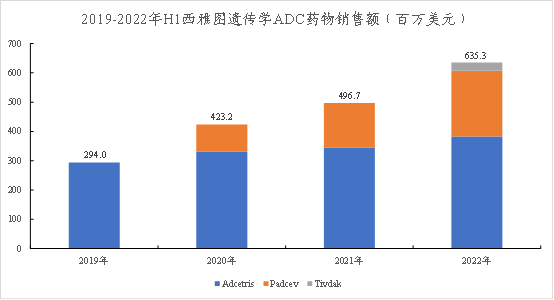
数据来源:西雅图遗传学官网、智银全球生物医药项目库
★西雅图遗传学的合作包括:
(1)2020年9月,默沙东与西雅图遗传学达成协议:默沙东获得靶向LIV-1的ADC的50%股份,西雅图遗传学获得6亿美元的预付款、最高26亿美元的里程碑付款;
同时,默沙东以10亿美元收购了西雅图遗传学的500万股;
此外,默沙东支付1.25亿美元预付款、6500万美元里程金以及8500万美元研发费用,获得了Tukysa在亚洲、中东和拉丁美洲以及美国、加拿大和欧洲以外其它地区的商业化权益;
(2)2021年8月,荣昌生物与西雅图遗传学达成协议:西雅图遗传学获得维迪西妥单抗在荣昌生物区域(即除日本、新加坡以外的其他亚洲地区)以外地区的全球开发和商业化权益,荣昌生物获得2亿美元的预付款、最高24亿美元的里程碑付款及销售提成。
3.1.3.ImmunoGen
★ImmunoGen于1980年成立,1989年上市,位于美国马萨诸塞州,至2022年9月3日,美股市值为12.3亿美元;该公司目前研发适应症集中于卵巢癌、急性骨髓性白血病、母细胞性浆细胞样树突状细胞瘤等。
图表42:ImmunoGen融资历史
数据来源:Crushbase、智银全球生物医药项目库
★ImmunoGen的主要团队成员包括:
(1)StephenC.McCluski博士:现任董事长,曾在Bausch&Lomb、MonroMufflerBrake等公司任职;
(2)MarkEnyedy博士:现任总裁兼首席执行官,有超过25年生物技术工业领域管理、事业、法律等经历,曾在ShirePlc、ProteostasisTherapeutics等公司任职。哈佛大学法律学博士。
图表43:ImmunoGen团队成员


数据来源:ImmunoGen官网、智银全球生物医药项目库
★ImmunoGen具有专用的ADC技术平台,包括:
(1)开发了DM1、DM4、IGN、新型喜树碱药物负载;
(2)开发了SMCC(不可裂解)、SPP(可裂解)、sulfo-SPDB(可裂解)、三肽连接子(可裂解);
(3)靶点包括:FRα(全球首个该靶点ADC)、ADAM9(全球首个该靶点ADC)、CD123等。
★ImmunoGen官网显示,目前有6条ADC管线,其中IMGN853进入临床III期,是该公司的核心产品。
IMGN853由靶向FRα抗体与DM4通过可裂解二硫键连接子偶联。FRα是一个理想的成药靶点,但目前研发药物均失败。2019年3月,IMGN853在作为单药疗法、治疗铂耐药卵巢癌的临床III期试验未能达到主要研究终点;但后来发现,IMGN853单药治疗FRα高表达的铂耐药卵巢癌试验达到主要研究终点,总缓解率为32.4%,中位缓解持续时间为5.9个月,5例完全缓解。由此,IMGN853管线继续推进,有望成为首款上市的靶向FRα药物。
图表44:ImmunoGen在研管线图

数据来源:ImmunoGen官网、智银全球生物医药项目库
★ImmunoGen与诺华、拜耳、罗氏、安进、赛诺菲等具有合作关系,向这些公司提供ADC技术平台,包括:
(1)2013年2月,ImmunoGen与罗氏合作的Kadcyla受FDA批准上市;
(2)2020年10月,杭州中美华东制药有限公司与ImmunoGen达成协议:中美华东的全资子公司华东医药获得IMGN853在大中华区的独家临床开发和商业化权益,ImmunoGen获得4000万美元的预付款、最高2.65亿美元的里程碑付款;
(3)2022年3月,礼来与ImmunoGen达成协议:礼来获得新型喜树碱平台的使用权,用于ADC药物的研发,ImmunoGen获得1300万美元的预付款、最高17亿美元的里程碑付款。
★根据ImmunoGen财报:公司近年来的总资产呈上升趋势,其公司收入目前主要来源于技术平台合作,可见其技术平台具有一定优势性。
图表45:近年来ImmunoGen总资产变化图
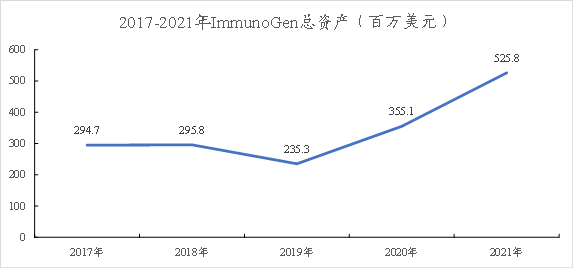
数据来源:ImmunoGen财报、智银全球生物医药项目库
★第一三公、西雅图遗传学、ImmunoGen的ADC技术平台是目前发展最成熟的平台,三者对比如下:
(1)药物载荷和连接子:第一三共潜力最大,西雅图遗传学适用范围最广,ImmunoGen种类最丰富;
(2)靶点和抗体:第一三共发展时间短、有待提升,西雅图遗传学和ImmunoGen发展时间长,种类丰富;
(3)研发情况:第一三共研发速度较快、技术平台合作少,西雅图遗传学研发管线与上市药物最多、技术平台合作多,ImmunoGen研发管线较慢、技术平台合作多。
图表46:ADC技术平台对比图
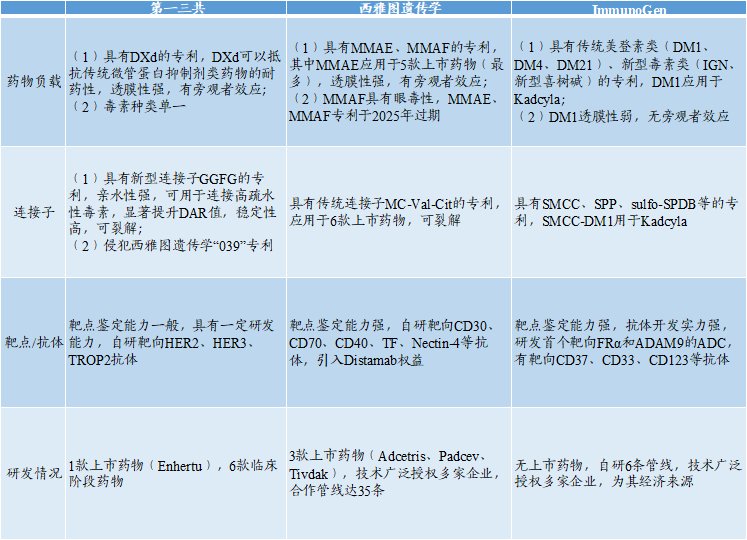
数据来源:医世象、智银全球生物医药项目库
3.1.4.基因泰克
★基因泰克于1976年成立,1999年上市,总部位于美国加州,至2022年9月3日,美股市值为44.8亿美元;2009年由罗氏收购,是一家生物技术公司。IPO融资20亿美元。
★基因泰克由HerbertW.Boyer博士和RobertA.Swanson先生联合创立。Herb是生物化学家与基因工程学家,曾任加州大学旧金山分校教授,因其出色工作,获1980年拉斯克基础医学医学研究奖、1993年瑞士HelmutHorten研究奖等;Swanson先生曾在Kleiner&Perkins风险投资合伙企业任职,任基因泰克的董事兼首席执行官,至1990年退休。
图表47:基因泰克创始人

数据来源:基因泰克官网、智银全球生物医药项目库
目前,SeverinSchwan博士任董事兼罗氏集团首席执行官,BillAnderson先生任罗氏制药公司首席执行官,AlexanderHardy先生任基因泰克首席执行官。
★基因泰克的ADC产品主要通过与其它技术平台合作获得,合作伙伴包括ImmunoGen、西雅图遗传学等。
★基因泰克官网显示,目前有两款ADC产品FDA获批上市,包括:
(1)Kadcyla:于2013年上市,利用Immunogen的ADC技术开发,由靶向HER2抗体(曲妥珠单抗)和DM1通过不可切割连接子SMCC偶联,DAR约为3.5,适应症为HER2+乳腺癌,仍有适应症处于临床试验阶段。
图表48:Kadcyla临床试验情况图
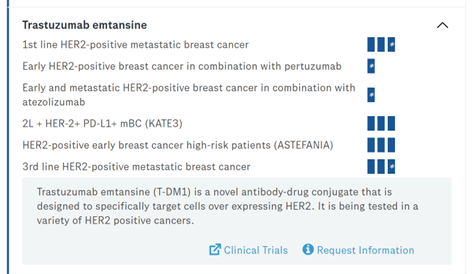
数据来源:基因泰克官网、智银全球生物医药项目库
根据2009年T-DM1(Kadcyla)对比卡培他滨联合拉帕替尼治疗HER2+局部晚期或转移性乳腺癌的临床Ⅲ期试验(NCT00829166):达到主要终点指标时,T-DM1组死亡率更低,生存期更长,表现出更好的疗效;
图表49:T-DM1与卡培他滨联合拉帕替尼临床试验达到主要终点指标时对比
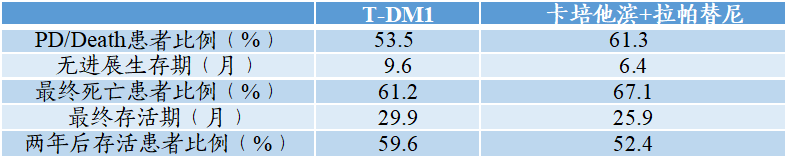
数据来源:美国国立医学图书馆、智银全球生物医药项目库
(2)Polivy:于2019年上市,利用西雅图遗传学的ADC技术开发,由靶向CD79B抗体和MMAE通过MC-VC-PAB偶联,适应症为弥散性大B细胞淋巴瘤,仍有其它适应症处于临床阶段。
图表50:Polivy临床试验情况图
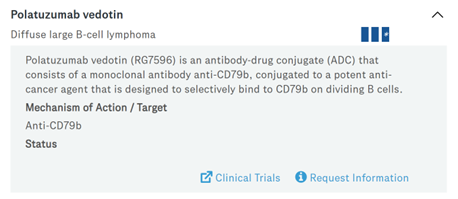
数据来源:基因泰克官网、智银全球生物医药项目库
根据2020年PolatuzumabVedotin(Polivy)联合苯达莫司汀和利妥昔单抗对比苯达莫司汀和利妥昔单抗治疗复发或难治性弥漫性大B细胞淋巴瘤的临床Ⅲ期试验(NCT04236141):达到主要终点指标时,含Polivy组完全缓解率更高(25.0%对比14.3%),疗效更好。
★根据基因泰克财报:2020年Kadcyla销售额为17.45亿瑞士法郎,2021年为19.82亿瑞士法郎,同比增长16%;2020年Polivy销售额为1.69亿瑞士法郎,2021年为2.47亿瑞士法郎,同比增长48%。
图表51:基因泰克癌症领域收入图
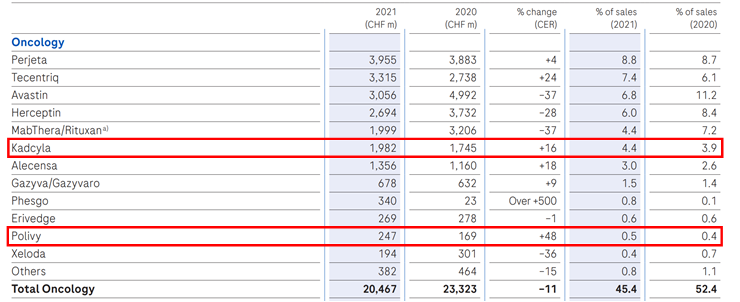
数据来源:基因泰克财报、智银全球生物医药项目库
3.1.5.ADCTherapeutics
★ADCTherapeutics于2011年6月成立,2020年5月上市,位于瑞士洛桑,至2022年9月3日,美股市值为4.94亿美元;专注于靶向固体瘤和血液瘤的ADC研发。
图表52:ADCTherapeutics融资历史
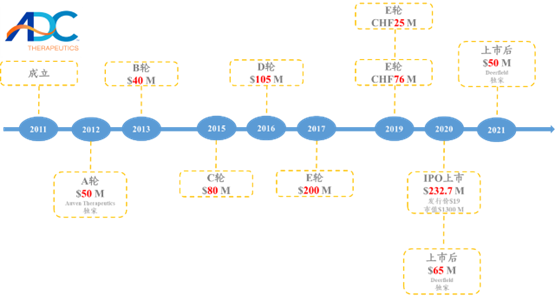
数据来源:Crushbase、智银全球生物医药项目库
★ADCTherapeutics的主要团队成员包括:
(1)ChrisMartin博士:联合创始人,同时是Spirogen联合创始人兼首席执行官,任职至2013年Spirogen被阿斯利康收购;
(2)AmeetMallik先生:现任首席执行官,有超过25年的工业界工作经历,曾任诺华执行副总裁、RafaelHolding首席执行官等。宾夕法尼亚大学工商管理硕士,西北大学化学工程学士和生物技术硕士;
(3)RonSquarer先生:现任董事长,曾任Hospira高级副总裁和首席商务官等。加州大学伯克利分校生物化学学士,西北大学凯洛格商学院工商管理硕士。
图表53:ADCTherapeutics团队成员

数据来源:ADCTherapeutics官网、智银全球生物医药项目库
★ADCTherapeutics具有专用的PBD二聚体小分子药物研发技术,该二聚体克服了一些肿瘤细胞对早期PBD药物的耐药性。
★ADCTherapeutics官网显示,目前有8条ADC管线,1款药物Zynlonta批准上市。
Zynlonta于2021年4月FDA加速批准上市,由靶向CD19抗体与PBD二聚体通过MC-VA-PABC偶联,DAR为2.3,是首款上市的靶向CD19的ADC产品,适应症为弥散性大B细胞淋巴瘤,与罗氏Polivy存在竞争关系。
FDA批准是基于Zynlonta针对复发或难治性弥漫性大B细胞淋巴瘤的临床Ⅱ期试验:总缓解率(ORR)为48.3%(70/145),包括完全缓解率(CR)和部分缓解率(PR)均为24.1%(35/145),中位响应时间为1.3个月,中位反应持续时间(mDoR)为13.4个月,常见≥3级治疗相关不良反应包括中性粒细胞减少(26.2%)、血小板减少(17.9%)、γ-谷氨酰胺转移酶增多(17.2%)、贫血(10.3%)。
图表54:ADCTherapeutics在研管线图

数据来源:ADCTherapeutics官网、智银全球生物医药项目库
★根据ADCTherapeutics财报:Zynlonta在2021年上市后销售额为33.9百万美元,2022年Q1销售额为16.5百万美元,Q2销售额为17.3百万美元,处于逐渐增长的趋势。
图表55:Zynlonta各季度销售额
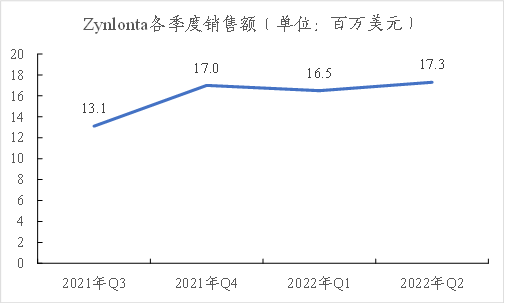
数据来源:ADCTherapeutics官网、智银全球生物医药项目库
★ADCTherapeutics的合作包括:
(1)2020年12月,ADCTherapeutics与瓴路药业成立新合资公司OverlandADCTBioPharma。ADCTherapeutics授权Lonca、ADCT-601、ADCT-602和ADCT-901在大中华区和新加坡的独家开发和商业化权利,拥有49%的股份;瓴路药业投资5000万美元,拥有51%的股份;
(2)2022年1月,ADCTherapeutics与日本三菱田边制药达成协议,合作完成日本地区Zynlonta的发展和商业化。ADCTherapeutics获得3000万美元的预付款、最高2亿美元的里程碑付款,同时享有20%左右的特许权使用费。
3.1.6.MersanaTherapeutics
★MersanaTherapeutics于2002年2月成立,2017年6月上市,位于美国马萨诸塞州,至2022年9月3日,美股市值为7.53亿美元;专注于发展癌症领域ADC。
图表56:MersanaTherapeutics融资历史
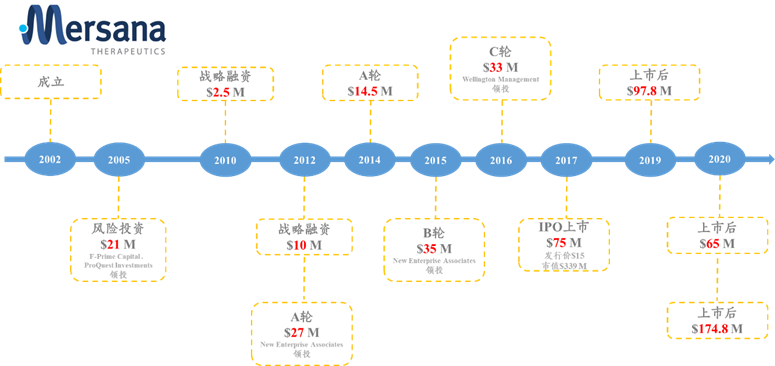
数据来源:Crushbase、智银全球生物医药项目库
★MersanaTherapeutics的主要团队成员包括:
(1)PeterKiener先生:联合创始人,同时是Cereius首席执行官,曾为Zyngenia联合创始人,在诸多医药公司任职。发表120多篇文章和40多项专利。兰卡斯特大学化学学士,哈佛大学(生物化学)哲学博士;
(2)DavidMott先生:任董事长,曾在SmithBarney、Medimmune、阿斯利康等公司任职。达特茅斯大学艺术学学士,兼任AdaptimmuneTherapeutics、Ardelyx等公司的董事长;
(3)AnnaProtopapas先生:任首席执行官兼总裁,曾任MillenniumPharmaceuticals的总裁等。普林斯顿大学科学与工程学学士,麻省理工学院化学工程硕士,斯坦福商学研究院工商管理硕士。
★MersanaTherapeutics具有专用的DolaLock技术,利用该技术得到的ADC在内化后,药物负载最初可以扩散到周围细胞中,一段时间后代谢为高活性但不能透过细胞膜的形式,进而控制了药物负载的旁观者效应。
图表57:DolaLock技术图解
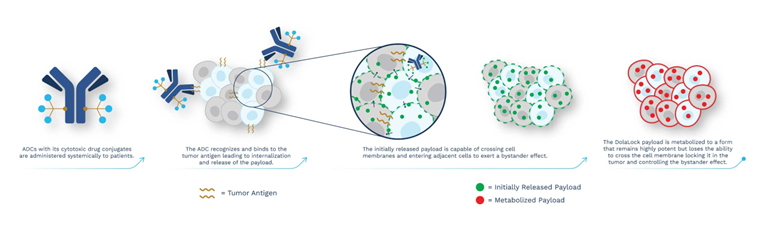
数据来源:Mersana官网、智银全球生物医药项目库
MersanaTherapeutics具有三个技术平台,包括:
(1)Dolaflexin平台:利用其专用的生物可降解、高生物兼容性、水溶性的柔性多聚体来携带药物分子,改善药物的溶解性、药代动力学性质、免疫原性、DAR等,不受PgPs影响,耐药性降低;
(2)Dolasynthen平台:将药物分子定点固定在多聚体骨架上,可以精确控制产生DAR为2-24的ADC;
(3)Immunosynthen平台:为STING激动剂ADC平台,开发的药物能够激活肿瘤驻留型免疫细胞和抗原表达细胞的STING通路,激活先天免疫系统,起到抗肿瘤作用。
图表58:MersanaTherapeutics三个平台比较图
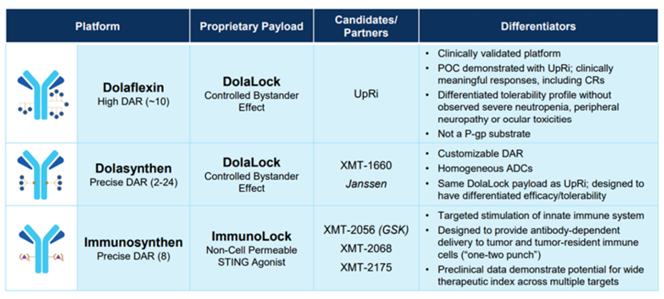
数据来源:医麦克、Mersana官网、智银全球生物医药项目库
★MersanaTherapeutics官网显示,目前有5条ADC研发管线,最快的1款药物UpRi进入临床Ⅱ期。
UpRi以NaPi2b为靶点,适应症为卵巢癌,是MersanaTherapeutics的核心产品。但该药物在治疗铂类化疗不敏感的卵巢癌临床Ⅰ期试验结果不理想:
(1)不良反应较严重。治疗相关的不良事件(TRAEs)出现率为44%,治疗相关的严重不良反应(SEAs)出现率为48%;
(2)疗效无计量关系。低剂量ORR为50%,中剂量ORR为41%,高剂量ORR为15%。
这使得MersanaTherapeutics股价大跌。
图表59:MersanaTherapeutics在研管线图

数据来源:MersanaTherapeutics官网、智银全球生物医药项目库
★MersanaTherapeutics的合作包括:
(1)2022年2月,杨森与MersanaTherapeutics合作,杨森提供三个靶点的抗体,MersanaTherapeutics利用Dolasynthen技术平台研发相应的ADC。MersanaTherapeutics获得4000万美元的预付款、最高10亿美元的里程碑付款;
(2)2022年8月,GSK与MersanaTherapeutics合作,进行靶向HER2的ADC药物XMT-2056的研发及商业化。MersanaTherapeutics获得1亿美元的预付款、最高13.6亿美元的里程碑付款。
★MersanaTherapeutics的平台比较新颖,发展高分子连接子,以提高ADC的DAR,目前受到杨森、GSK的支持。但其进展最快的药物不良反应较强,该技术平台的可靠性仍有待验证。
3.1.7.其它
★吉利德:2020年9月,吉利德以210亿美元收购Immunomedics,获得Trodelvy。该药物是首款靶向TROP2的ADC,于2020年4月FDA批准上市,适应症为转移性三阴性乳腺癌,2021年销售额为3.8亿美元。目前的潜在竞争对手是第一三共与阿斯利康合作的Dato-DXd。
★葛兰素史克:2020年8月,GSK研发的Blenrep由FDA批准上市,是首款靶向BCMA的药物,适应症为多发性骨髓瘤。根据GSK财报:Blenrep上市以来总销售额为89百万英镑,约1.07亿美元。然而,随着新的同适应症疗法逐渐进入市场,该药物的市场仍充满挑战。
★HeidelbergPharma:成立于1997年,致力于生物药物的研发,具有专用的ATAC技术平台,利用鹅膏蕈碱作为药物负载。目前有7条ADC管线(包括合作),1款药物HDP-101进入临床Ⅰ期,另有1条ARC管线。
2022年2月,华东医药与HeidelbergPharma达成协议:华东医药通过全资子公司华东医药投资控股(香港)有限公司收购HeidelbergPharma的35%股权,成为其第二大股东;华东医药另一家全资子公司中美华东获得HDP-101、HDP-103在中国大陆等20个亚洲国家和地区的独家许可,及HDP-102、HDP-104的独家选择权。HeidelbergPharma获得2000万美元的预付款、最高4.49亿美元的里程碑付款。
3.2.国内ADC研发情况
随着Adcetris、Kadcyla这些第二代ADC的上市,ADC逐渐进入发展期,在近年来国内新药申报数量逐渐增长;2019年Enhertu重磅上市,进一步促进了ADC的发展,2021年国内新药申报管线数达到22条。
图表60:国内ADC新药申报(至2022年6月)
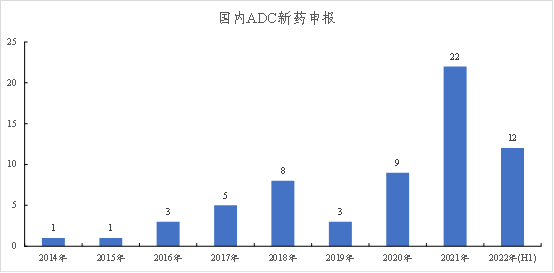
数据来源:抗体圈、智银医药资料库
至2022年6月,国内药企共有170余个ADC在研,其中进入临床阶段的近60个,累计申报64款ADC新药;至2022年9月,国内共有5款ADC新药获批上市,1款进入医保。
图表61:中国上市ADC新药(至2022年6月)
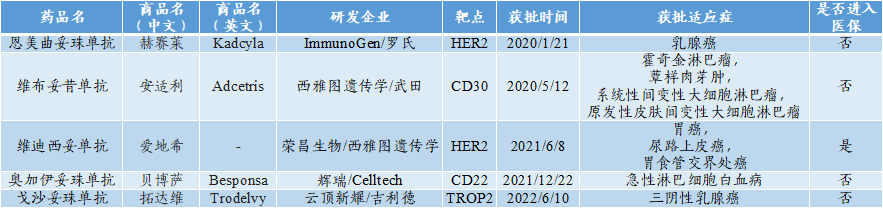
数据来源:NMPA官网、医药魔方、智银全球生物医药项目库
国内ADC研发公司包括三类:
(1)技术型:具有专用的ADC技术平台,如荣昌生物、多禧生物等;
(2)引进型:通过引入技术、引入管线甚至收购的方法进军ADC领域,如华东医药、云顶新耀等;
(3)CDMO/CMO企业:如迈百瑞、东曜药业、药明合联等。
3.2.1.荣昌生物
★荣昌生物于2008年7月成立,2020年11月上市,位于烟台,至2022年9月3日,A股市值为266.17亿人民币,港股市值为78.11亿港币;致力于创新型生物制药研发,主要药物类型为ADC、抗体融合蛋白、单克隆抗体等抗体药物,主要研发领域为自身免疫疾病、肿瘤、眼科。
图表62:荣昌生物融资历史
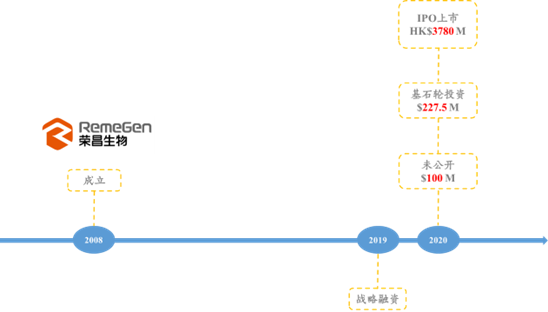
数据来源:动脉网、智银全球生物医药项目库
★荣昌生物的主要团队成员包括:
(1)王威东先生:联合创始人,现任董事长,有超过27年制药行业创业经验,自1997年开始,致力于公司创新生物制剂开发。黑龙江商学院(现称哈尔滨商业大学)中药制药学士;
(2)房健民博士:联合创始人,现任首席执行官兼首席科学家,有超过20年生物制药研发经验,同时担任全资附属公司荣昌生物医药研究(上海)有限公司、RemeGenBiosciences及荣昌生物香港有限公司的董事。在顶级期刊发表论文多篇,有药物发明专利40多项。加拿大达尔豪斯大学生物学博士,哈佛大学医学院外科/波士顿儿童医院博士后研究员。
图表63:荣昌生物团队成员


数据来源:荣昌生物官网、智银全球生物医药项目库
★荣昌生物具有的专利包括:抗体、小分子化合物、连接子、组合物、制备工艺及应用,其中组合物相关的专利占比较大。
图表64:荣昌生物部分专利信息

数据来源:中国及多国专利审查信息查询网、智银全球生物医药项目库
荣昌具有专用的全面集成ADC平台,涵盖ADC开发及生产的全过程。平台技术包括:连接子、优化载荷的筛选,专用桥接(Thiel-bridge)偶联技术,偶联工艺开发,连接子、载荷及组合物的GMP合成等。
荣昌具有GMP标准的生产设施,现配备6个2000升的一次性袋式生物反应器,建立起了细胞生产、小分子药物合成、偶联、制剂生产线,可以实现从源头开发到商业化全过程。此外,荣昌生物建立了迈百瑞国际生物医药,进军CDMO服务。
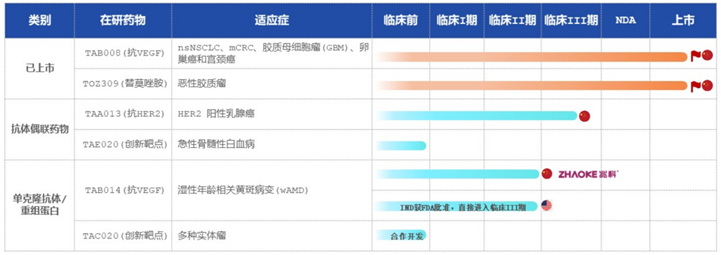
★荣昌官网显示,目前有7条ADC管线,1款药物RC48上市,其余均处于临床试验申请期或临床Ⅰ期。
维迪西妥单抗(RC48)于2021年6月NMPA批准上市,同年12月纳入医保目录。该药物是首款我国原创ADC上市新药,首款获得FDA突破性疗法认定的中国ADC产品。
维迪西妥单抗由自主研发的靶向HER2抗体Disitamab(迪西妥单抗)与MMAE通过MC-VC-PABC偶联,适应症为胃癌、尿路上皮癌、乳腺癌等。相比于Kadcyla所用的曲妥珠单抗,维迪西妥单抗采用的迪西妥单抗与靶点亲和力更高,EC50更低,安全性更好。
维迪西妥单抗联合特瑞普利单抗治疗局部晚期或转移性尿路上皮癌临床Ib/Ⅱ期研究(RC48-C014)表明:该药在所有患者中ORR为75%,在一线转移性尿路上皮癌患者的cORR为80%,在HER2(3+)患者中ORR为100%。可见其效果很好。
2021年,注射用维迪西妥单抗实现销售额8400万元,涵盖全国29个省级行政单位的105个地级市的374家医院及约2139名患者。
图表65:荣昌生物在研管线
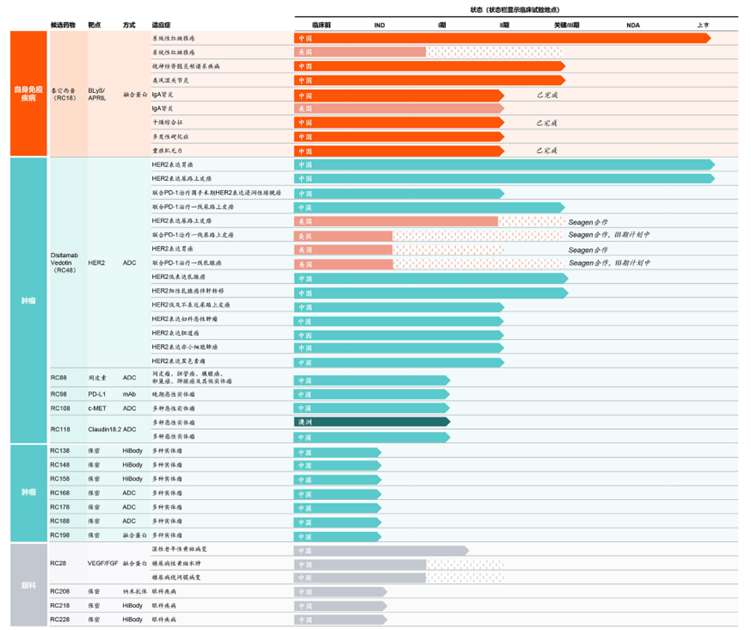
数据来源:荣昌生物官网、智银全球生物医药项目库
★2021年8月,荣昌生物与西雅图遗传学达成协议,西雅图遗传学获得维迪西妥单抗在荣昌生物区域(即除日本、新加坡以外的其他亚洲地区)以外地区的全球开发和商业化权益;荣昌生物获得2亿美元的预付款、最高24亿美元的里程碑付款及销售额提成。
★荣昌生物是国内最早发展ADC的企业之一,目前基础很牢固,具有专用的ADC平台,专利布局较全面,同时进军CDMO领域,从研发到商业化全流程发展。在抗体上进行改良,研发首款国内研发上市ADC,后续管线数很多,值得期待。
3.2.2.百奥泰
★百奥泰于2003年7月成立,2020年2月上市,位于广州高新技术开发区,至2022年9月3日,A股市值为83.93亿人民币;致力于创新药和生物类似药研发,主要领域为治疗肿瘤、自身免疫性疾病、心血管疾病以及其它危及人类生命或健康的重大疾病。
图表66:百奥泰融资历史
数据来源:动脉网、智银全球生物医药项目库
★李胜峰博士为联合创始人,现任首席执行官,有超过20年新药研发的经验,曾任Abmaxis首席科学官等。美国乔治亚大学博士,耶鲁大学生物物理与生物化学博士后。
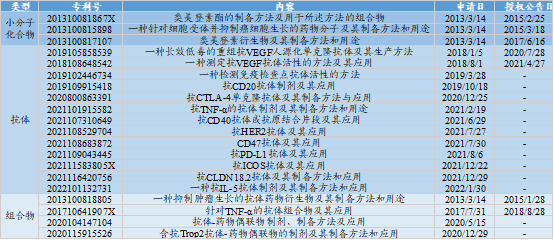
★百奥泰的专利包括抗体、小分子化合物、组合物、制剂、用途。百奥泰在抗体方面的专利布局很全面,相比之下小分子化合物、连接子、组合物相关的专利较少。
图表67:百奥泰部分专利信息
数据来源:中国及多国专利审查信息查询网、智银全球生物医药项目库
百奥泰在广州黄埔区科学城设有研发区,包括办公室、实验室和符合GMP的中试车间(>9500m2);在广州黄埔区永和设有生产区,符合GMP标准,占地40000m2,厂房超过50000m2;已经建成原液产能为30500L,具有预充针、西林瓶、冻干3条制剂生产线。
★2018年2月,百奥泰注射用BAT8001获批进入临床Ⅲ期,BAT8001由靶向HER2单抗和Batansine(美登素衍生物)通过不可裂解连接子偶联,适应症为HER2+晚期乳腺癌;2019年4月,百奥泰注射用BAT8003获批进入临床Ⅰ期,由靶向TROP2单抗和Batansine通过不可裂解连接子偶联,适应症为晚期上皮癌。
但在2021年2月和3月,百奥泰相继宣布终止这两款药物的研发。公告披露:前者的主要疗效指标无进展生存期(PFS)与阳性对照组比较未达到预设的优效目标,难以获得优势;后者综合考虑TROP2靶点ADC市场及BAT8003与BAT8001的相似性,存在较高的风险,因此终止。这使得百奥泰的三亿元人民币投资打水漂,股价随之下跌。
2022年,百奥泰东山再起,至8月共有3款ADC产品获批临床,均处于临床Ⅰ期:
(1)3月,注射用BAT8006获批,该药物由靶向FRα抗体与拓扑异构酶I抑制剂通过自主研发的可剪切连接子偶联;
(2)4月,注射用BAT8009获批,该药物由靶向B7H3(CD276)抗体与拓扑异构酶I抑制剂通过自主研发的可剪切连接子偶联;
(3)7月,注射用BAT8010获批,该药物由靶向HER2抗体与拓扑异构酶I抑制剂通过自主研发的可剪切连接子偶联。
图表68:百奥泰在研管线图
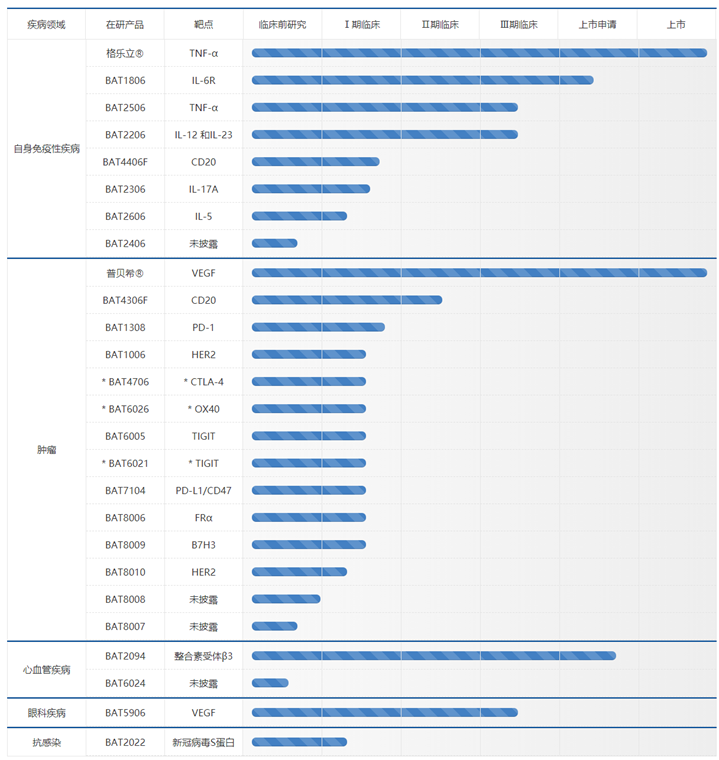
数据来源:百奥泰官网、智银全球生物医药项目库
★百奥泰是国内早期发展ADC的企业,但是随着两款核心产品研发终止,目前百奥泰在ADC领域的领军地位不再,同时面领着亏损等问题。但ADC研发基础仍在,目前三款产品的发展趋势还有待时间验证。
3.2.3.多禧生物
★多禧生物于2012年12月成立,位于杭州;专注于ADC药物研发。
图表69:多禧生物融资历史
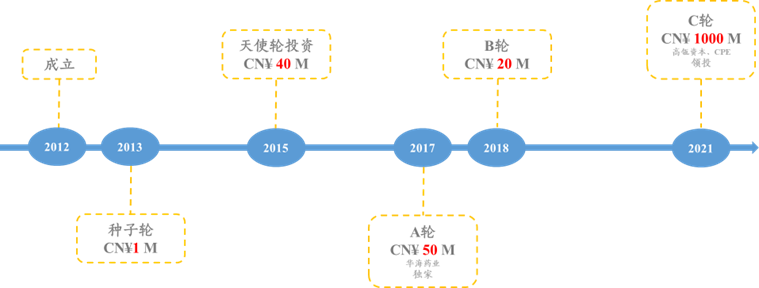
数据来源:Crunchbase、智银全球生物医药项目库
★赵永新博士为创始人,现任董事长兼首席执行官兼总裁。从事癌症研究已20余年,曾在ImmunoGen从事ADC的研究,作为技术骨干先后参与了12家制药公司ADC的技术转让和合作。拥有发明专利67项(已有42个授权),专业文章27篇。武汉大学环境化学学士、硕士,美国芝加哥伊理诺依大学博士,美国康乃尔大学医学研究生院及纪念斯隆凯特琳癌症中心博士后。
图表70:赵永新博士

数据来源:多禧生物官网、智银全球生物医药项目库
★多禧生物注重专利布局,具有20余项PCT专利,21项美国地区专利,总数超过400项,分布在20多个国家和地区。专利类型包括:小分子化合物、连接子、组合方法、偶联制剂方法等,布局很全面,但缺少有关抗体方面的专利。
图表71:多禧生物部分专利信息

数据来源:中国及多国专利审查信息查询网、智银全球生物医药项目库
多禧具有专用的ADC开发平台,包括:
(1)连接技术:拥有新型智能化连接子(包括定点偶联)共约50余种;
(2)小分子化合物:拥有5大类,共约100余种分子。包括:微管蛋白抑制剂(微管溶素)、DNA小沟槽结合体(PBD)、DNA烷基化类(杜卡霉素)、RNA聚合酶抑制剂类(鹅膏毒素)、拓扑酶抑制剂类(喜树碱)等;
(3)抗体:抗体构建和生产工艺完善,符合GMP标准,能够实现小试到放大生产;
(4)ADC:具有ADC药物动物体内外评价、药物结构确证、分析方法开发与验证等体系,已有近10个ADC的生产经验,能够年产上万瓶ADC。
★多禧生物官网显示,目前有20多条ADC管线,是国内ADC管线最多的企业之一,其中4款药物进入临床,包括:
(1)DX126-262:由靶向HER2抗体(DX-CHO9)与自主研发的微管溶素类似物偶联,现已完成HER2+晚期/转移性乳腺癌、胃癌的I期研究,处于HER2+不可切除的局部晚期或复发转移性乳腺癌的临床Ⅱ期研究;
(2)JS108(DAC-002):由靶向TROP2抗体与微管溶素类似物通过智能连接子偶联,处于晚期实体瘤的临床I期研究;
(3)DXC-005:是国内首个进入临床阶段的靶向MUC1的ADC产品,目前以MUC1作为靶点的ADC很少,处于晚期恶性实体瘤的临床I期研究;
(4)DXC-007:靶点未披露,处于复发/难治性急性髓系白血病的临床I期研究。
图表72:多禧生物在研管线图
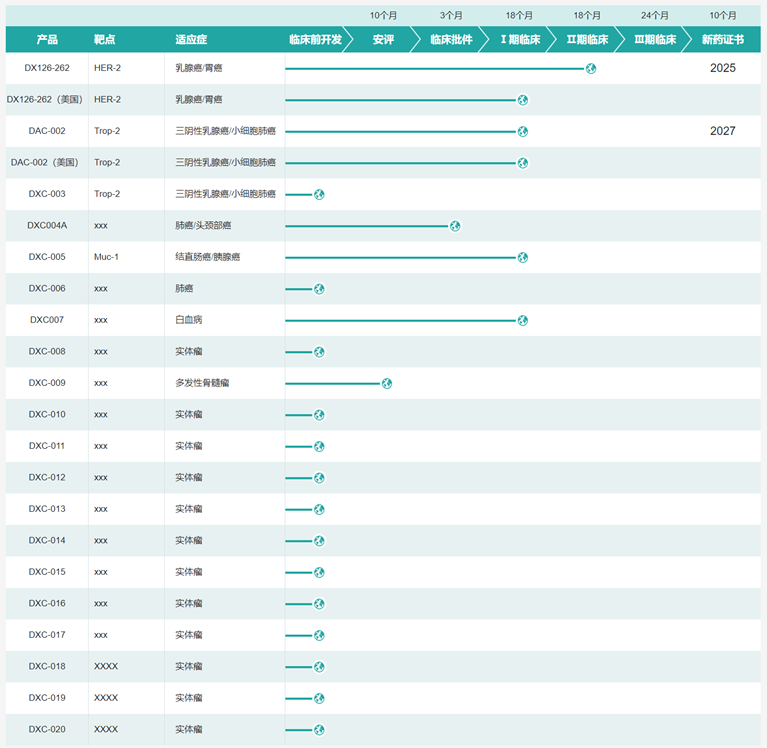
数据来源:多禧生物官网、智银全球生物医药项目库
★多禧生物的合作伙伴包括:君实生物、药明生物、杨森(强生)等:
(1)2019年12月,君实生物与多禧生物签订协议:君实生物获得在除日韩以外的全部亚洲国家及地区开展DAC-002的临床开发和商业化权利;多禧生物获得3000万元人民币的预付款、226.8万元人民币的样品制备费用、最高2.7亿元人民币的里程碑付款;
(2)2021年8月,药明生物与多禧生物建立战略合作:多禧生物发挥具有自主知识产权的多种有效载荷和连接子专业技术特长,药明生物提供具有自主知识产权的抗体发现技术平台,共同开发创新候选ADC;
(3)2022年6月,杨森(强生)与多禧生物签订协议:多禧生物应用独有的ADC创新平台,杨森提供的独有抗体,双方将就至多5个靶点开发新型ADC。
★多禧注重专利布局、ADC管线布局、技术研发、对外合作,技术研发方面注重小分子药物、连接子的开发,并通过与药明生物、杨森等合作弥补抗体开发方面的不足,推动管线研发与商业化。其发展轨迹可以对标西雅图遗传学,目前仍处于蛰伏期,随着产品的上市,未来可能会飞速发展,是国内一家竞争力很强的ADC企业。
3.2.4.东曜药业
★东曜药业于2010年7月成立,2019年10月上市,位于苏州工业园区,至2022年9月3日,港股市值为22.19亿港币;专注于创新型肿瘤药物及疗法开发与商业化,药品种类包括多种单克隆抗体药物、ADC、溶瘤病毒药物及特殊肿瘤药物(如脂质体药物)。
图表73:东曜药业融资历史
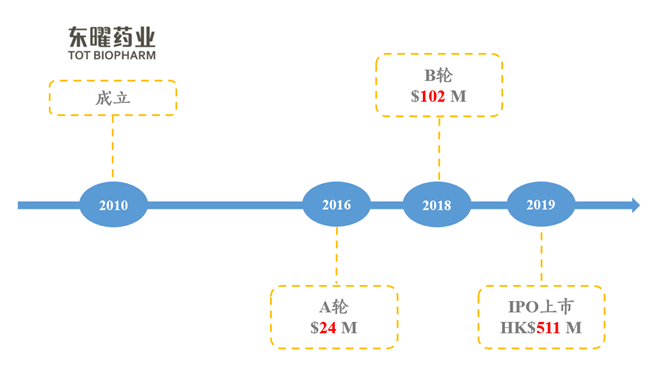
数据来源:动脉网、智银全球生物医药项目库
★东曜药业的主要团队成员包括:
(1)刘军博士:现任首席执行官,曾任集团副总经理、公司首席运营官。加入东曜前,曾任上海睿智化学研究有限公司生物制剂研发部执行总监、美国BayerHealthcare高级科学家。中国科技大学化学学士,加州大学戴维斯分校生物分析化学博士;
(2)黄纯莹女士:现任副主席,曾任集团总经理、公司执行董事及董事会副主席。加入东曜前,曾任台湾东洋药品工业股份有限公司癌症科学发展事业群执行副总经理、台北荣民总医院药剂师。台湾台北医学院(现称台北医学大学)药学学士;
(3)付山先生:现任董事长,同时是维梧资本(VivoCapitalLLC)的管理合伙人、联席首席执行官及大中华区首席执行官等。北京大学历史学学士、硕士。
图表74:东曜药业团队成员

数据来源:东曜药业官网、智银全球生物医药项目库
★东曜药业具有专用的ADC药物技术平台;专利包含器械、组合物、制剂、检测方法和抗体。其中,器械、制剂、分析方法占主体,其余较少。
图表75:东曜药业部分专利信息
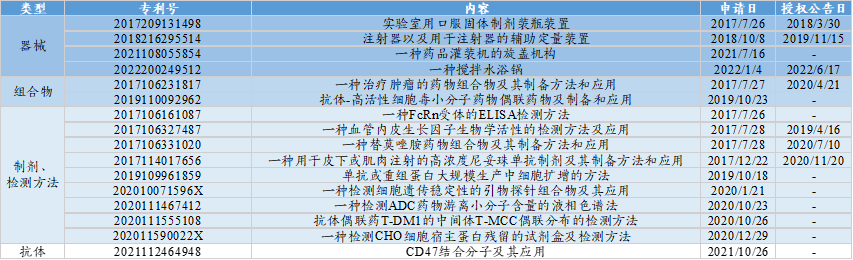
数据来源:中国及多国专利审查信息查询网、智银全球生物医药项目库
★东曜药业官网显示,目前有2条ADC管线,1款药物TAA013进入临床Ⅲ期。
TAA013由曲妥珠单抗和DM1通过MCC偶联,适应症为HER2+乳腺癌,是全球三个进入临床Ⅲ期的HER2+乳腺癌药物之一。
TAA013的HER2+乳腺癌临床Ⅰ期试验结果包括:
(1)安全耐受性:各剂量组均未观察到剂量限制性毒性,大部分不良事件为1-2级,临床可控,且抗药抗体均为阴性;
(2)药代动力学:在推荐剂量3.6mg/kg时,最大血药浓度为70.6μg/ml,药时曲线下面积为256.04天•μg/mL,半衰期为2.7天;
(3)有效性:在推荐剂量3.6m/kg时,客观缓解率为10%,疾病控制率达到70%,中位无进展生存期超过5个月,1例受试者治疗超过500天。
图表76:东曜药业在研管线图
数据来源:东曜药业官网、智银全球生物医药项目库
★东曜药业重点布局ADC领域CDMO/CMO服务,包括:
(1)拥有国内稀缺、GMP标准的集ADC裸抗、ADC原液和制剂于一体的完整ADC商业化生产车间,并配备OBE-5级别隔离器,ADC关键生产环节可以在同一厂区内集中完成;
图表77:东曜药业ADC商业化生产线图

数据来源:东曜药业年报、智银全球生物医药项目库
(2)拥有从工艺研发、临床生产、注册报批到商业化生产全流程的完整团队,已积累丰富的实战经验,能够提供一站式CDMO解决方案。
东曜CDMO合作包括:
(1)2021年5月,合作伙伴诗健生物和联宁生物联合开发的靶向TROP2抗体-SN38偶联物临床试验申请获批;
(2)2021年7月,合作伙伴新港生物旗下靶向CD79b的ADC(注射用NBT508)临床试验申请获批并已启动临床I期试验;
(3)2021年7月,与博瑞医药宣布开展抗体偶联药物CDMO服务战略合作,共同为客户提供ADC产品前期工艺开发、中间体规模放大和GMP生产服务。
★东曜药业是国内较早布局ADC的企业之一,但该公司目前的主打方向是ADC类CDMO/CMO。ADC管线不多,进展最快的管线竞争对手很多,同时专利和设施方面也更倾向于检测、器械等商业化方向。由于ADC工业化生产技术壁垒较高,构建ADC类CDMO/CMO需要一定的技术、时间,随着ADC赛道的逐渐火热,该方向未来将具有很大前景。
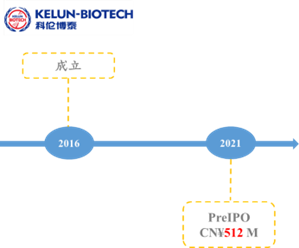
3.2.5.科伦博泰
★科伦博泰于2016年11月成立,位于成都;是科伦药业下属子公司,专注于生物技术药物及创新小分子药物的研发、生产、上市及国际合作。在肿瘤领域全面布局62个项目,包括41项靶向治疗药物、6项免疫治疗药物、3项细胞毒性药物、5项肿瘤支持治疗药物和7项细胞治疗项目。
图表78:科伦博泰融资历史
数据来源:动脉网、智银全球生物医药项目库
★科伦博泰的主要团队成员包括:
(1)刘革新先生:科伦集团创始人,现任集团董事长。曾任四川奇力制药有限公司总经理。研究生学历,高级工程师;
图表79:刘革新先生

数据来源:科伦药业官网、智银全球生物医药项目库
(2)葛均友先生:现任科伦博泰首席执行官,兼任四川科伦斗山生物技术有限公司董事。曾任上海延安制药厂生产主管、德国RATIOPHARM制药有限公司亚太区质量经理等。复旦大学博士。
★科伦博泰具有专用的ADC平台,具备靶点发现、毒理连接子筛选、设计以及ADC全平台的GMP生产能力;其专利主要涉及肿瘤治疗领域的化学药物,在ADC方面专利布局较少,包括CLDN-18.2、HER2等抗体。
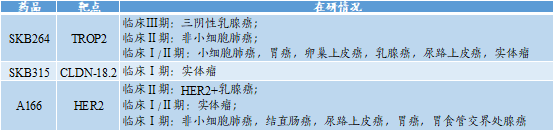
★科伦博泰目前具有至少3条ADC管线,包括:
(1)SKB264:由新型靶向TROP2单抗和新型拓扑异构酶I抑制剂通过酶可裂解连接子偶联,该药物的竞争对手包括国内外已上市的Trodelvy、第一三共进入临床Ⅲ期的Dato-DXd。
SKB264的Ⅰ/Ⅱ期临床试验表明:该药物在血液循环系统中无蓄积;不良反应轻,研究未发生导致死亡的AE;总缓解率(ORR)为41.2%(7/17),疾病控制率(DCR)为70.6%(12/17),对多种实体瘤都产生了较好的疗效反应;
(2)A166:由靶向HER2单抗(曲妥珠单抗)和新型微管蛋白抑制剂毒(Duo-5)通过新型酶可裂解连接子偶联,竞争对手为Kadcyla。
图表80:科伦博泰在研管线图
数据来源:药融云、智银全球生物医药项目库
★科伦博泰主要与默沙东进行合作:
(1)2022年5月,科伦博泰与默沙东签订协议:有偿独家许可默沙东在中国以外(中国大陆,香港、澳门和台湾)区域范围内研发、生产与商业化靶向TROP2的ADC药物SKB264;科伦博泰将获得4700万美元的预付款、最高13.63亿美元的里程碑付款及销售额提成;
(2)2022年7月,科伦博泰与默沙东签订协议:有偿独家许可默沙东在全球范围内进行研发、生产与商业化某款ADC药物(可能为SKB315);科伦博泰将获得3500万美元的预付款、最高9.01亿美元的里程碑付款及销售额提成。
★科伦博泰并非国内最早发展ADC的平台,但是其背后平台较大,进展速度很快,最快的管线已经进展到临床Ⅲ期。目前管线中发展较快的两个均是热门靶点,竞争对手较多,优势暂不明显;同时,科伦在肿瘤治疗领域的布局很广,并非专攻ADC,其在ADC领域的专利、技术布局可能不及部分国内企业。笔者认为,科伦可以对标基因泰克,二者同为大公司的子公司,且发展方面很广,可以与其它技术型ADC公司合作,利用其平台在ADC赛道更好、更快地前行。
3.2.6.恒瑞医药
★恒瑞医药于1970年成立,2000年上市,总部位于连云港,至2022年9月3日,A股市值为2162.48亿人民币;是国内知名的抗肿瘤药、手术用药和影像介入产品的供应商。
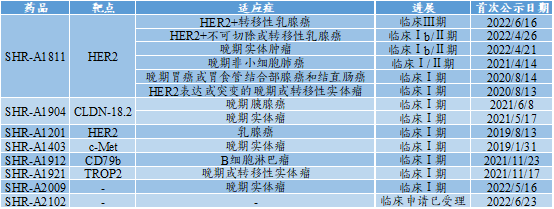
★恒瑞发展ADC的政策主要为仿制。2011年仿制Kadcyle研发出SHR-A1201,但一直停止在临床Ⅰ期阶段;2019年仿制Enhertu研发出SHR-A1811等DXd类似物ADC,对DAR做出了优化。
恒瑞具有专用的ADC技术平台,靶点和小分子药物都比较丰富,包括:HER2、HER3、CEA、PSMA、B7H3、TROP2、CD79B、ClDN-18.2等靶点;依喜替康类似物、澳瑞他汀类似物等小分子药物。专利布局同样,靶点、小分子药物、组合物布局相当广泛,但以类似物为主。
★目前,恒瑞医药是国内拥有ADC管线数最多的企业,有8款处于临床,但大多处于临床Ⅰ期,1款药物SHR-A1811进入临床Ⅲ期。SHR-A1811以HER2为靶点,目前竞争较激烈。
图表81:恒瑞在研管线图
数据来源:药融云、智银全球生物医药项目库
★恒瑞属于中国制药龙头企业,其研发实力不容小觑。目前ADC平台基础很雄厚,主要以仿制为主。管线虽多,但能否发展下去仍需要时间验证。
3.2.7.其它企业:
★石药集团:于1997年8月成立,总部位于石家庄,是一家集创新药物研发、生产和销售为一体的国家级创新型企业。
目前,石药集团具有至少5条ADC管线,2款药物进入临床,包括:
(1)DP303c:以HER2为靶点,适应症为HER2+胃癌,2018年2月,获得FDA颁发治疗胃癌的孤儿药资格认定,2019年7月NMPA批准临床,目前进入临床Ⅱ期;
(2)SYSA1801:以CLDN-18.2为靶点,2021年6月NMPA批准临床,2021年7月FDA批准临床。2022年7月,石药集团与ElevationOncology达成协议:ElevationOncology获得SYSA1801在大中华地区(中国大陆、中国香港、中国澳门及中国台湾)以外地区的开发及商业化独家权利;石药集团获得2700万美元的预付款、最高11.68亿美元的里程碑付款。
★美雅珂(乐普):于2014年1月成立,位于上海浦东新区张江高科技园区,专注于ADC研发。
2019年,美雅珂与Synaffix签订协议,以1.25亿美元引进ADC专利技术GlycoConnect™和HydraSpace™:
(1)GlycoConnect™能够利用天然糖基化位点实现定点偶联;
(2)HydraSpace™是一种高极性化的连接体技术,改善ADC的稳定性、溶解度、偶联能力。
目前,美雅珂有6条ADC管线,2款药物MRG003、MRG002进入临床Ⅱ期,2款药物MRG001、MPG901进入临床Ⅰ期,与康诺亚生物共同研发的CMG901获得IND审批。
乐普生物于2018年成立,是乐普医疗旗下的子公司,2018年获得美雅珂的控股权及几款ADC药物的全球权利,2020年收购美雅珂。
★云顶新耀:于2020年4月成立,2020年9月上市,位于嘉兴,致力于生物制药。
目前,云顶新耀的核心ADC为从吉利德引入的Trodelvy:
(1)2019年4月,云顶新耀与Immunedics(吉利德)达成协议:云顶新耀获得在中国等地Trodelvy的开发和商业化独家权利,Immunedics获得6500万美元的预付款、最高7.7亿美元的里程碑付款及销售提成;
(2)2022年6月,NMPA批准了云顶新耀的新药戈沙妥珠单抗(Trodelvy)的上市申请;
(3)2022年8月,云顶新耀将Trodelvy在大中华区、韩国和部分东南亚国家的开发和商业化独家权利退回Immunedics。
★宜联生物:于2020年7月成立,位于苏州工业园区,专注于ADC研发,由原科伦博泰首席执行官薛彤彤博士创立。宜联生物自主研发第四代高DAR、低中毒素ADC技术。技术平台中的抗体种类包括:人源化抗体、双特异性抗体等;小分子毒素包括:澳瑞他汀衍生物、美登素衍生物、喜树碱衍生物等;连接子包括:可裂解型、不可裂解型。目前,宜联医药有7条ADC管线,1款药物YL201进入临床Ⅰ期。
★瓴路药业:于2020年12月成立,在北京、上海、波士顿设有办事处,致力于生物制药,由高瓴资本支持。
此后,瓴路药业与ADCTherapeutics成立合资公司OverlandADCTBioPharma。ADCT提供旗下Lonca、ADCT-602、ADCT-601和ADCT-901在大中华区和新加坡的独家开发和商业化权利,瓴路药业投资5000万美元,拥有51%的股份。目前,瓴路药业的ADC管线即为这4条。
★联宁生物:于2021年10月成立,位于苏州工业园区,专注于ADC研发,为美国SorrentoTherapeutics旗下子公司。联宁生物能够提供多种抗体、小分子药物、连接子等产品,此外,其技术平台拥有新一代定点偶联技术C-LOCK的专利。核心ADC产品STI-6129进入临床Ⅰ期。
3.2.8.CDMO/CMO企业
根据弗若斯特沙利文,2021年-2025年中国CDMP/CMO市场收入年均复合增长速度为30.0%,预计2025年中国整体CDMO/CMO市场收入为1235亿人民币;2021年-2025年生物药CDMO/CMO服务年均复合增长率为30.0%。
ADC商业化具有以下难点:
(1)生产组分复杂。ADC生产中涉及到生物组分、化学组分的生产,需要具备不同类型的生产车间及生产技术,同时需要不同单位的相互配合,做好存储、转移工作,生产中要考虑的方面成倍于单一品种药物生产;
(2)工艺流程复杂。ADC生产流程包括抗体生产、小分子药物生产、偶联、制剂,各部分均步骤繁多、流程复杂;
图表82:ADC生产流程图示例
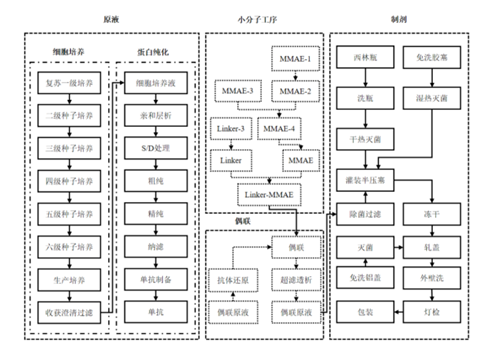
数据来源:荣昌制药招股书、智银医药资料库
(3)检测指标复杂。根据抗体偶联药物质量控制和临床前评价专家共识,ADC的检测指标包括工程细胞管理、单抗质量控制(理化、免疫学性质等)、小分子药物质量控制(形状、含量等)、连接子质量管理、ADC质量控制(DAR、载药量、偶联位点、生物活性等)、工艺质量控制(杂质、污染物、含量等)、稳定性评价、临床前药效学(靶向作用、抗肿瘤作用等)、药代动力学等。
可见,ADC商业化门槛很高,随着未来ADC逐渐发展,CDMO/CMO必将成为热门的选择。目前,国内ADC的CDMO/CMO企业包括:药明合联、迈百瑞、东曜药业、臻皓生物等。
3.3.AOC研发情况
AOC研发公司包括AvidityBiosciences、DyneTherapeutics、TallacTherapeutics等,代表为AvidityBiosciences。该公司技术平台主要以mAb和siRNA作为偶联对象。
图表83:AvidityBiosciences技术平台

数据来源:AvidityBiosciences官网、智银全球生物医药项目库
AvidityBiosciences于2013年成立,2020年上市,总部位于美国特拉华州,至2022年9月3日,美股市值为11.08亿美元;致力于发展靶向RNA治疗技术。
图表84:AvidityBiosciences融资历史
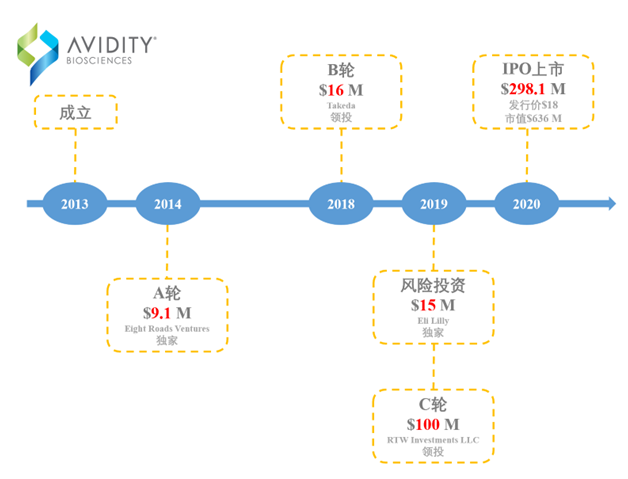
数据来源:Crushbase、智银全球生物医药项目库
TroyWilson博士为联合创始人,现任执行主席职位,曾任公司总裁及首席执行官。曾任职于KuraOncology、WellspringBiosciences等公司。加州大学伯克利分校生物物理学学士、生物有机化学博士及纽约大学法学博士。
AvidityBiosciences官网显示,目前有7条AOC管线,1款药物AOC1001进入临床。
AOC1001靶点为DMPK,由靶向TfR1抗体与靶向DMPK基因的mRNA的siRNA偶联,可以减少骨骼、心肌、平滑肌中DMPK基因的RNA水平。适应症为肌强直性营养不良Ⅰ型,该疾病由DMPK基因突变造成。
图表85:AvidityBiosciences在研管线
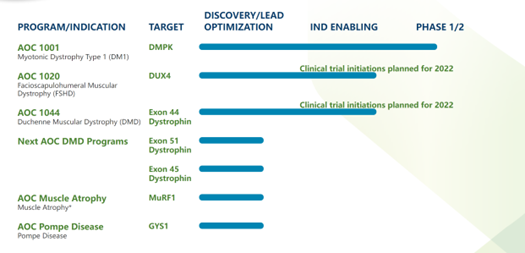
数据来源:AvidityBiosciences官网、智银全球生物医药项目库
全球AOC在研管线如下,其中:AvidityBiosciences以mAb和siRNA及PMO作为偶联对象,1条管线推进至临床Ⅰ期,2条管线计划2022推进至临床Ⅰ期;DyneTherapeutics以Fab和ASO(包括PMO)作为偶联对象,2条管线计划2022推进至临床Ⅰ期;其余公司进展相对较慢。
图表86:全球AOC在研管线
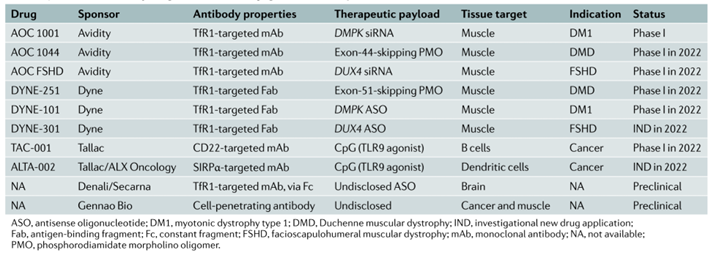
数据来源:A.Mullard,Nat.Rev.DrugDiscov.2022,21,6-8.、智银全球生物医药项目库
3.4.ABC研发情况
ABC研发公司很少,目前值得一定关注的公司为KodiakSciences,ABC研发技术也为该公司研发(详见1.5.2.)。
KodiakSciences于2009年成立,2018年上市,总部位于美国加州,至2022年9月3日,美股市值为5.28亿美元;该公司是一家处于临床期的生物医药公司,专注于发展慢性病、高度流行眼科疾病的新疗法。
图表87:KodiakSciences融资历史
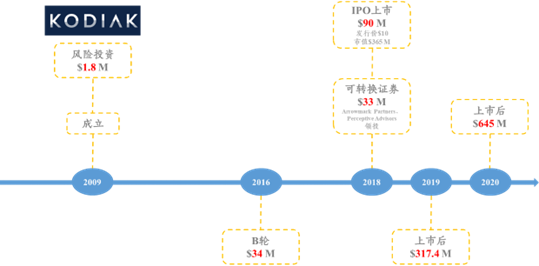
数据来源:Crushbase、智银全球生物医药项目库
VictorPerlroth博士为联合创始人,现任董事长兼执行总经理。曾联合创立了Avidia,并在该公司担任总经理和公司发展副总裁;曾在GuzikTechnicalEnterprises担任首席运行官。斯坦福大学医学博士和工商管理硕士学位,普林斯顿大学分子生物学学士。
图表88:VictorPerlroth博士

数据来源:KodiakSciences官网、智银全球生物医药项目库
KodiakSciences官网显示,目前有3条ABC管线,最快进入临床III期,包括:
(1)KSI-301:单靶点ABC,是VEGF抑制剂,该药物的四种适应症:视网膜静脉阻塞、糖尿病性黄斑水肿、湿性黄斑变性、糖尿病性视网膜病变均处于临床III期;
(2)KSI-501:双靶点ABC,是IL6和VEGF双重抑制剂,适应症为视网膜血管疾病,未进入临床;
(3)KSI-601:三靶点ABC,适应症为干性老年性黄斑变性,未进入临床。
图表89:KodiakSciences在研管线

数据来源:KodiakSciences官网、智银全球生物医药项目库
2022年2月,公司的核心产品KSI-301在湿性黄斑变性适应症临床IIb/III期试验中未能达到主要疗效终点,原因可能是给药方案用药间隔过长。受此影响,公司股价大跌80%。该公司计划于2022年Q3公布KSI-301其它适应症的关键临床试验数据。
3.5.ACC研发情况
与ABC类似,ACC研发公司也很少,目前有一定前景的公司为Acepodia,ACC研发技术也为该公司研发(详见1.5.3.),公司技术平台以oNK细胞和γδ2T细胞作为细胞偶联物。
Acepodia于2016年成立,总部位于美国加州;是一家致力于发展创新高效细胞疗法以治疗肿瘤的生物技术公司。
图表90:Acepodia融资历史
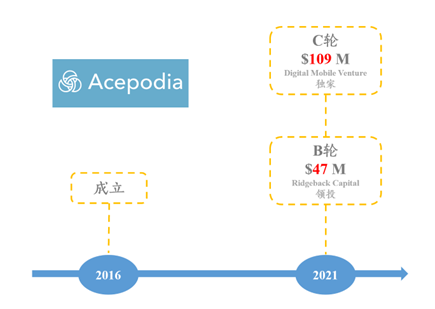
数据来源:Crushbase、智银全球生物医药项目库
Acepodia的主要团队成员包括:
(1)PatrickY.Yang博士:联合创始人,现任董事长职位,曾在JunoTherapeutics、罗氏、基因泰克任职执行副总经理。台湾交通大学工程学学士,辛辛那提大学电气工程硕士,俄亥俄州立大学电气工程博士;
(2)SonnyHsiao博士:联合创始人,现任总裁职位,在免疫细胞治疗领域造诣颇深,指导公司的ACC技术平台。台湾国立大学化学学士,加利福尼亚大学伯克利分校化学与分子生物学博士。
图表91:Acepodia团队成员

数据来源:Acepodia官网、智银全球生物医药项目库
Acepodia重点布局ACC管线。官网显示,目前有6条管线,多数为研发期或临床前期,2款药品进入临床Ⅰ期,包括:
(1)ACE1702:由靶向HER2抗体和oNK细胞偶联,适应症为乳腺癌、子宫内膜癌、卵巢癌等固体瘤;
(2)ACE1831:由靶向CD20抗体和γδ2T细胞偶联,适应症为血液肿瘤。
二者在体内外研究中均效果良好。
图表92:Acepodia在研管线
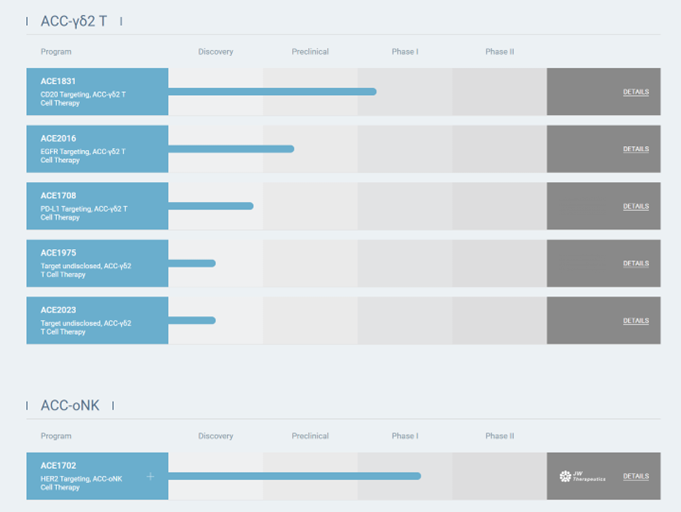
数据来源:Acepodia官网、智银全球生物医药项目库
四、总结
4.1.A“X”C药物发展趋势
4.1.1.多点开花,全面发展
★就种类方面:A“X”C目前处于研发早期阶段,偶联对象分布差异悬殊,ADC管线达到四百余个,而其它类型大多处于个位数;靶点分布很不均匀,热门靶点如HER2、TROP2等竞争激烈,而其余靶点仅有少数研发平台;适应症主要集中在癌症领域。因此,未来A“X”C发展将不断扩大偶联物与靶点的种类,但在此方向上,机遇与风险并存,应全面考量新偶联物或新靶点的成功率再进一步进行投资;
★就技术方面:目前上市药物仍然存在毒性较大、DAR不够均一、容易产生耐药等问题。采用的抗体、连接子、药物负载、连接方法等仍需要进一步的发展与创新,目前也不断有新方法涌现。随着越来越多厂商参与进A“X”C赛道,唯有具有过硬的、全面的、不断更新优化的技术,才能站住脚跟,笑到最后;
图表93:上市ADC黑框警告情况
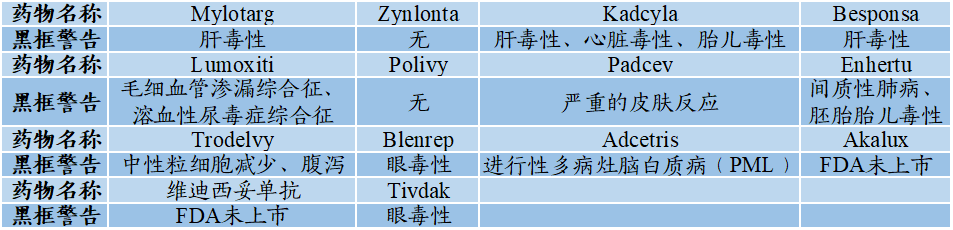
数据来源:生物诊断网、智银全球生物医药项目库
★就A“X”C发展全流程方面:A“X”C从研发到商业化是很漫长的过程,不仅需要独到的研发能力,还需要坚实的专利屏障、扎实的生产能力、符合标准的生产环境、富有经验的法律团队和营销团队等,因此企业应进行全方面的考量与发展,避免某个环节出现短板而出现损失;
★就产业链而言:国内ADC发展仍然存在上游仪器、耗材等卡脖子问题。“十四五”医药工业发展规划多次强调“供应链稳定可控”,国内医药上游供应链的发展需求迫切。因此,在专注药物技术创新的同时,应重视整体供应链的稳定,一方面需要国家支持与上游供应链企业发展;另一方面,ADC企业要重视上游供应链厂商的动态,做好备选方案,防患于未然。
4.1.2.取长补短,合作共赢
★目前,出现的ADC企业主要为技术型、引进型和CDMO/CMO型。技术型企业之间的合作,引进型企业与技术型企业之间的平台合作、管线引进、技术授权、收购,CDMO/CMO型企业为其它企业提供全流程服务等情况比比皆是,未来会继续增加;
★目前,国内外企业之间的合作也不占少数。如:华东医药引入ImmunoGen的IMGN853,云顶新耀引入吉利德的Trodelvy,荣昌生物将维迪西妥单抗授权西雅图遗传学,科伦博泰将项目B授权默沙东等,通过国际之间的交流,将引入先进技术,以及提高国内产品在国际上的认可程度。
4.2.投资建议
可以看出,目前ADC正处于黄金时代,该赛道未来将会出现大量的竞争者。
★对于企业应考虑:是否有充分的积淀时间,是否有足够的创新潜力,是否有全面的专业布局,是否有可信的合作伙伴,是否有明显的风向标(龙头制药企业收购或龙头投资机构支持等)等;
★对于产品应考虑:研发企业是否可靠、靶点选择是否合适(热门靶点竞争激烈,冷门靶点具有风险),适应症是否有足够的市场,竞争对手是否强势,创新点是否具有优势(药物载荷、连接子、偶联方式、DAR、疗效、药动学性质等)等。
免责声明
本报告仅供智银资本(以下简称“本公司”)的客户使用。本公司不会因接收人收到本报告而视其为客户。
本报告是基于本公司认为可靠的已公开信息,但本公司不保证该等信息的准确性或完整性。本报告所载的资料、工具、意见及推测只提供给客户作参考之用,并非作为或被视为出售或购买证券或其他投资标的的邀请或向人作出邀请。
客户应当认识到有关本报告的相关推荐等只是研究观点的简要沟通,需以本公司刊载的完整报告为准。
本报告所载的资料、意见及推测仅反映本公司于发布本报告当日的判断,本报告所指的证券或投资标的的价格、价值及投资收入可能会波动。在不同时期,本公司可发出与本报告所载资料、意见及推测不一致的报告。
客户应当考虑到本公司可能存在可能影响本报告客观性的利益冲突,不应视本报告为作出投资决策的惟一因素。本报告中所指的投资及服务可能不适合个别客户,不构成客户私人咨询建议。本公司未确保本报告充分考虑到个别客户特殊的投资目标、财务状况或需要。本公司建议客户应考虑本报告的任何意见或建议是否符合其特定状况,以及(若有必要)咨询独立投资顾问。
在任何情况下,本报告中的信息或所表述的意见并不构成对任何人的投资建议。在任何情况下,本公司不对任何人因使用本报告中的任何内容所引致的任何损失负任何责任。
若本报告的接收人非本公司的客户,应在基于本报告作出任何投资决定或就本报告要求任何解释前咨询独立投资顾问。
本报告的版权归本公司所有。本公司对本报告保留一切权利。除非另有书面显示,否则本报告中的所有材料的版权均属本公司。未经本公司事先书面授权,本报告的任何部分均不得以任何方式制作任何形式的拷贝、复印件或复制品,或再次分发给任何其他人,或以任何侵犯本公司版权的其他方式使用。所有本报告中使用的商标、服务标记及标记均为本公司的商标、服务标记及标记。

 产业资讯
产业资讯
 Bio Journey
Bio Journey  2025-09-29
2025-09-29
 20
20

 产业资讯
产业资讯
 深蓝观
深蓝观  2025-09-29
2025-09-29
 19
19

 产业资讯
产业资讯
 细胞基因治疗前沿
细胞基因治疗前沿  2025-09-29
2025-09-29
 21
21