 产业资讯
产业资讯
 药渡Daily
药渡Daily  2022-11-29
2022-11-29
 2412
2412
1 全球新药研发进展
2022.11.12-11.18这一周,全球新药研发各个领域均有新的突破,包括:肿瘤、精神、神经、消化系统、心血管、感染、免疫、皮肤和结缔组织疾病、内分泌系统等多个领域。其中,肿瘤等热门领域依旧同时涵盖了化学药、生物药、细胞疗法的最新研究进展。
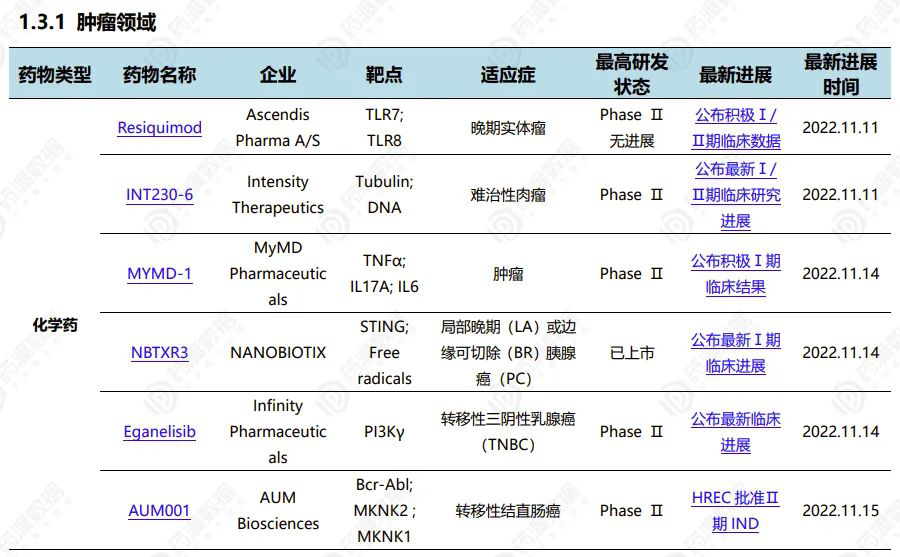
Infinity Pharmaceuticals公布Eganelisib MARIO-3临床研究最新临床进展
2022年11月14日,Infinity Pharmaceuticals公布Eganelisib联用Atezolizumab和白蛋白紫杉醇作为一线疗法治疗转移性三阴性乳腺癌患者的MARIO-3临床研究积极结果。
在MARIO-3临床研究中,62例患者入组并评估安全性,57例患者评估疗效,中位随访时间为10.0(8.1,14.2)个月。在 57 名可评估患者中:
35例(61.4%)PD-L1(-)肿瘤
18例患者(31.6%)患有PD-L1(+)肿瘤
4例患者(7.0%)患有PD-L1状态未确定的肿瘤
研究结果显示:自2021年圣安东尼奥乳腺癌研讨会以来,数据成熟度又延长了一年,现在有令人鼓舞的证据表明,与基准 IMpassion130研究相比,MARIO-3研究者患者的一年PFS率有所提高,包括PD-L1(+)和PD-L1(-)肿瘤患者,具有长期患者无进展生存期(PFS)获益,并未发现新的安全信号。
Eeganelisib(IPI-549)是Infinity Pharmaceuticals研发的“First-in-class”口服免疫肿瘤巨噬细胞重编程疗法,旨在解决癌症免疫抑制的基本生物学机制在多项临床研究中。

来源:Infinity Pharmaceuticals官网
Cocrystal Pharma公布CC-42344 I期临床研究积极结果S
2022年11月17日, Cocrystal Pharma宣布CC-42344在正在进行的I期研究的单次递增剂量和多次递增剂量部分均表现出良好的安全性。CC-42344是一种广谱口服抗病毒药物,用于治疗大流行性和季节性甲型流感,具有新的作用机制。CC-42344是一种口服PB2抑制剂,采用Cocrystal专有的基于结构的药物发现平台技术。它专门设计用于有效对抗所有重要的大流行性和季节性甲型流感毒株,并且由于病毒复制机制的靶向方式而具有很高的抗药性障碍。CC-42344靶向流感聚合酶,流感聚合酶是一种必需的复制酶,具有多种流感毒株共有的几个高度保守的区域。体外测试显示,CC-42344对甲型流感毒株(包括大流行和季节性毒株)以及抗达氟和Xofluza菌株具有出色的抗病毒活性,同时还显示出良好的PK和安全性。

来源:Cocrystal官网
2022.11.12-11.18全球新药研发进展(部分)
2 国内新药研发进展
2022年11月12日-11月18日,国内新药研发同样突飞猛进,治疗肿瘤的生物药进展迅速。
和黄医药宣布呋喹替尼二线治疗胃癌的FRUTIGA中国III期研究取得阳性顶线结果
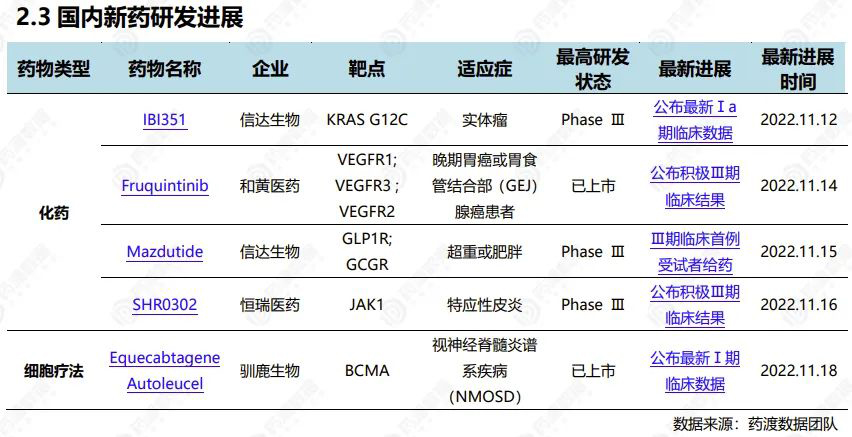
2022年11月14日,和黄医药公布呋喹替尼III期临床试验FRUTIGA研究的初步结果。该研究旨在评估呋喹替尼与紫杉醇联合疗法治疗晚期胃癌或胃食管结合部(GEJ)腺癌患者,研究共纳入703名中国患者。该研究取得了阳性结果,达到了其中一个主要终点,即无进展生存期(PFS)取得具有统计学意义的显著改善,这一结果具有临床意义。同时,另一个主要终点总生存期(OS)尽管在中位OS上观察到改善,但按照预设的统计计划未取得统计学显著性。此外,包括客观缓解率(ORR)、疾病控制率(DCR)和延长缓解持续时间(DoR)在内的次要终点亦均观察到具有统计学意义的显著改善。呋喹替尼在FRUTIGA研究中的安全性特征与既往研究中观察到的一致。呋喹替尼是一种高选择性、强效的口服血管内皮生长因子受体(VEGFR)-1、-2及-3抑制剂。VEGFR抑制剂在抑制肿瘤的血管生成中起到至关重要的作用。呋喹替尼的独特设计使其激酶选择性更高,以达到更低的脱靶毒性、更高的耐受性及对靶点更稳定的覆盖。迄今,呋喹替尼在患者中的耐受性普遍良好,并且临床前研究中展示出的较低的药物间相互作用的可能性,或使其非常适合与其他癌症疗法联合使用。

来源:和黄医药公告
信达生物宣布Mazdutide (IBI362) 中国超重或肥胖III期临床研究GLORY-1完成首例受试者给药
2022年11月15日,信达生物宣布,胰高血糖素样肽-1受体(glucagon-like peptide-1 receptor, GLP-1R)/胰高血糖素受体(glucagon receptor, GCGR)双重激动剂Mazdutide (研发代号:IBI362) 在中国超重或肥胖受试者中的一项随机、双盲、安慰剂对照的III期临床研究(GLORY-1)完成首例受试者给药。
本研究是一项在中国超重或肥胖受试者中评估Mazdutide的有效性和安全性的随机、双盲、安慰剂对照的III期临床研究(NCT05607680),也是全球GLP-1R/GCGR双重激动剂中第一个在肥胖适应症开展的注册临床研究,有望率先实现新的突破。该研究计划纳入600例受试者,按1:1:1的比例随机分配至Mazdutide 4mg组、Mazdutide 6mg组或安慰剂组,共治疗48周。研究的主要终点是第32周时受试者体重相对基线的百分比变化以及体重相对基线下降≥5%的受试者比例。此前,一项在中国超重或肥胖受试者中进行的随机、双盲、安慰剂对照的II期临床研究(ClinicalTrials.gov, NCT04904913)的结果显示,给药24周后,mazdutide 6 mg组受试者的体重相对基线百分比变化为-11.57%。此外,Mazdutide还可显著降低受试者腰围、血脂、血压、血尿酸、肝酶和肝脏脂肪等,为超重或肥胖受试者带来多重代谢获益,展现出同类最优的潜力。安全性方面,Mazdutide耐受性良好,整体安全性特征与同类药物相似。此项III期临床研究将进一步验证Mazdutide长期给药的疗效及安全性。

来源:信达生物官网
2022.11.12-11.18国内新药研发进展(部分)
3 国内临床默示许可进展
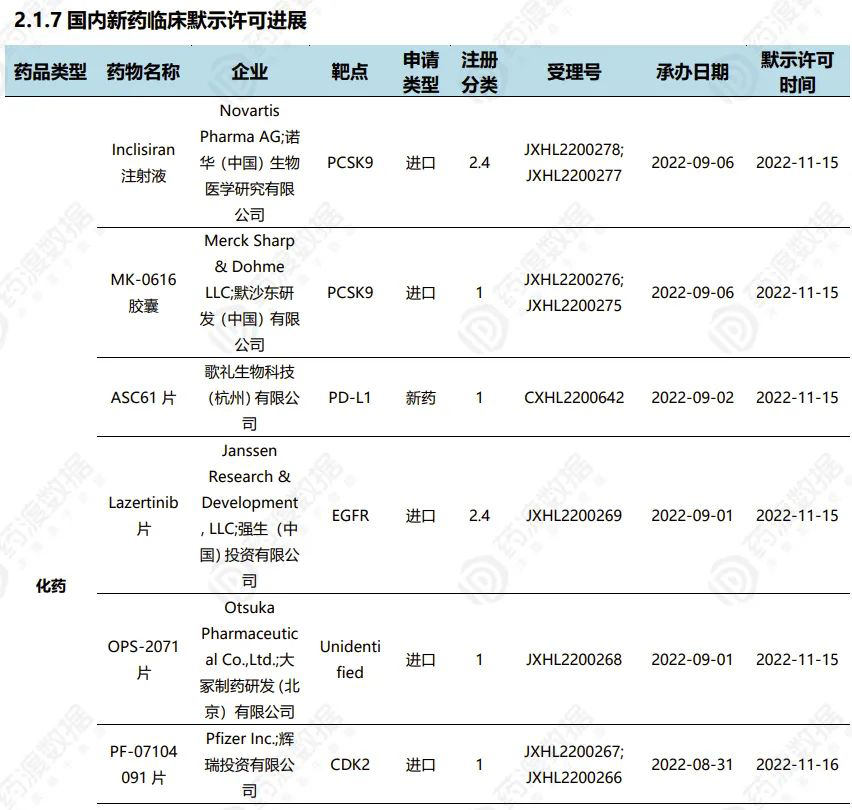
2022.11.12-11.18临床默示许可进展(部分)
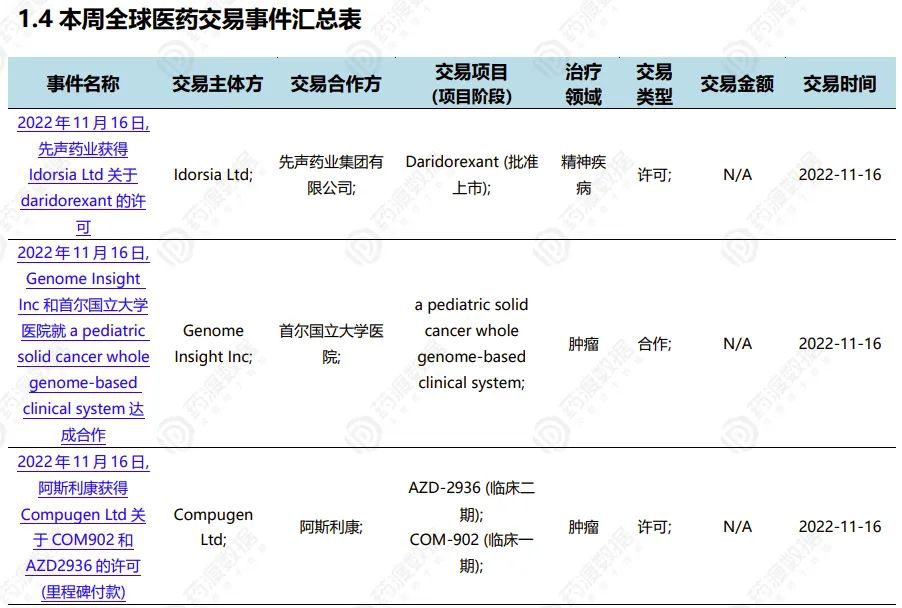
4 全球医药交易事件
先声药业与瑞士Idorsia公司就双食欲素受体拮抗剂失眠新药达成许可协议
2022年11月16日,先声药业和瑞士领先的Idorsia共同宣布,已就Idorsia的新型抗失眠药物Daridorexant在中国的开发签订独家许可协议。根据协议,先声药业将获得大中华地区(中国大陆、香港、澳门)开发和商业化Daridorexant的独家权利。先声负责在中国开展该项目的临床研发。在既往先必新开发与商业化的成功基础上,Daridorexant将进一步扩充先声药业神经科学产品管线。Idorsia公司将获得3000万美元的首付款,并有资格在中国注册获批后获得2000万美元额外里程碑付款,以及基于未来销售额的低两位数分层特许权使用费。
自1998年食欲素及其受体被发现以来,Idorsia的研究团队一直致力于该领域科学研究,并发现对食欲素系统的拮抗可让失眠患者保持自然睡眠结构,由此开发出双促食欲素受体拮抗剂Daridorexant(海外商品名QUIVIVIQ)。它通过阻断促醒神经肽——食欲素与其受体结合,从而降低过度活跃的中枢觉醒。与一般通过镇静大脑来诱导睡眠的疗法不同,Daridorexant仅阻断食欲素受体的启动,因此可减少唤醒驱动,诱导睡眠发生,而不改变睡眠阶段的比例。III期关键性临床试验数据发表于《柳叶刀神经病学》杂志( 2022;21:125–39.)。
来源:先声药业官网
成都先导与韩国Daewoong达成基于DEL技术的新药研发合作
2022年11月14日,成都先导宣布与韩国Daewoong达成新药研发合作。
此次合作,成都先导将针对Daewoong所关注的靶点,在DNA编码化合物库(DEL)中筛选能与其结合的起始化合物,用于进一步的新药开发。成都先导是DEL技术开发及其在小分子新药研发领域应用的全球领导者,其DEL技术平台可设计、合成和筛选包含超过1.2万亿DNA编码化合物的实体分子库。

来源:成都先导官网
2022.11.12-11.18全球医药交易(部分)

 产业资讯
产业资讯
 小药说药
小药说药  2025-05-28
2025-05-28
 36
36

 产业资讯
产业资讯
 2025-05-28
2025-05-28
 34
34

 产业资讯
产业资讯
 医麦创新药
医麦创新药  2025-05-28
2025-05-28
 33
33