 产业资讯
产业资讯
 医麦客
医麦客  2025-05-28
2025-05-28
 1697
1697
近年来,细胞疗法已经成为全球生物制药领域的战略布局重点。据行业统计,2024 年全球生物制药企业在细胞与基因(CGT)领域的投资已突破 250 亿美元,预计 2025 年将持续保持增长态势。Global Market Insights 预测,至 2030 年,全球细胞治疗市场规模有望突破 800 亿美元。
作为前沿发展方向之一,通用细胞疗法(又称同种异体细胞疗法)可通过标准化生产实现「即用型」细胞药物的临床转化,在显著降低生产成本的同时提升治疗可及性。然而,该领域现阶段仍面临免疫排斥、持久性不足等挑战。
近期,邦耀生物科研团队在国际学术期刊 Cell Research 上发表突破性临床研究成果,披露了其基于 CRISPR/Cas9 基因编辑技术构建的异体抗 CD19 CAR-T 细胞(BRL-303)在难治性系统性红斑狼疮(SLE)治疗中的临床数据。结果表明,BRL-303 在 SLE 治疗中展现出快速深度的疾病缓解能力,且未发现严重不良事件,验证了该疗法的临床安全性和有效性。

2025 ASGCT 年会上公布的数据显示,入组患者的临床体征和症状均获得持续性改善,SLE
疾病活动度得到根本性控制,治疗全程未观察到移植物抗宿主病(GVHD)、免疫效应细胞相关神经毒性综合征等严重并发症。
值得关注的是,BRL-303 疗法此前已在免疫介导的坏死性肌炎(1 例)、系统性硬化症(2 例)等自身免疫疾病治疗中取得突破,相关研究成果于 2024 年 7 月发表于国际顶级学术期刊 Cell。
随着基因编辑技术、诱导多能干细胞(iPSC)技术的迭代突破,以及临床数据的持续积累,通用型细胞疗法正不断突破技术瓶颈,有望为癌症、自身免疫疾病等多种疾病提供普惠型治疗方案。当前在研通用细胞疗法管线根据细胞来源可大致分为三类技术路径,一是基因编辑改造的通用 CAR-T/CAR-NK 疗法;二是包含 NK、NKT、γδT 在内的天然免疫细胞疗法;三是由 iPSC 衍生的免疫细胞疗法。
以下将针对这三大技术路径展开详细论述。
通用 CAR-T/CAR-NK
通用型 CAR-T(UCAR-T)是基于异体 T 细胞来源的免疫细胞疗法,其技术核心在于通过体外基因编辑技术对健康供体 T 细胞进行改造扩增。相较于自体 CAR-T 疗法存在的生产成本高、制备时间长等局限,UCAR-T 在插入靶向肿瘤抗原的嵌合抗原受体(CAR)后可以变成「现货即用」的标准化治疗产品,增强患者可及性。
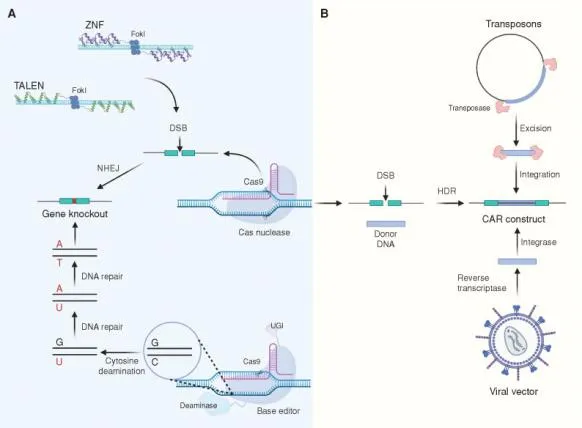
▲ UCAR-T 基因编辑 图源:参考资料 1
然而,UCAR-T 在临床转化中仍面临三大核心挑战,包括GVHD、宿主抗移植物反应(HVGR)和疗效持久性不足。
国内外研发格局
全球已有多家企业布局 UCAR-T 疗法领域,海外先驱包括 Cellectis、Allogene、Caribou 和 Poseida 等;国内企业如科济药业、北恒生物、亘喜生物、邦耀生物、奇迹生物、益杰立科、臻愈生物、尊羿生物等均已入局。目前,国内外研发进展差距较小,在研管线多处于早期阶段。
在临床突破方面,近期多项研究证实了 UCAR-T 在肿瘤及自身免疫疾病领域的治疗潜力。以科济药业基于 THANK-uCAR®技术平台研发的双靶点 UCAR-T 候选产品 CT0590 为例,其采用 BCMA 和 NKG2A 双特异性 CAR 结构,结合 TRAC/B2M/NKG2A 三基因敲除策略,有效规避 GVHD 和 HVGR 风险。2024 年 ASH 年会披露的 IIT 数据显示,CT0590 安全性可控,疗效持久性与自体 CAR-T 相当甚至更优,2 例患者实现超 20 个⽉的持续缓解。
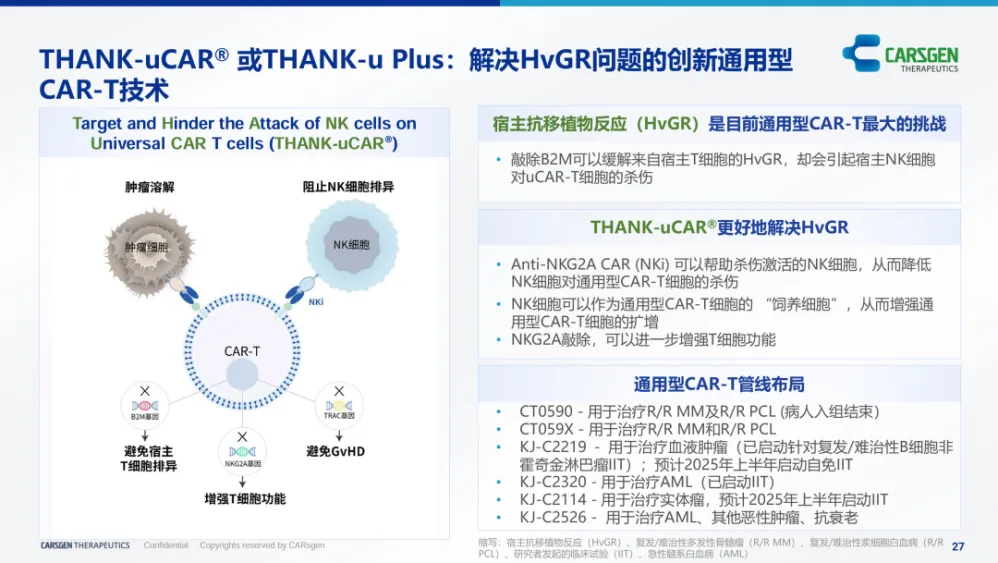
在此基础上,科济药业推出增强型 Plus 技术平台,通过优化 NKG2A 表达调控机制,确保不同 NKG2A 表达水平下 CAR-T
细胞的持续扩增能力。其 BCMA 靶向候选产品 CT0596 早期临床数据显示,60% 可评估患者治疗仅 4
周即达到严格完全缓解/完全缓解(sCR/CR),且所有 sCR/CR 患者维持持续缓解状态。
2024 年下半年,诸多 MNC 企业加速布局 UCAR-T 领域。诺华、罗氏等相继达成技术合作,其中罗氏以总价 15 亿美元收购 Poseida 的交易最为瞩目。
Poseida 核心管线 P-BCMA-ALLO1 采用干细胞记忆型 T 细胞(Tscm,来源于外周血单个核细胞,半衰期超长),结合 Cas-CLOVER 基因编辑系统(易于操作、高精确度)。在已披露的多发性骨髓瘤 1 期临床中,患者客观缓解率(ORR)达 91%。罗氏可能看中的是其专有的基因编辑平台,包括设计、开发和制造富含同种异体 Tscm 的 CAR-T 疗法的全套非病毒技术。
2025 年 ASGCT 年会前瞻性研究显示,Poseida 在研异体 CAR-T 通过 DNA 转座子递送系统与 Cas-CLOVER 基因编辑技术,实现内源性 T 细胞受体敲除及β-2 微球蛋白部分缺失,GVHD 和 HVGR 发生率显著降低。
实体瘤与新靶点探索
当前 UCAR-T 管线仍以血液瘤为主,但实体瘤领域也在逐渐兴起。同时,除 BCMA、CD19 等经典靶点外,新兴靶点开发也呈现多元化趋势。本届 ASGCT 年会期间,南京奇迹生物科技有限公司首次披露 CHT102(靶向间皮素)治疗晚期胰腺癌的 1 期临床数据,这是靶向 MSLN 的 UCAR-T 疗法首次应用于胰腺癌等实体瘤的人体临床试验,并初步验证其良好的安全性、耐受性和抗肿瘤潜力。
CAR-NK 与体内 CAR-T 等新兴方向
随着 UCAR-T 技术的成熟,CAR-NK 领域热度持续攀升。不同于 T 细胞, NK 细胞无需 HLA 配型,异体排斥和 GVHD 发生率更低,且 NK 细胞来源广泛,因此更易实现「现货型」疗法。
另一新兴方向是体内 CAR-T(in vivo CAR-T),该技术结合了自体 CAR-T 的疗效优势与异体 CAR-T 的可及性,通过递送载体将基因编辑工具导入患者体内,直接实现 T 细胞原位 CAR 改造,规避了体外制备的复杂流程,具备「周期短、成本低、疗效佳」等潜在优势。
据不完全统计,全球已有数十家企业布局 in vivo CAR-T。国际代表企业包括 Umoja、Interius、Capstan 等,国内有济因生物、易慕峰、沙砾生物、嘉晨西海等,研发管线覆盖了血液瘤、实体瘤及自身免疫疾病等多个领域。递送载体主要分为以慢病毒为主的病毒载体和 LNP 为主的非病毒载体两大类。
天然免疫细胞疗法
天然免疫细胞疗法通过激活或改造固有免疫细胞(如 NK、NKT、γδT 细胞)实现抗肿瘤和抗病毒效应,其核心优势在于无需抗原致敏即可快速识别异常细胞,同时规避异体移植相关的 GVHD 风险。
NK 细胞是源于淋巴系的先天免疫细胞,其肿瘤杀伤机制多样,包括穿孔素/颗粒酶途径、死亡配体途径、细胞因子途径以及 ADCC 途径等。
ZMPB-NK006 是河北美欧赛奥金生物自主研发的同种异体单采血来源、非基因改造的 NK 细胞候选药物,于今年 3 月获批临床,拟用于治疗晚期实体瘤。该候选药物是通过特定的体外生产工艺,获得的一类具有高纯度、高表达活性受体的通用现货型 NK 细胞制剂,同时维持高水平表达颗粒酶、穿孔素、细胞因子分泌功能,展现出强大的抗肿瘤杀伤活性。
技术层面,基因编辑与联合疗法成为 NK 细胞改造的核心方向。NK510 是贝斯生物基于自主知识产权的 AccuBase ®碱基编辑技术研发的全球首个零脱靶碱基编辑 NK 细胞疗法。相较于传统的 CRISPR 技术,AccuBase ®系统通过单碱基定点转换实现精准编辑,避免 DNA 双链断裂风险,编辑效率超过 90% 且无脱靶效应。NK510 经逻辑门控重编程设计,可响应肿瘤相关抗原 (TAA) 信号并拮抗免疫抑制微环境。
NKT 细胞(自然杀伤 T 细胞)是兼具 T 细胞特异性识别与 NK 细胞天然杀伤功能的特殊 T 细胞亚群,其细胞毒作用机制与 NK 细胞类似。CAR-NKT 细胞疗法通过双重功能设计,既可以突破肿瘤免疫抑制微环境,又能维持长期免疫监视功能,为肿瘤持续控制提供了新策略。
动物模型研究显示,在高肿瘤负荷条件下,CAR-NKT 细胞可能出现耗竭,表现为 PD1 和 TIM3 的共表达上调。临床前研究表明,PD-1 抑制剂联用可显著增强 CAR-NKT 细胞的抗肿瘤活性;人工糖脂α-半乳糖神经酰胺激活的 NKT 细胞,与载药树突状细胞联用也可进一步放大 CAR-NKT 细胞的抗肿瘤效应。
γδT 细胞是 T 淋巴细胞中特有的一个亚群,其 TCR 由γ链和δ链组成,具有非 MHC 限制性抗原识别特征,可避免引发患者 GVHD。该细胞亚群通过分泌颗粒酶 B、穿孔素等细胞因子,发挥 1 型免疫应答介导的肿瘤杀伤作用,对感染细胞和肿瘤细胞均具有直接杀伤效应。
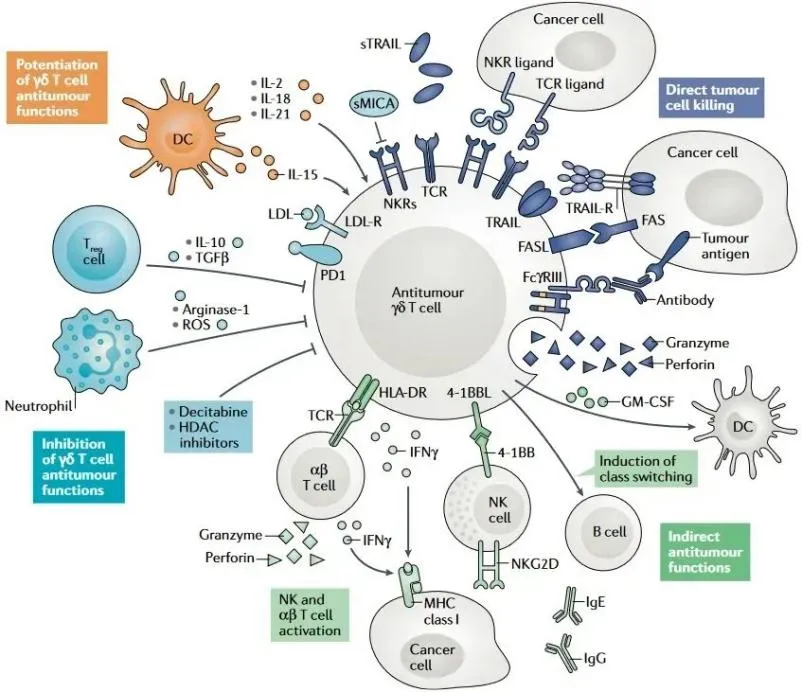
▲ 抗肿瘤γδ T 细胞的功能和调节机制
全球γδT 细胞治疗领域呈现多技术路线并进格局。其中,国外企业研发进展相对较快,国内布局企业包括森朗生物、清辉联诺、博生吉、上海细胞治疗集团、暨德康民等,多数管线处于临床前及早期临床阶段。
鉴于γδ T 细胞体外扩增效率瓶颈,临床开发主要采用基因工程改造策略。当前技术挑战集中在:提高肿瘤特异性识别和杀伤能力;降低正常组织靶向毒性;优化基因编辑安全性。现有基因编辑工具仍面临脱靶风险控制、编辑效率提升等技术难题。
5 月 16 日,清辉联诺宣布其靶向 B7 H3 异体通用型 CAR-γδ T 细胞注射液 QH104A 获 FDA 批准临床,拟用于治疗复发或进展性高级别胶质瘤。据公开资料介绍, 该候选产品采用双信号识别策略,通过γδ TCR-BTN-磷抗原信号通路识别肿瘤代谢异常产物;CAR 结构特异性识别肿瘤高表达抗原 B7 H3。这种双重靶向设计在机制上实现了肿瘤杀伤与正常组织保护的平衡。
2024 年 ESMO 年会上,QH104 治疗复发性胶质母细胞瘤的 1 期临床数据显示,7 例患者客观缓解率(ORR)为 42.9%,疾病控制率(DCR)为 100%,初步验证其临床转化潜力。
iPSC 衍生的免疫细胞疗法
iPSC 的分化潜能为其在免疫细胞治疗领域的应用提供了独特优势。通过体外定向诱导分化技术,其可高效生成各类免疫细胞,结合基因编辑技术敲除 HLA 等免疫原性基因,可解决免疫排斥反应的问题。
基于 iPSC 的多向分化能力,可构建多元化的通用型免疫细胞治疗平台,涵盖 iPSC-CAR-T、iPSC-CAR-NK 等多种创新疗法。这些经基因工程改造的免疫细胞不仅可规避宿主免疫排斥,还可以表达不同的治疗性蛋白,并且在需要时扩增制备「即用型」细胞制剂。
全球范围内,iPSC 衍生免疫细胞疗法领域已形成多极竞争格局。国际领军企业包括 Cynata、Fate、Century、Cytovia 等,国内代表企业则有中盛溯源、赛元生物、星奕昂、呈诺医学、启函生物、昕传生物等,大多管线也仍处早期临床阶段,适应症同样涉及血液瘤与实体瘤等领域。
今年 4 月,Fate 宣布其 iPSC 衍生 CAR-T 细胞疗法 FT819 获美国 FDA 授予再生医学先进疗法(RMAT)资格认定,用于治疗 SLE,包括狼疮性肾炎(LN)。值得关注的是,FT819 作为美国 FDA 批准临床的首个 iPSC 衍生 CAR-T 疗法,初始适应症为 CD19 阳性 B 细胞肿瘤,此次自免领域适应症扩展标志着该平台技术向着非肿瘤领域的延伸。该公司另一款 CD19 CAR-iNK 疗法 FT522 亦同步推进 B 细胞淋巴瘤及自身免疫疾病适应症开发。
除了具有较为广泛的适应症外,FT819 的安全性也得到了升级。其通过基因工程改造,确保了 T 细胞表面的 TCR 被完全去除,从而可大大降低发生 GvHD 的风险。
回看国内市场,我国在 iPSC 衍生的免疫细胞疗法领域的研发势头丝毫不弱于国外,且技术路径呈现鲜明的差异化特征。启函生物、中盛溯源等企业聚焦 iNK 及 CAR-iNK 开发,赛元生物则另辟蹊径选择布局 CAR-iM。这种多技术路线并行的战略布局,体现了国内企业在这一领域的自主创新探索。
结语
在自体细胞疗法已验证卓越疗效但可及性受限的背景下,通用型细胞治疗技术正成为突破治疗瓶颈的关键方向。无论是针对血液系统肿瘤、实体瘤还是自身免疫疾病,通用型细胞疗法已然展现出重塑治疗范式的潜力。
尽管全球尚未有同类产品获批上市,且多数在研管线仍处于早期临床阶段,但不断积累的临床数据展现出其潜在的广阔应用前景。未来,通用型细胞疗法还需要通过更多严谨的临床试验验证其长期疗效与安全性,而中国创新力量在这一前沿领域的深度参与,或将为中国乃至全球患者带来更具可及性的治疗选择。

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-11-06
2025-11-06
 3
3

 产业资讯
产业资讯
 药圈头条
药圈头条  2025-11-06
2025-11-06
 4
4

 产业资讯
产业资讯
 氨基观察
氨基观察  2025-11-06
2025-11-06
 4
4