 产业资讯
产业资讯
 新药前沿
新药前沿  2022-11-30
2022-11-30
 2746
2746
由于药物开发过程中的许多障碍,获批的孤儿药名单有限。一项研究显示,截止2015年欧盟共批准了133种孤儿药,涵盖179种罕见疾病。与此同时,在美国,415种孤儿药(涵盖521种罕见病)已获批准。
相比之下,EMA和FDA批准的孤儿药只有一小部分在中国获批。例如,2018年有研究者统计,在FDA批准的60种孤儿药中,只有27种在中国获得批准。同样,在EMA批准的27个孤儿药中,有8个是在中国获得批准的。药物开发的一个关键阶段是进行临床试验。
值得注意的是,由于临床试验设计、患者招募、监管挑战等多重挑战,罕见病的临床试验更加难以实施。近年来,关于罕见病临床试验的现状和趋势的研究已经引起越来越多的关注。关于罕见病的研究大多基于数据库,如ClinicalTrials.gov注册中心和欧盟临床试验注册中心。
但在中国,基于官方数据库的罕见病临床试验分析却很少。重庆医科大学药学院郑航(Hang Zheng)博士等研究者通过基于中国官方平台的具体数据分析,探讨中国罕见病临床试验的现状和趋势,为改善孤儿药的临床开发、识别未满足的临床需求提供启示,为政策制定者和其他利益相关者提供必要的支持性数据,相关研究结果发表在《罕见病杂志》。
通过对2013年1月1日至2021年12月31日CDE药物临床试验登记和信息公示平台(DCTIRP,http://www.chinadrugtrials.org.cn)的孤儿药临床试验数据分析发现,具有以下趋势:
启动试验的时间趋势
总体而言,从2013年到2021年,孤儿药的年度临床试验数量呈上升趋势,平均年增长率为61%。值得注意的是,2021年的临床试验数量明显增加,与2020年的数量相比,增加了70%。从2018年到2021年,I期和II期临床试验的总数呈现稳步增长,年增长率为87%。BE的数量逐渐减少,从2018年到2020年平均每年变化31%。但2021年BE的数量明显上升,与2020年的数量相比,增长了180%。
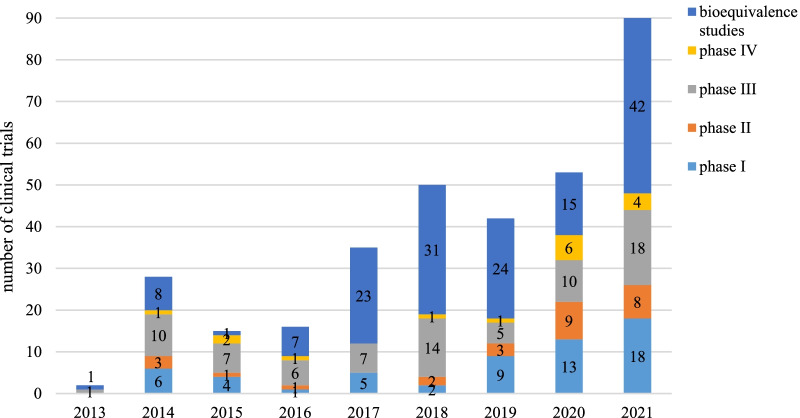
图1 按研究阶段划分孤儿药临床试验年度数量试验药物的时间趋势
2013年至2021年,有124种药物接受了临床试验。在测试的124种药物中,82种(66%)是化学药物,42种(34%)是生物制品。测试的药物数量逐年增加,平均每年大幅增加53%(P = 0.0025)。从2019年到2021年,化学药物的数量逐渐增加,平均每年增加47%。而生物制品的数量逐渐增加,平均每年变化53%。此外,与2020年相比,2021年化学药品和生物制品的数量分别增加了44%和40%。
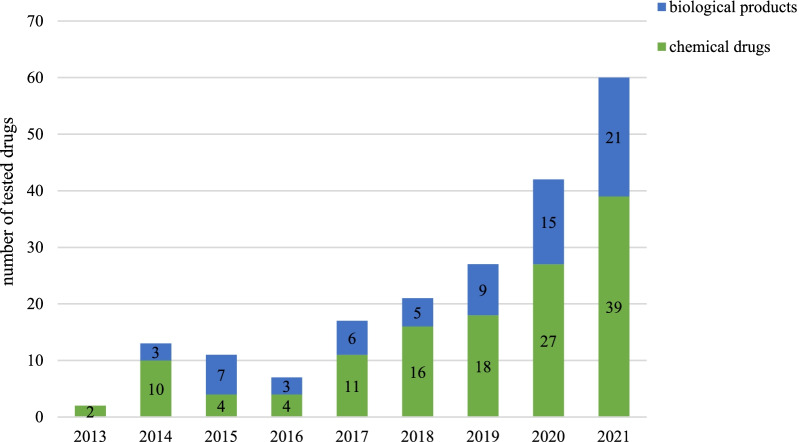
图2 按药物类型划分的年度试验药物数量注册临床试验中的罕见疾病类型
331项孤儿药的临床试验涵盖了《中国第一批罕见病目录》的31种罕见疾病。在这31种罕见病中,有5种分别有20项以上的试验。帕金森病(年轻发病,早期发病)是最常见的罕见病,有86项(26%)试验,其次是血友病(70,21%)、纯合子家族性高胆固醇血症(60,18%)、特发性肺纤维化(40,12%)和多发性硬化症(23,7%)。其余26种罕见病的试验数量各不超过10项。
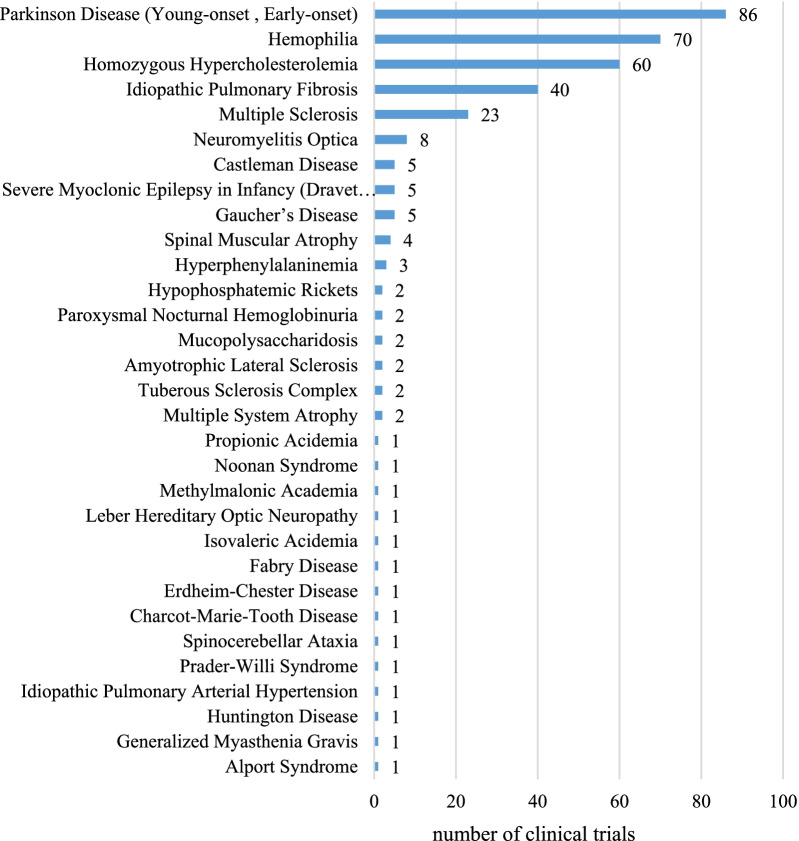
图3 不同罕见病的临床试验数量参与机构的地理分布
2013年至2021年,中国共有281家临床试验单位作为孤儿药的临床试验基地,覆盖32个省级行政区域。北京的临床试验单位数量最多(29,10%),其次是上海(23,8%)、江苏(22,8%)和广东(21,7%)。总的来说,华东地区的孤儿药临床试验单位数量最多(90家,32%),其次是华北地区(52家,19%)和华南地区(48家,17%)。中国西北地区(18,6%)和东北地区(18,6%)的临床试验单位数量最少。就进行临床试验的数量而言,北京的单位数量最多(254,17%),其次是上海(110,7%)和广东(105,7%)的单位。一致的是,华东地区的单位进行的临床试验数量也最多(456个,31%),其次是华北地区(400个,27%)。单位开展的临床试验数量最少的是西北地区(77,5%)和东北地区(67,5%)。
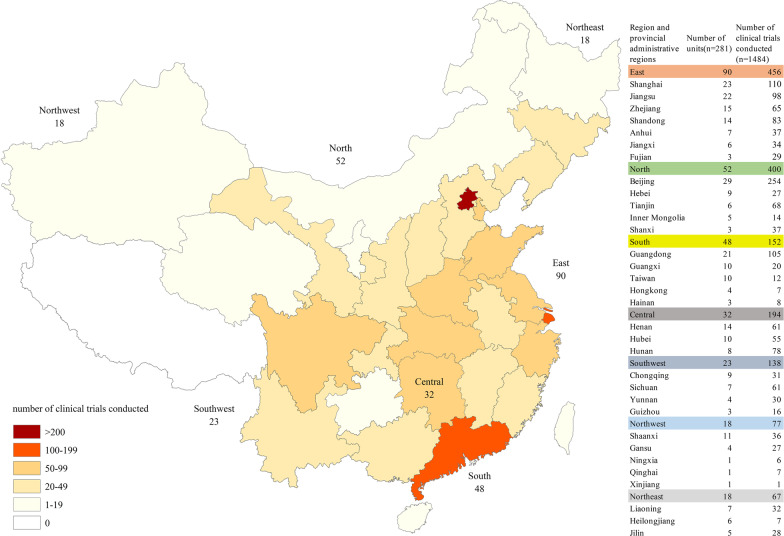
图4 罕见病临床试验单位的地理分布情况
由此可见,我国目前罕见病药物开发存在针对疾病分布不平衡,缺乏创新等问题。未来,应更加关注一些罕见病未被满足的需求以及这些疾病的药物开发。
参考资料:[1] Xiang Z, Jiang W, Yan B, Jiang J, Zheng H. Current status and trend of clinical development of orphan drugs in China. Orphanet J Rare Dis. 2022 Jul 27;17(1):294. doi: 10.1186/s13023-022-02440-4. PMID: 35897012; PMCID: PMC9327367.

 产业资讯
产业资讯
 UmabsDB
UmabsDB  2025-06-23
2025-06-23
 48
48

 产业资讯
产业资讯
 支点财经
支点财经  2025-06-23
2025-06-23
 49
49

 产业资讯
产业资讯
 药视声
药视声  2025-06-23
2025-06-23
 51
51