 产业资讯
产业资讯
 GBIHealth
GBIHealth  2022-12-15
2022-12-15
 2662
2662
近期,随着国内疫情防控政策的调整,各类新冠药物再次成为大众关注的焦点,前有3天内4款国产新冠疫苗获准紧急使用,后有石药、歌礼、广生堂等旗下小分子口服药物取得最新进展。此外,昨日晚间,据界面新闻,多个互联网平台已经开始、或即将放开销售辉瑞Paxlovid以及真实生物阿兹夫定,定价分别为2980元/盒和330元/瓶(1mg*35片)。国内新冠赛道持续升温,“入局者”们的激烈竞速一触即发。
布局新冠赛道的国内企业有哪些?
疫苗/治疗类药物获批情况和研发进展如何?
哪些在研产品值得重点关注?
疫苗:13款国产可选择,近20款临床中
根据世界卫生组织(WHO)数据,截至2022年12月6日,全球在研新冠疫苗175个,处于临床前阶段的199个。处于临床阶段的疫苗中,蛋白亚单位(Protein subunit)、RNA类疫苗占比较高。聚焦国内市场,目前布局新冠疫苗领域的企业超过20家,产品技术路径主要集中在灭活疫苗、腺病毒载体疫苗、mRNA疫苗、重组蛋白疫苗等。
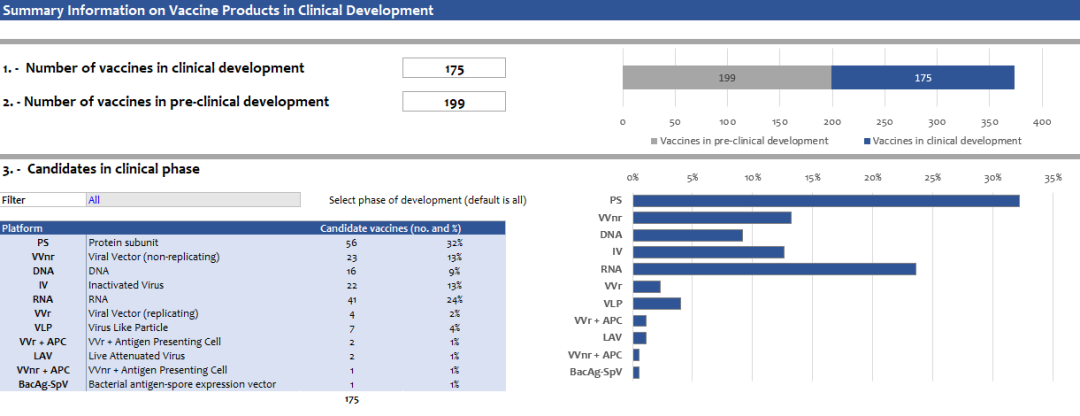
来源:https://www.who.int/
累计13款国产疫苗可选择
据GBI统计,目前国内已经有13款新冠疫苗获得国家药监局批准附条件上市或纳入紧急使用,包含11个注射式、1个吸入式以及1个鼻喷式疫苗(详见表1)。
表1. 国内获批上市或纳入紧急使用的新冠疫苗
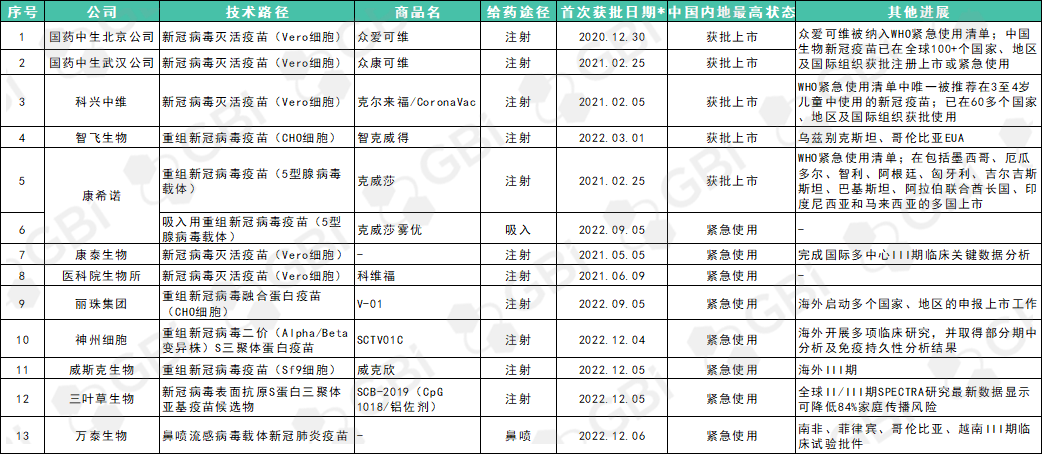
*首次获批日期不计军队特批时间 来源:GBI 整理
其中,国药中生北京公司新冠灭活疫苗、科兴中维新冠灭活疫苗以及康希诺重组新冠病毒疫苗(5型腺病毒载体)被列入WHO紧急使用清单(EUL)。科兴中维克尔来福/CoronaVac是WHO EUL中唯一被推荐在3至4岁儿童中使用的新冠疫苗。
13个疫苗中有8个是纳入紧急使用。其中神州细胞SCTV01C、威斯克生物威克欣、三叶草生物SCB-2019(CpG 1018/铝佐剂),以及万泰生物鼻喷流感病毒载体新冠肺炎疫苗在2022年12月4至6号三天内,接连在中国被纳入紧急使用。
GBI既往报道,SCTV01C是神州细胞针对新冠病毒变异快、以原始株为基础的国内外第一代疫苗对变异株中和抗体滴度和保护率下降等问题自主研发的新一代二价变异株重组蛋白疫苗,临床上拟用于预防新型冠状病毒感染所致疾病;威克欣是中国首个获批紧急使用的、由昆虫细胞技术平台生产的重组蛋白新型冠状病毒疫苗;三叶草SCB-2019(CpG 1018/铝佐剂)在全球II/III期SPECTRA研究最新数据显示可降低84%家庭传播风险;万泰生物鼻喷流感病毒载体新冠疫苗采用鼻腔喷雾剂给药,其模仿呼吸道病毒的自然感染途径,以激活局部和全身免疫反应,在病毒进入人体后更快地发挥作用。
另外值得关注的是,上述大部分产品都在海外多国获得紧急使用授权或处于临床后期阶段。
近20款I-III期临床,mRNA疫苗受瞩目
除了已经获批上市或纳入紧急使用的疫苗外,据GBI统计,目前还有近20个国产疫苗产品处于临床研发阶段(详见表2)。
表2. 国产在研新冠新苗情况
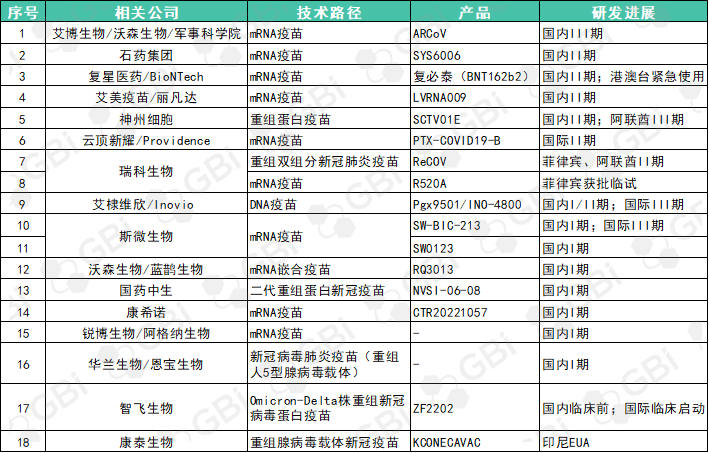
来源:GBI 整理
在临床阶段的产品中,mRNA疫苗数量过半。目前中国大陆暂无mRNA疫苗获批上市,国内聚焦此领域的企业中,有十余家旗下药物进入临床阶段,其中进展较快的有艾博生物/沃森生物/军事科学院的ARCoV,处于国内III期阶段;艾美疫苗/丽凡达的LVRNA009和云顶新耀/Providence的PTX-COVID19-B分别在国内和海外推进到临床II期;石药集团的SYS6006的I、II期临床试验及序贯加强免疫的临床研究报告均已上交CDE;复星医药/BioNTech的复必泰(BNT162b2)已在港澳台三地获紧急使用授权,其在中国内地的II期临床试验结束,上市审批工作仍在积极沟通中。此外,还有瑞科生物、斯微生物、康希诺等企业旗下mRNA疫苗处于临床早期阶段。
小分子药物:1款国产获批上市,20+布局临床
关注新冠小分子口服药物,目前全球两大“领头羊”为默沙东和辉瑞。2021年11月,默沙东的莫努匹拉韦(Molnupiravir)在英国获批上市,成为全球首个获批用于治疗成人轻度至中度COVID-19的口服抗病毒药物。据GBI全球药品价格数据,莫努匹拉韦的售价为700美元/盒,即18美元/片。辉瑞旗下新冠口服药Paxlovid(奈玛特韦片/利托那韦片)已在包括中国在内的约70个市场获批上市、有条件批准上市,或紧急使用授权。
聚焦国内市场,首个获批的国产新冠小分子药物为真实生物旗下阿兹夫定。该产品是我国自主研发的口服小分子药物,分别于2021年7月和2022年7月获批HIV和COVID-19适应证,复星医药拥有该药部分区域的独家商业权益。2022年8月,国家卫健委和中医药局发布通知,将阿兹夫定片纳入《新型冠状病毒肺炎诊疗方案(第九版)》。
相比于新冠中和抗体,小分子口服药具有生产成本低、储运条件易满足、服用方便、病人顺应性好等优势。诸多优点与广阔的市场空间也引得国内企业积极入局,加速推进海内外研发进程(详见表3)。
表3. 国内企业在研/已上市新冠小分子药物
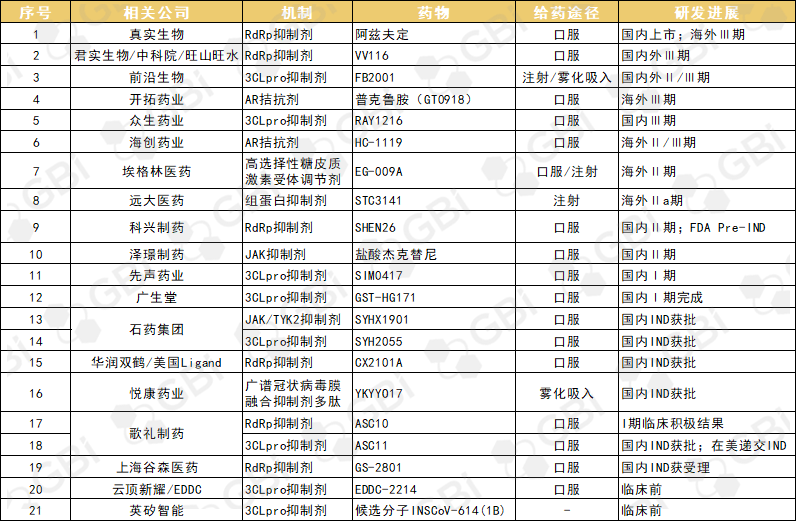
来源:GBI 整理
在研药物中,进展较快的为君实生物/中科院/旺山旺水的VV116,目前已在国内完成一项III期临试,多项国际多中心的III期临试进行中;前沿生物的FB2001注射剂和雾化吸入剂分别在海外和国内推进至II/III期;开拓药业的普克鲁胺正在进行用于轻中症非住院新冠患者的III期全球多中心临床试验和一项用于重症住院新冠患者的III期全球多中心临床试验;众生药业的RAY1216已启动新冠治疗III期临试。
此外,海创药业、埃格林医药、远大医药、科兴制药、泽璟制药旗下新冠小分子药物均处于临床II期。另外还有先声药业、广生堂、石药集团、歌礼制药等企业在加速推进相关药物的研发进程。
抗体类:1款国产上市,I/II期临床居多
关注新冠抗体类药物,目前国内只有腾盛博药新冠病毒中和抗体联合治疗药物安巴韦单抗/罗米司韦单抗(BRII-196/BRII-198)获批上市,其余药物大多处于国内外临床早期阶段(详见表4)。
表4. 国内企业在研/已上市新冠抗体类药物
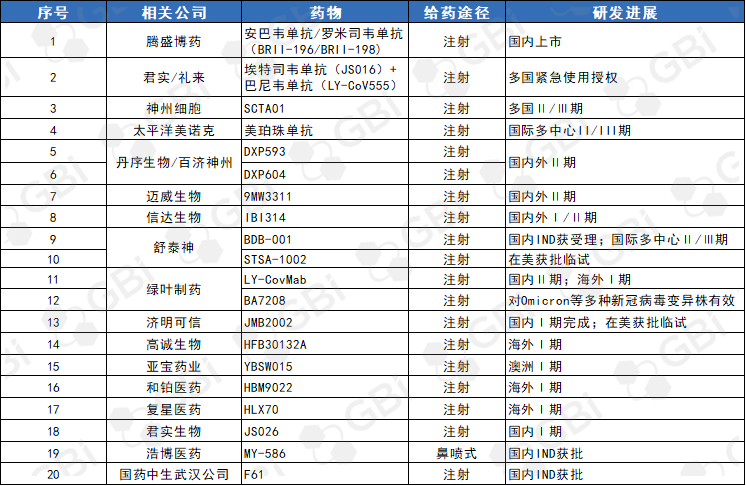
来源:GBI 整理
GBI既往报道,礼来制药此前已获得君实生物埃特司韦单抗(JS016)在大中华区以外地区的权益,2021年埃特司韦单抗和巴尼韦单抗联合的双抗体疗法在全球超过15个国家和地区获得紧急使用授权,用于治疗COVID-19患者。其余进展较快的新冠中和抗体包括:神州细胞SCTA01、丹序生物/百济神州的DXP-604和DXP-593、迈威生物9MW3311、绿叶制药LY-CovMab、信达生物IBI314、济明可信JMB2002、以及舒泰神BDB-001。
新冠抗原测试剂:累计42款获批上市
除了疫苗与治疗类药物外,新冠抗原测试剂也在加速获批中。12月8日,国家药监局发布《关于延长新冠病毒抗原检测试剂注册证有效期的公告》,将已获准注册的新冠病毒抗原检测试剂的注册证有效期,在原有效期基础上延长6个月,以切实保障相关产品市场供应。
12月11日,国家药监局宣布批准佰奥达生物科技(武汉)股份有限公司、基蛋生物科技股份有限公司、泰普生物科学(中国)有限公司、中山生物工程有限公司的新冠抗原检测试剂上市。12月12日,郑州安图生物工程股份有限公司、厦门为正生物科技股份有限公司的新冠抗原检测试剂获批上市。据GBI DEVINT医疗器械数据库,目前我国已上市的新冠抗原检测产品多达42款。
随着疫情防控政策的不断调整,未来对于新冠预防和治疗类药物的需求或将大大增加。我们期待研发进展较快的药物早日获批上市,也将持续追踪其他“入局者”们以及旗下药物的最新进展。

 产业资讯
产业资讯
 E药经理人
E药经理人  2025-07-16
2025-07-16
 48
48

 产业资讯
产业资讯
 识林
识林  2025-07-16
2025-07-16
 52
52

 产业资讯
产业资讯
 胖猫的生命科学札记
胖猫的生命科学札记  2025-07-16
2025-07-16
 45
45