 产业资讯
产业资讯
 识林
识林  2025-07-16
2025-07-16
 477
477
*图片来自网络,仅作示意用。
7月10日,IQVIA在其《美国药品短缺和ANDA批准趋势》(Trends in Drug Shortages and ANDA Approvals in the U.S.)报告中指出美国药品短缺的背景却是大量已获批ANDA(简化新药申请,即仿制药申请)未能上市。
美国医疗体系长期面临药品短缺问题,截至2024年6月,FDA报告称有102种药品处于活跃短缺状态,其中超过一半的短缺持续时间超过两年。这些短缺药品主要集中在疼痛管理和肿瘤治疗领域,且以注射剂形式为主。仿制药作为保障平价医疗的关键药品,占据了短缺药品的84%。
短缺不能归因于FDA不批。2013年至2024年第一季度期间,37%的获批仿制药尚未上市,且通常需要超过四年时间才有70%的仿制药能够进入市场。在当前短缺药品中,62%已有获批的仿制药,但其中84%至少有一个已获批但未上市的产品,21%的品种的已获批仿制药完全没有上市。注射剂受影响尤为严重,在短缺药品中,75%涉及未上市的仿制注射剂。
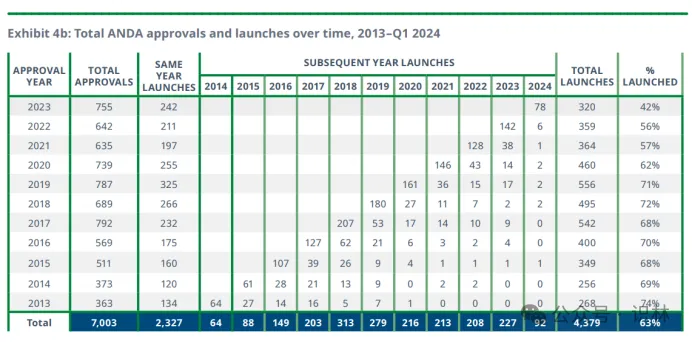
在分析获批ANDA的仿制药上市时间线时发现(见上图),尽管获得FDA批准,但许多仿制药在进入市场之前存在显著延迟。获批当年和次年集中上市之后,药企动力似乎耗尽,数量断崖式下跌,致使相当一部分药品在获批多年后仍未上市。平均而言,在获批两年后,仍有超过200种获批ANDA的仿制药未上市。
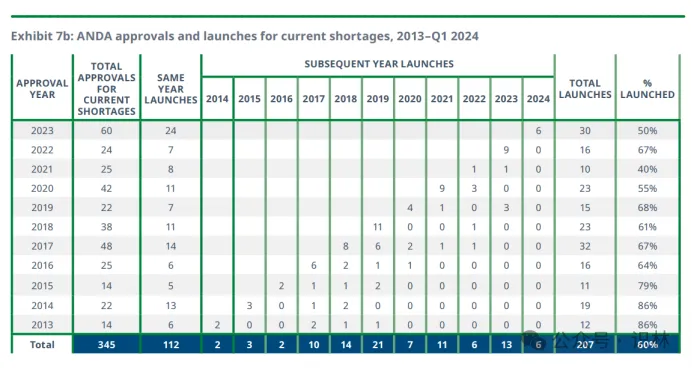
从上图则可以看出,即使是存在于现行短缺药清单中的药物,情况仍无改观,获批当年和次年是上市高峰,其后几乎无人问津。这意味着短缺清单对于仿制药上市的激励有限,药企在辛苦拿到ANDA批件后也可能找不到动力或路径让药品上市,从而真正弥补短缺。
报告还显示,公司规模也影响药品上市行为。2013年以来,超过一半(3618/7003)的仿制药批准来自微型仿制药公司(年全球销售额低于5亿美元),其上市仿制药的可能性高于更大型的公司,同时也更积极地响应短缺。
获批却不上市,企业必然是面临痛苦抉择。报告指出启动成本、市场动态、定价压力以及短缺持续时间的不确定性等经济和运营障碍,阻碍了药企推出获批的仿制药。尤其是对于注射剂,市场进入风险和成本双高,挑战尤为突出。
无独有偶,生物类似药面临相似局面。三星Bioepis一份报告显示,FDA批准的生物类似药中,还有三分之一未能在美国市场上市。生物类似药要做临床可比性研究(在美国还要做可转换研究),开发成本远高于许多小分子化学仿制药。即便如此,已获批药品却因为种种原因无法上市,而那些上市的生物类似药也并未如业界所期望的那样显著拉低用药成本,更未能出现化药仿制药上市带来的所谓“专利悬崖”现象。
拿下ANDA或BLA且零483通过检查绝非终点,以上情形均提示我国仿制药和生物类似药出海企业提早关注市场挑战。

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 641
641

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 650
650

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 619
619