 研发追踪
研发追踪
 2016-12-21
2016-12-21
 6716
6716
来源:药明康德 2016-12-21
近日,总部位于美国纽约的生物技术公司Tonix Pharmaceuticals宣布,针对创伤后应激障碍(Post Traumatic Stress Disorder, PTSD)的在研新药TNX-102 SL,获得了FDA突破性疗法认定。公司计划在2017年开始两项3期临床试验。
PTSD是指患者在遭遇重大创伤性事件后,包括目击他人死亡、目击或遭受重伤、或受到严重威胁后,出现的持续性精神障碍。PTSD的主要症状包括反复在思维或噩梦中回顾所遭遇的创伤性事件、麻木或情感疏离、焦虑或暴躁易怒等等。PTSD通常在创伤性事件后数天到数个月内发病,病程可能长达数年甚至数十年,严重影响患者的正常生活。目前,PTSD并没有针对性的药物治疗,临床上通常使用抗抑郁或抗精神病药结合心理治疗。
Tonix Pharmaceuticals的在研新药TNX-102 SL是一种新型舌下含片,其有效成分为环苯扎林(cyclobenzaprine)。 该药的口服片目前被用于治疗肌肉痉挛以及由此引发的疼痛。
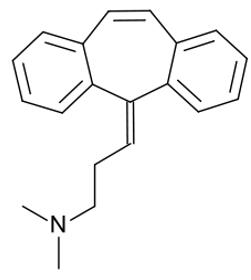
▲Cyclobenzaprine分子结构(图片来源:维基百科)
Tonix公司发现,该药对于多个与睡眠和精神障碍相关神经递质通路都能产生影响。它通过抑制血清素受体2A,可以增加慢波睡眠,也就是深度睡眠的时间,并能减少醒来时回顾创伤性事件的可能性;通过抑制α-1肾上腺素受体,可以减少与创伤性事件相关的噩梦产生以及由此打断睡眠的可能性;通过抑制组胺受体1,可以减少快速动眼睡眠期间大脑承受的压力。基于这些研究,Tonix开发了低剂量的cyclobenzaprine舌下含片TNX-102 SL,每天睡前含服,可以快速将药物送往大脑,以改进PTSD患者睡眠,并减少清醒时的症状。
在今年早些时候完成的2期临床试验中,TNX-102 SL在军人PTSD患者中显着地改善了多项PTSD临床评估标准的表现,减少了患者自杀或自残的倾向,改善了睡眠质量,减少了从噩梦中惊醒的次数。基于这些数据,FDA授予了该药突破性疗法认定。Tonix计划于2017年一季度展开在军人PTSD患者中的关键性3期临床试验,以及在下半年展开在平民PTSD患者中的关键性3期临床试验。
Tonix总裁兼首席执行官Seth Lederman博士表示:“我们很高兴FDA授予TNX-102 SL突破性疗法认定。这项决定反映出了FDA对PTSD作为一种严重疾病的承认,以及TNX-102 SL在2期临床试验中展现的相比起现有药物的优势。在准备3期临床试验时,我们期待突破性疗法认定能帮助加快该药的开发和审批。 我们致力于尽快为PTSD患者,尤其是军人患者,带来更好的疗法。”

 研发追踪
研发追踪
 药时代
药时代  2026-02-13
2026-02-13
 194
194

 研发追踪
研发追踪
 医药魔方
医药魔方  2026-02-13
2026-02-13
 190
190

 研发追踪
研发追踪
 瞪羚社
瞪羚社  2026-02-13
2026-02-13
 174
174