 产业资讯
产业资讯
 生辉
生辉  2022-12-22
2022-12-22
 3288
3288
美国东部时间 12 月 19 日,生物医药公司 Madrigal Pharmaceuticals 宣布,其在研药物 Resmetirom 在治疗非酒精性脂肪性肝炎(NASH)的临床 Ⅲ 期试验结果积极,主要终点和关键次要终点均已达成,而这两个终点是 FDA 认为能够预测患者临床获益性以及用来支持加速药物批准的重要指标。

▲图|Madrigal Pharmaceuticals 公布的临床试验结果(来源:公司官网)
基于药物较好的疗效以及安全性,该公司表示计划将在 2023 年上半年递交新药申请并同时寻求该药物快速批准。值得注意的是,如果获得批准,Resmetirom 将成为全球首款上市的非酒精性脂肪性肝炎治疗药物。
随着这一消息的公布,Madrigal Pharmaceuticals 公司股价大幅增长,截止目前,该公司股价涨幅已超 268%,达 234.83 美元,公司总市值达到 40.15 亿美元。
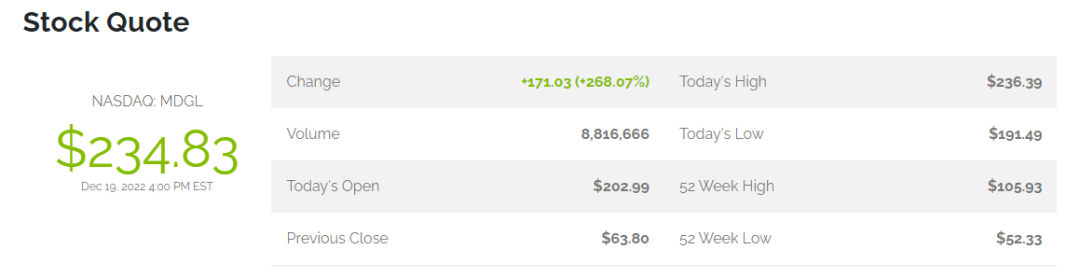
▲图|Madrigal Pharmaceuticals 股价(来源:公司官网)
达成两项终点,计划明年递交新药申请和加速审批
作为一种较为常见的慢性肝病,非酒精性脂肪性肝炎(Non-alcoholic Steatohepatitis,NASH)是指除了酒精以及其他明确的肝脏损害的因素以外而导致的肝脏内脂肪过度沉积。NASH 的发生可能是由环境、遗传、饮食和代谢等因素相互作用的结果,其组织病理学改变包括脂肪酸堆积、线粒体功能障碍、自由基的产生、氧应激、脂质过氧化和内毒素介导的细胞因子释放等。
在全球范围,目前已经有超 1 亿例 NASH 患者,仅在美国就有 2200 万人患有 NASH,其中 800 万人患有伴有严重肝纤维化的 NASH。先前的研究发现 NASH 是非酒精性脂肪性肝病(NAFLD)发展为肝硬化、肝细胞肝癌、肝衰竭等终末期肝病的重要环节,若不进行早期干预治疗约有 10%~20% 的单纯性脂肪肝将会恶化为 NASH。统计数据显示,NAFLD 患者随访 10-20 年发展为肝硬化的概率为 0.6%-3%,而 NASH 患者 10-15 年内发展为肝硬化的概率高达 15%-25%,因此 NASH 的早期治疗显得格外重要。
然而多年以来,包括吉利德、阿斯利康和葛兰素史克等在内的许多生物医药公司一直试图将 NASH 治疗药物推向市场,但迄今为止仍然没有药物获批。
据公司官网介绍,Resmetirom 药物是 Madrigal Pharmaceuticals 公司开发的一种靶向肝脏的甲状腺激素受体 β(THR-β)口服选择性激动剂。
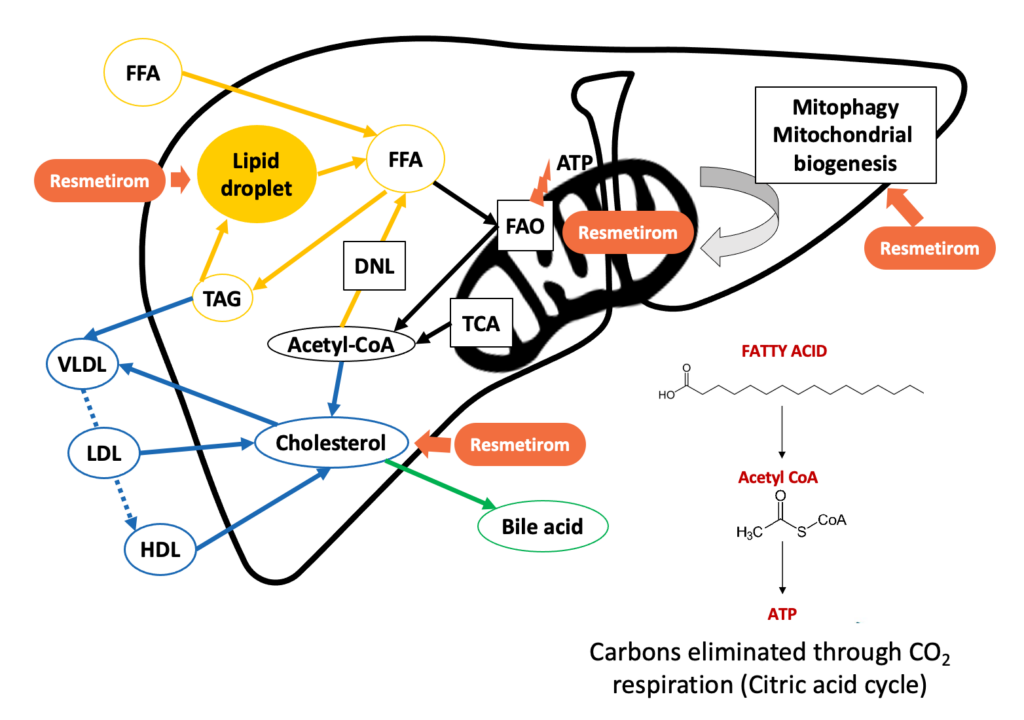
▲图|Resmetirom 药物的作用机制(来源:公司官网)
甲状腺激素通过激活肝脏细胞中的 β 受体在肝脏功能中发挥核心作用,比如维持血清胆固醇和甘油三酯水平等。THR-β 是维持正常肝脏功能的关键,包括调节线粒体活性(例如肝脏脂肪分解)以及控制正常、健康的线粒体水平,而在 NASH 患者中,肝脏中 THR-β 受体活性水平降低。因此为了优化 THR-β 通路在肝病治疗中的有效性,至关重要的一点是要保持 THR-α 受体活性。
据了解,Madrigal Pharmaceuticals 针对 Resmetirom 设计了四项 Ⅲ 期临床试验,分别为 MAESTRO-NASH、MAESTRO-NASH-OUTCOMES、MAESTRO-NAFLD-1 和 MAESTRO-NAFLD-OLE,用来研究该药物治疗 NASH 的有效性和安全性。
其中,MAESTRO-NASH 试验针对非酒精性脂肪性肝炎(NASH)患者,以非肝硬化 NASH 患者症状缓解的同时在 52 周内无纤维化恶化作为首要评估终点;而 MAESTRO-NAFLD-1 试验针对非酒精性脂肪性肝病(NAFLD)患者,以安全性作为主要的研究终点。
据公司官网介绍,MAESTRO-NASH 是一项多中心、随机、双盲、安慰剂对照的 Ⅲ 期临床试验。该研究于 2019 年 3 月开始启动,共招募了 966 位符合条件的 NASH 患者,所有患者被随机分配,分别接受每日口服 80 mg、100 mg 的 Resmetirom 药物或安慰剂进行治疗,患者分别在基线和治疗 52 周时进行肝脏组织活检评估。
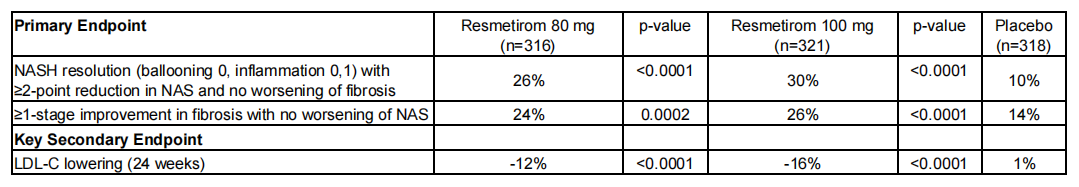
▲图| MAESTRO-NASH 临床 Ⅲ 期试验疗效分析(来源:公司官网)
试验数据显示,相较于安慰剂组,服用两种剂量的 Resmetirom 药物的患者均达到两项终点:患者拥有更高的 NASH 症状缓解水平和肝脏纤维化改善水平,达到非酒精性脂肪性肝病活动评分(NAS)下降的主要终点,同时也实现了低密度脂蛋白胆固醇水平(LDL)下降,达到关键次要终点。除此之外,基于 MAESTRO-NAFLD-1 临床试验的研究数据显示,Resmetirom 是安全的且耐受性良好的,并且在肝脏和心血管健康的关键指标方面拥有统计学上显著的改善。
“这些关键的 Ⅲ 期临床试验结果表明,Resmetirom 药物有可能帮助患者改善导致该疾病的潜在脂肪性肝炎以及与肝硬化及其并发症相关的纤维化,同时临床试验的顶线数据也增强了我们对 Resmetirom 安全性和耐受性的信心。我们相信,临床试验将为下一步的新药申请和 Resmetirom 治疗非肝硬化 NASH 伴肝纤维化的加速获批打下坚实基础。”Madrigal Pharmaceuticals 公司创始人、首席医疗官兼研发总裁 Rebecca Taub 博士表示。

▲图|Madrigal Pharmaceuticals 公司创始人、首席医疗官兼研发总裁 Rebecca Taub 博士(来源:公司官网)
Rebecca Taub 在领导药物开发方面拥有 20 多年的经验,在加入 Madrigal Pharmaceuticals 公司之前,她还曾担任 VIA Pharmaceuticals 公司研发高级副总裁、罗氏公司代谢疾病研究副总裁以及百时美施贵宝和杜邦制药公司的领导职务。在学术界,她于耶鲁大学医学院获得医学博士学位,目前她是宾夕法尼亚大学遗传学与医学的终身教授,曾在哈佛大学哈佛医学院乔斯林糖尿病中心的助理教授和霍华德休斯医学研究所的副研究员。
Madrigal Pharmaceuticals 公司董事长兼首席执行官 Paul Friedman 博士表示,“MAESTRO-NASH 实现了 FDA 提出的能够预测临床疗效的两个主要终点,这些明确的积极的第 Ⅲ 阶段数据表明我们的前进道路是明确的。我们打算在明年上半年提交一份新药申请以加快 Resmetirom 的批准,为全球更多患者提供这种新的治疗方法。”
“由于至今仍然没有得到批准的治疗方法,NASH 伴肝纤维化代表了当今医疗保健中最迫切的未满足需求之一,该疾病可能会使患者面临进展为肝衰竭、肝癌、需要肝移植以及死亡风险。MAESTRO-NASH 临床 Ⅲ 期试验的这些前所未有的结果标志着该领域的一个重大转折点。”临床研究负责人、牛津大学拉德克利夫医学院的肝病学客座教授 Stephen Harrison 博士表示。
针对 NASH 的药物开发之路道阻且长
据悉,Madrigal Pharmaceuticals 成立于 2011 年,总部位于宾夕法尼亚州,是一家临床阶段的生物医药公司,主要开发解决心血管和代谢性疾病领域未满足临床需求的小分子药物,现阶段该公司专注于为非酒精性脂肪性肝炎开发新的治疗药物。
公开资料显示,自成立以来 Madrigal Pharmaceuticals 公司共完成了 4 轮融资,融资金额为 2.884 亿美元,其中,最近的一次融资是今年 5 月,融资金额为 2.5 亿美元,投资机构为 Hercules Capital。2013 年,Madrigal Pharmaceuticals 公司在纳斯达克上市,股票交易代码为 MDGL。
随着 Madrigal Pharmaceuticals 公司临床试验结果的公布以及股价的暴涨,包括 89bio、Intercept Pharmaceuticals、Akero Therapeutics 和 Viking Therapeutics 等很多 NASH 治疗药物开发商的股票也受到影响。以 89bio 和 Intercept Pharmaceuticals 为例,两家公司股票跌幅分别达 6.54% 和 23.47%。
值得一提的是,近日 89bio 公司也公布了其候选药物 Pegozafermin 治疗 NASH 的 1b/2a 期概念验证研究结果。数据显示,与安慰剂相比,每周或每两周对患者进行给药,在第 13 周时将近 88% 的患者的肝脏脂肪分数减少将近 30%,肝脏脂肪分数的绝对减少量具有统计学意义,表明减缓了肝脏纤维化发展,与此同时,Pegozafermin 还能改善患者的肝脏转氨酶(评估肝脏损伤)、纤维化和脂质标志物。除此之外,Pegozafermin 药物在这项研究中的耐受性表现良好,未观察到与治疗相关的严重不良事件。
89bio 公司指称 Pegozafermin 有望具有成为针对 NASH 的“best-in-class”治疗药物的潜力,并计划在 2023 年上半年推进该药物治疗严重性高甘油三酯血症患者的临床 Ⅲ 期试验。
据了解,Pegozafermin 是一种糖基聚乙二醇化的成纤维细胞生长因子 21 类似物,能够用来治疗严重性高甘油三酯血症(SHTG)和 NASH。成纤维细胞生长因子 21 一种调节能量消耗和糖脂代谢的内源性代谢激素,89bio 公司采用专有的糖聚乙二醇化技术进行工程设计,可延长成纤维细胞生长因子 21 的生物活性并保持其功效。
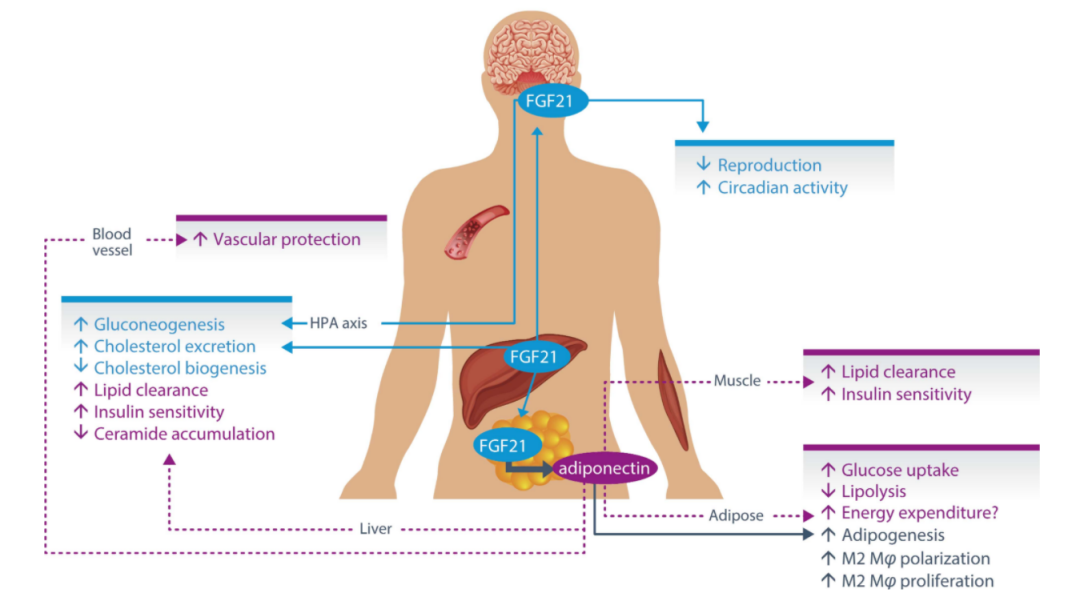
▲图|Pegozafermin 药物作用机制(来源:公司官网)
就在前不久,Intercept Pharmaceuticals 开发的 NASH 治疗药物奥贝胆酸(Obeticholic acid)在治疗 NASH 临床 Ⅲ 期试验获得了积极结果。据了解,奥贝胆酸是一种获批的用于治疗原发性胆汁胆管炎的口服药物,也是表达在肠道与肝脏上的法尼醇 X 受体(FXR)的激动剂。

▲图|Intercept Pharmaceuticals 公司在研管线(来源:公司官网)
基于临床试验的积极结果,该公司计划申请批准奥贝胆酸用来治疗 NASH 引起的肝纤维化,然而,最终 FDA 以“预测临床益处仍然存在不确定性”拒绝了该公司的批准申请。
正是由于此,投资机构对 Madrigal Pharmaceuticals 公司及其药物 Resmetirom 并没有抱很高期望,好在多项临床 Ⅲ 期试验的顶线积极结果重新燃起了投资者的信心,至于接下来 Resmetirom 能否不负众望并成为第一款获批的 NASH 治疗药物,让我们拭目以待。
参考资料:
1.https://ir.madrigalpharma.com/news-releases/news-release-details/madrigal-announces-positive-topline-results-pivotal-phase-3
2.https://www.biopharmadive.com/news/nash-madrigal-phase-3-results-resmetirom/639095/
3.https://www.madrigalpharma.com/
4.https://www.crunchbase.com/organization/madrigal-pharmaceuticals-inc/company_financials
5.https://www.89bio.com/pipeline/#bio89-100
6.https://www.interceptpharma.com/our-research/pipeline/

 产业资讯
产业资讯
 药渡
药渡  2025-11-07
2025-11-07
 29
29

 产业资讯
产业资讯
 药时代
药时代  2025-11-07
2025-11-07
 41
41

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-11-07
2025-11-07
 31
31