 产业资讯
产业资讯
 药明康德
药明康德  2022-12-23
2022-12-23
 2979
2979
《自然》子刊Nature Reviews Drug Discovery曾指出,每个“first-in-class”药物的上市多有赖于创新药物靶点的发现,靶点的重要性不言可喻!在2022年,全球科研人员们在创新靶点的探索和开发上做出了诸多突破:这些靶点有的是创新癌症免疫疗法诞生的契机,有的有望提升T细胞疗法的活性,有的则有可能变革阿尔茨海默病、帕金森病、非酒精性脂肪性肝炎(NASH)等重大疾病的治疗格局……

图片来源:药明康德内容团队制图
药明康德内容团队盘点了在2022发布于国际知名科研期刊当中的潜力靶点,以供各位医药界的朋友们作为参考。在这篇文章中,我们优选15个值得关注的靶点做详细报道。
癌症免疫疗法潜在靶点
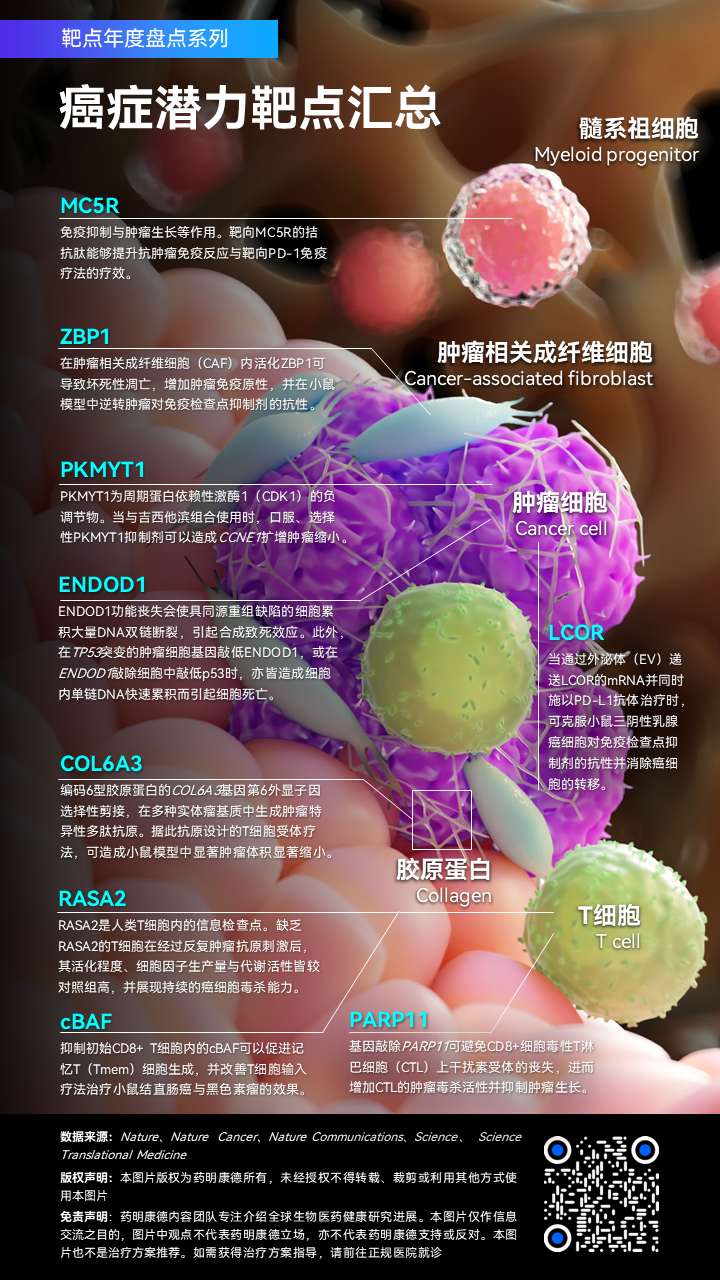
靶点:ZBP1应用:增加肿瘤免疫原性期刊 / PMID:《自然》 / 35614224发现:在癌症免疫治疗中,仅有一小部分病患会对免疫检查点抑制剂(ICB)单药疗法产生长期缓解。近期RNA编辑酶ADAR1被发现与免疫检查点抑制剂疗法抗性相关。ADAR1可通过抑制具免疫原性双链RNA(dsRNA)的产生,进而避免肿瘤对免疫检查点抑制剂产生应答。在此篇论文中,科学家发现ADAR1的突变或删除会造成Z型dsRNA(Z-RNA)的累积,进而活化Z-RNA感应蛋白ZBP1,并最终导致细胞发生RIPK3介导的坏死性凋亡(necroptosis)。由于临床上目前仍不存在ADAR1抑制剂,科学家找到了一种不受ADAR1影响而直接活化ZBP1的化合物CBL0137。通过引发细胞内生成Z-RNA,CBL0137可而有效地活化ZBP1。CBL0137可在肿瘤相关成纤维细胞(CAF)内引发ZBP1依赖性坏死性凋亡,并在黑色素瘤小鼠模型中逆转肿瘤对免疫检查点抑制剂的抗性。这些结果显示即便癌症对免疫检查点抑制剂已有耐药性,通过靶向活化ZBP1依旧可引发癌细胞的坏死性凋亡,恢复对免疫疗法的应答。
靶点:COL6A3应用:不限癌种T细胞疗法靶点期刊 / PMID:Science Translational Medicine / 36044599发现:T细胞受体疗法靶向细胞内外抗原,但此抗原肽片段须在肿瘤细胞上,通过与特定人类白细胞抗原(HLA)分子结合,成为peptide-HLA(pHLA)复合体呈现,才能为T细胞所识别。因此识别在肿瘤中高度表达但在健康组织内罕见、具高度TCR亲和力的pHLA复合体为TCR疗法成功的关键之一。研究人员对约1500个肿瘤与健康组织样本(包含11种不同实体瘤)进行测试,并通过量化质谱法来分析、比较组织内pHLA复合体。在使用人工智能量化分析每个细胞中含有各种pHLA复合体拷贝数后,研究人员发现一种由HLA-A*02:01所呈现的肿瘤特异性肽片段。此片段来自编码6型胶原蛋白的COL6A3基因,其第六外显子(exon 6)因选择性剪接而产生。这种选择性剪接出现在多种实体瘤基质中,但在健康组织内却十分罕见。而根据此所识别出的pHLA复合体所设计出的TCR疗法,在带有人类肿瘤细胞的小鼠当中展现良好疗效。实验结果显示,接受此项TCR疗法小鼠的肿瘤不但生长速度减缓,且有肿瘤缩小的情形。重要的是,此疗法的耐受性良好,研究人员并未观察到此疗法对正常细胞的任何毒性。因此COL6A3选择性剪接具潜力被开发成为治疗不同种类实体瘤的T细胞疗法。
靶点:MC5R应用:降低肿瘤免疫抑制期刊 / PMID:《科学》/ 35926007发现:下丘脑-垂体(hypothalamic–pituitary)能够分泌多种激素调控免疫反应,而其中有部分激素或效应分子在癌症病患中有增加的情形。研究人员发现,下丘脑-垂体能够促进髓系造血(myelopoiesis)与免疫抑制作用,进而促进肿瘤的生长。皮下肿瘤的植入会引发小鼠下丘脑活化,以及促进垂体分泌α-黑素细胞刺激素(α-MSH)。α-MSH通过作用于髓系祖细胞上的黑素皮质素受体5(MC5R)而促进髓系造血、髓系细胞累积、免疫抑制与肿瘤生长等作用。靶向MC5R的拮抗肽能够提升抗肿瘤免疫反应,以及靶向PD-1免疫疗法的疗效。值得一提的是,研究人员亦发现癌症患者血清中的α-MSH水平上升,并且与患者体内循环的髓系抑制细胞量呈正相关。这些发现显示神经内分泌通路可能参与抑制肿瘤免疫反应,以及MC5R为癌症免疫疗法的潜力靶点。
图片来源:药明康德内容团队制图
提升T细胞疗法抗肿瘤能力
靶点:PARP11应用:增强CAR-T细胞疗法抗实体瘤效力期刊 / PMID:Nature Cancer / 35637402发现:免疫抑制性的肿瘤微环境(TME)帮助实体瘤逃避抗肿瘤免疫反应并对免疫疗法产生抗性。科学家们发现包含调节性T细胞与腺苷在内的TME因子,会下调在CD8+细胞毒性T淋巴细胞(CTL)上1型干扰素受体IFNAR1的表达,而此过程与肿瘤中CTL内所诱发表达的多腺苷二磷酸核糖聚合酶11(PARP11)有关。PARP11是产生免疫抑制性TME的调节物之一。基因敲除PARP11则可避免CTL上IFNAR1的丧失,进而增加CTL的肿瘤毒杀活性并引起IFNAR1依赖性的肿瘤生长抑制。因此通过遗传学工具调控或药物来抑制PARP11,有潜力增加嵌合抗原受体(CAR)-T细胞疗法的疗效。而通过工程化造成PARP11失活的CAR-CTL则可能增加其抗实体瘤的效力。这些发现显示PARP11在具免疫抑制性的TME中所扮演的关键角色,并概念性验证靶向此信号通路以提升免疫疗法效力的可能。
靶点:cBAF应用:增强T细胞疗法抗实体瘤效力期刊 / PMID:《自然》/ 35732731发现:识别能够提升记忆T(Tmem)细胞生成的机制,对于癌症疫苗的发展与抗肿瘤免疫疗法的开发是至关重要的。研究人员通过CRISPR基因编辑技术筛选体内Tmem细胞的负调节因子时发现,许多哺乳类动物典型的BRG1/BRM相关因子(cBAF)组成扮演关键角色。这些cBAF复合体的组成对于活化的CD8+ T细胞分化成效应T(Teff)细胞是必须的,而这些Teff细胞的丧失则促使Tmem细胞在体内形成。有趣的是,研究人员发现,活化的CD8+ T细胞在进行分裂时,当子细胞同时具有高度MYC与cBAF表达时,细胞较有可能分化成Teff细胞;反之,当子细胞的MYC与cBAF表达量皆低时则细胞倾向分化成Tmem细胞。关键的是,当研究人员在初始CD8+ T细胞活化的48小时内以可能的cBAF抑制剂对小鼠进行治疗时,可以促进Tmem细胞生成,并改善T细胞输入疗法治疗小鼠结直肠癌与黑色素瘤的效果。此研究显示在T细胞分化早期调控cBAF,有潜力改善实体瘤癌症免疫疗法的效果。
靶点:RASA2应用:增加T细胞疗法持续性期刊 / PMID:《自然》/ 36002574发现:由于外在抑制因子与内部抑制检查点的作用,过继性T细胞疗法在癌症治疗上的效用受到局限,而靶标基因编辑可能是克服这些限制、加强T细胞疗法的关键。通过在不同免疫抑制情形下进行CRISPR基因敲除的筛选过程,研究人员识别出能够避免T细胞功能障碍的基因。不同的筛选过程皆发现RasGTP酶激活蛋白(RasGAP)RASA2是人类T细胞内的信息检查点,其表达量会在T细胞受体经急性刺激后下降,也会随着T细胞在慢性抗原暴露下逐渐升高。基因敲除RASA2会增强MAPK信号以及CAR-T细胞面对靶标抗原时的细胞溶解能力。体外实验显示,缺乏RASA2的T细胞在经过反复肿瘤抗原刺激后,与野生组细胞相比,其活化程度、细胞因子生产量与代谢活性皆较高,并展现持续的癌细胞毒杀能力。此外,RASA2基因敲除CAR-T细胞在血癌小鼠模型的骨髓中,也较具适应优势。重要的是,在许多临床前T细胞受体(TCR)疗法与CAR-T疗法中,去除RASA2能够延长异种移植的血液与实体瘤小鼠的生存期。因此RASA2可能是增加现有T细胞疗法持续性与功能性的关键靶点。
其他癌症治疗潜在靶点
靶点:PKMYT1疾病:CCNE1扩增肿瘤期刊 / PMID:《自然》/ 35444283发现:细胞周期蛋白E1(CCNE1)基因的扩增常见于许多类型的肿瘤,尤其是在高分化浆液性卵巢癌、子宫癌与胃食管癌,在这些癌症中细胞周期蛋白E1的高度表达与基因组不稳定性、对靶向药物具抗性相关。科学家为找出CCNE1扩增肿瘤的治疗靶标,以基于CRISPR-Cas9的技术进行基因组的合成致死配对筛选。科学家们发现,当细胞CCNE1的表达量增加,其对PKMYT1激酶的抑制变得更为敏感。PKMYT1为周期蛋白依赖性激酶1(CDK1)的负调节物。当与吉西他滨(gemcitabine)组合使用时,针对PKMYT1所开发的口服、选择性抑制剂RP-6306可以造成CCNE1扩增肿瘤缩小。因此靶向PKMYT1为CCNE1扩增肿瘤的潜在靶点。
靶点:ENDOD1疾病:同源重组缺陷&TP53突变肿瘤期刊 / PMID:Nature Communications / 35606358发现:研究人员发现非典型核酸酶ENDOD1在DNA修复机制中未曾被发现的功能。当细胞内ENDOD1基因被敲除时,ENDOD1功能的丧失会使具同源重组缺陷的细胞累积大量DNA双链断裂,引起合成致死效应。有趣的是,研究人员亦同时发现在TP53突变的肿瘤细胞中敲低ENDOD1,或在ENDOD1敲除细胞中进一步敲低p53时,皆会造成细胞内单链DNA快速累积而引起细胞死亡,因此ENDOD1与p53之间亦存在合成致死关系。而这也在动物实验中获得证实,小鼠对系统性EndoD1基因敲低具良好耐受性,然而对异种移植小鼠施以全身性靶向ENDOD1的siRNA时却会抑制其身上带有TP53突变的人类肿瘤进展。这些数据显示ENDOD1有潜力作为具癌症专一性的合成致死药物靶点。
靶点:LCOR疾病:三阴性乳腺癌(TNBC)期刊 / PMID:Nature Cancer / 35301507发现:配体依赖辅阻遏物(LCOR)蛋白介导了正常与肿瘤乳腺癌干细胞的分化。虽然肿瘤干细胞(CSC)造成肿瘤异质性(heterogeneity)以及肿瘤治疗抗性,但其在免疫疗法当中所扮演的角色却鲜为人知。研究人员发现以免疫检查点抑制剂治疗TNBC会筛选出具低LCOR表达量的CSC,这些CSC的抗原呈递机制(APM)蛋白表达下降,因此会使得肿瘤对免疫攻击与免疫检查点抑制剂疗法不产生应答。科学家们发现LCOR是APM基因的转录激活蛋白,能以独立于干扰素(IFN)信息的方式与IFN刺激反应元素基序(ISRE)结合。LCOR的表达可增强肿瘤的免疫原性与对免疫检查点抑制剂的应答性。重要的是,LCOR的表达亦与TNBC患者对免疫检查点抑制剂的临床应答相关。当通过外泌体(EV)递送LCOR的mRNA并同时施以PD-L1抗体治疗时,可克服小鼠TNBC细胞对免疫检查点抑制剂的抗性并消除乳腺癌细胞的转移。这些结果显示LCOR可通过提升肿瘤APM表达,加强免疫检查点抑制剂对TNBC的疗效,是一款有力的潜在靶点。
代谢相关疾病潜在靶点
靶点:ASGR1疾病:高胆固醇期刊 / PMID:《自然》/ 35922515发现:高胆固醇是造成心血管疾病的重大风险之一。直至目前为止,尚无通过促进胆固醇排泄以降低胆固醇水平的药物上市。过去遗传学研究曾发现去唾液酸糖蛋白受体1(ASGR1)变异所导致的功能失去突变与低胆固醇水平和心血管疾病风险降低有关。ASGR1仅表达于肝脏内,其可介导血液中去唾液酸糖蛋白内化与在溶酶体中的降解。在此篇论文中,科学家们发现小鼠内Asgr1的缺失会稳定肝X受体α(LXRα),进而造成血清与肝脏内脂肪水平的下降——这可能是因为LXRα上调转运蛋白ABCA1与ABCG5/G8,进而促进胆固醇运输至高密度脂蛋白并分别排泄至胆汁与粪便中。重要的是,当施以小鼠靶向ASGR1中和抗体时能够促进胆固醇排泄并降低脂质水平,且与atorvastatin和ezetimibe这两个广为使用的降胆固醇药物产生协同作用。因此ASGR1为促进胆固醇排泄与降低脂质水平的潜在靶点。
靶点:CD47-SIRPα疾病:NASH期刊 / PMID:Science Translational Medicine / 36417485发现:坏死性凋亡是造成肝细胞在NASH疾病死亡的机制之一,然而科学家们对于这些坏死性凋亡肝细胞(necHCs)在NASH中所扮演的角色却不清楚。研究人员发现,在患有NASH的人类与小鼠肝脏中necHCs的累积,与在necHCs表面所表达的“别吃我”CD47配体相关。此外,在肝脏巨噬细胞表面亦发现CD47受体SIRPα的表达量增加,这与所观察到巨噬细胞介导的necHCs清除受损现象一致。重要的是,当科学家以靶向CD47、SIRPα抗体治疗,或以腺相关病毒递送shCD47以沉默CD47在肝细胞的表达时,在两个由饮食引起的NASH小鼠模型上皆发现肝脏巨噬细胞增加对necHCs的清除,以及肝纤维化与肝脏星状细胞(HSC)活化的生物标志物降低。HSC活化是导致肝脏纤维化的原因之一。此外,以SIRPα抗体治疗亦可避免小鼠因CD47抗体治疗而产生的贫血副作用。这些发现显示阻断CD47-SIRPα信息通路可避免necHCs在肝脏的累积以及肝纤维化进展,是治疗NASH的潜在靶点。
靶点:FLCN疾病:非酒精性脂肪性肝病(NAFLD)、NASH期刊 / PMID:《科学》/ 35420934发现:NAFLD和NASH目前为止都尚未存在有效的治疗方法,虽然mTORC1通路为潜在的靶向疗法,但对于mTORC1如何控制脂质代谢却存在着争议性的解读。研究人员发现,当通过删除RagC/D鸟苷三磷酸酶激活蛋白FLCN(即卵泡素,folliculin)来选择性地抑制小鼠内的mTORC1通路时,可以在不影响其他mTORC1靶标蛋白的情况下,促进肝脏转录因子E3(TFE3)的活化。TFE3可通过诱发脂质消耗与抑制脂肪生成,保护肝脏免于NAFLD与NASH的疾病进展。这些结果对以往看似相冲突的研究做出了解释,并识别如FLCN等mTORC1通路蛋白为潜在的NAFLD与NASH治疗靶点。

图片来源:药明康德内容团队制图
神经系统相关疾病潜在靶点
靶点:USP11疾病:阿尔茨海默病期刊 / PMID:《细胞》/ 36198316发现:与男性相较,女性具有显著较高的tau蛋白含量,也易罹患阿尔茨海默病,但造成此现象的机制尚仍不清楚。科学家在此篇论文中揭示,X连锁泛素特异性肽酶11(USP11)能够对tau蛋白进行去泛素化,进而使tau蛋白的相关位点发生乙酰化,造成tau蛋白聚集扩大的病理现象。乙酰化的tau蛋白是阿尔茨海默病患脑部内的病理特征之一。研究人员并证实,通过遗传学删除具有tau病变小鼠模型内的usp11表达时,可以选择性地保护母鼠,减少乙酰化tau蛋白的累积、tau相关病变以及认知损害。因此抑制由USP11介导的tau蛋白去泛素化可能降低女性罹患阿尔茨海默病与tau蛋白病变的风险。
靶点:GPNMB疾病:帕金森病期刊 / PMID:《科学》/ 35981040发现:通过全基因组关联分析(GWAS)相关研究,许多与帕金森病相关的基因位点已被识别,然而治疗帕金森病的靶点基因与机制仍多属未知。研究人员通过GWAS数据,以及对帕金森病风险讯号与位点特征表达定量(expression quantitative trait locus)的共定位分析发现,帕金森病相关的染色体7位点(包含rs199347)与非转移性黑色素瘤糖蛋白b(GPNMB)基因相关联。研究人员发现,在细胞内,GPNMB蛋白与α突触核蛋白(α-synuclein,aSyn)存在共定位与免疫共沉淀关系。在源自诱导多能干细胞的神经元模型中,GPNMB的丧失使得细胞无法内化aSyn原纤维,进而避免产生aSyn相关的病理现象。值得一提的是,在对731位帕金森病患者与59位对照组样本的分析后发现,帕金森患者血浆中GPNMB表达量升高,且其表达量与患者疾病严重程度相关。因此GPNMB为帕金森病的风险基因,且为开发生物标志物与疾病治疗的潜在靶点。
靶点:CLEC7A疾病:阿尔茨海默病期刊 / PMID:《细胞》/ 36306735发现:遗传学研究显示小胶质细胞在阿尔茨海默病中扮演关键角色,其中小胶质细胞内TREM2-SYK信号异常与疾病发展相关。TREM2 R47H蛋白的变异与罹患阿尔茨海默病的高风险相关,这些变异的蛋白无法通过SYK激酶来活化小胶质细胞。研究人员发现,缺失SYK的小胶质细胞由于无法对Aβ斑块进行包覆,会加速小鼠大脑病变与行为障碍。CLEC7A受体可直接活化SYK激酶。当系统性递送靶向CLEC7A抗体至小鼠体内时,可活化TREM2 R47H蛋白变异小鼠内的SYK激酶,进而促进小胶质细胞活化,因此CLEC7A有可能成为阿尔茨海默病免疫疗法的新治疗选择。
期待这些创新靶点的发现能够促进更多创新疗法的开发,带进临床治疗的突破,造福更多受不同疾病所苦的患者。

 产业资讯
产业资讯
 医药财经
医药财经  2025-06-25
2025-06-25
 35
35

 产业资讯
产业资讯
 医药魔方
医药魔方  2025-06-25
2025-06-25
 32
32

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-06-25
2025-06-25
 33
33