 产业资讯
产业资讯
 生物制药小编
生物制药小编  2022-12-23
2022-12-23
 3380
3380
药物发现和开发是一个漫长、昂贵和高风险的过程,需要10-15年以上的时间,每个新药被批准用于临床的平均成本超过10-20亿美元。对于任何一家制药公司或学术机构来说,在候选药物在临床前阶段经过严格优化后,将一个候选药物推进到I期临床试验是一项重大成就。然而,在进入临床研究后的10个候选药物中,有9个在I期、II期、III期临床试验和药物批准期间会失败。同样值得注意的是,90%的失败率是针对已经进入I期临床试验的候选药物,这不包括处于临床前阶段的候选药物。如果还统计处于临床前阶段的候选药物,药物发现/开发的失败率甚至高于90%。
2010年至2017年的临床试验数据分析显示了归因于90%药物开发临床失败的4个可能原因:缺乏临床疗效(40%-50%)、无法控制的毒性(30%)、药物样特性差(10%-15%)以及缺乏商业需求和战略规划不佳(10%)。一般来说,药物开发遵循一个经典的过程,包括遗传和基因组靶标验证、候选药物分子的高通量筛选(HTS)、严格的药物活性和类药特性优化、临床前疗效和毒性测试,以及生物标志物指导的患者选择和最佳临床试验设计。
尽管做出了这种经过验证的努力,但临床药物开发的总体成功率仍然很低,为10%-15%。如此持续的高失败率提出了几个问题:尽管在过去几十年中实施了许多成功的策略,为什么90%的临床药物开发失败?我们是否忽视了导致高失败率的药物开发过程的某些方面?如何提高临床药物开发的成功率?
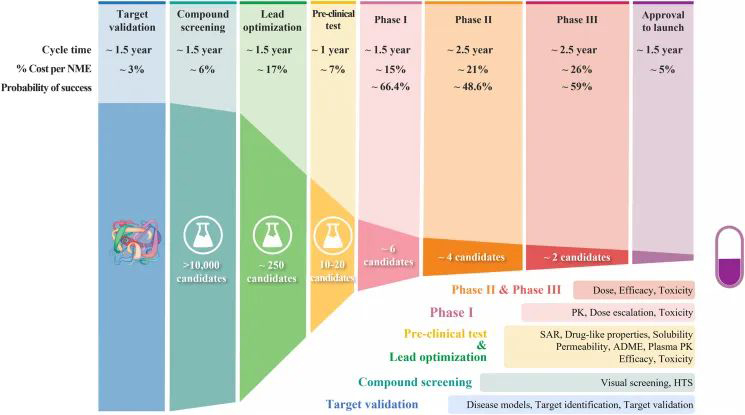
图:药物发现和开发的过程,以及每一步的失败率
在过去几十年中,改善药物开发过程各方面的成功策略是什么?
1.选择最佳的先导候选药物以达到充分的临床疗效;由于40%-50%的药物开发临床失败是由于缺乏临床疗效,因此在临床前和临床研究中致力于改善药物疗效。在成功开发药物之前,在人类疾病中对任何新的分子靶点进行真正的验证都具有挑战性,因为体外、疾病动物模型和人类疾病之间的生物学差异可能会阻碍对分子靶点功能的真正验证。人工智能(AI)和机器学习计算工具进一步改善了计算辅助药物设计过程。使用基于蛋白质的生化检测、基于细胞的表型检测或基于微生物的检测进行HTS可提高结合的效率和特异性。在临床前试验期间,通常对化合物进行试验和优化,以在临床前动物疾病模型中显示出极好的疗效。在临床研究过程中,严格优化了I期至III期的临床试验设计和给药方案选择。此外,基因组学和遗传生物标志物也已被广泛用于选择患者进行临床试验,以提高药物开发的成功率。
2.选择最佳的先导候选药物,以尽量减少临床毒性;在毒理学研究中使用了各种策略,以尽量减少由于无法控制的临床毒性导致的药物开发失败。为了降低脱靶毒性,通常针对其他靶点进行药物筛查。例如,开发任何激酶抑制剂通常需要针对其他几百种激酶进行筛选。疾病相关激酶靶标相对于其他激酶靶标的选择性通常通过其IC50的比值计算,其中首选至少10倍的选择性。另一方面,如果候选药物具有靶向毒性(由抑制疾病相关靶点引起),则溶液有限,剂量方案滴定可能有帮助。此外,通常会评价候选药物是否会抑制主要重要器官中的几个已知毒性靶点。由于动物模型和人类之间可能存在差异,在临床试验期间,通常使用各种方法优化给药方案,以维持具有充分疗效和可控毒性的治疗窗。
3.选择具有最佳药物样特性的最佳先导候选药物;不良的药物样特性导致了20世纪90年代30%-40%的药物开发失败;但它们今天只占药物开发失败的10%-15%。这种改进受益于药物优化过程中对药物样特性的严格选择标准,包括溶解度、渗透性、蛋白结合、代谢稳定性和体内药代动力学,如生物利用度(F)、药物暴露量(AUC)、Cmax、t1/2、清除率CL和分布容积V。
4.优化药物研发的战略规划;战略规划不佳,可能包括治疗重点的改变、公司合并或临床研究行为不佳,占药物开发失败的10%。制药公司的合并可能会增加被迫终止的药物的重复数量,所有制药公司都制定了细致的开发计划,具有详细的路线图和里程碑,以在每个开发阶段从实验室推进新的化合物。人工智能(AI)带来了最先进的分析工具,使制药公司能够以更高效和成本效益更高的方式预测患者的需求和市场趋势。
导致临床药物开发高失败率的药物发现/优化中被忽视的方面是什么?
真正的靶点验证,证实了分子靶点是人类疾病的病因和药物的预期靶点,对临床药物开发的成功仍具有挑战性;
目前的药物优化可能过分强调了一个方面,但忽略了其他方面,这些方面可能误导候选药物选择,并影响临床剂量/疗效/毒性的平衡;
如何提高药物优化选择更好的候选药物,平衡临床剂量/疗效/毒性,提高临床药物开发成功率?
临床药物研发的成功与否,除了真正的靶点验证,还取决于最佳候选药物的选择和临床剂量/疗效/毒性之间的微妙平衡。人体试验中候选药物临床剂量/疗效/毒性的平衡不仅取决于其抑制分子靶点的效力/特异性(通过SAR研究),还取决于其在疾病靶向器官与正常器官中的暴露/选择性(通过结构-组织暴露/选择性关系,STR)。
本研究提出了一个结构-组织暴露/选择性-活性关系(STAR)系统,以改善药物优化过程。STAR系统根据以下三个方面将候选药物分为四类(I‒IV):使用IC50或Ki(高或低)SAR研究确定的抑制分子靶点的药物效力/选择性;使用STR研究(高或低)确定的药物组织暴露量/选择性;平衡临床疗效/毒性的剂量要求(高或低)。4种不同类别的候选药物(I‒IV类)需要不同的策略来选择先导候选药物、优化临床剂量和平衡临床疗效/毒性。STAR的成功应用将提高4类不同候选药物的药物优化和临床研究效率,以提高临床药物开发的成功率。
在该STAR系统中,SAR探索了改变化合物与分子靶标结合亲和力和特异性的结构修饰。可以使用SAR优化药物的效力和特异性,以获得在低nmol/L或pmol/L范围内具有低Ki或IC50的化合物,以获得更好的疗效和更低的毒性。
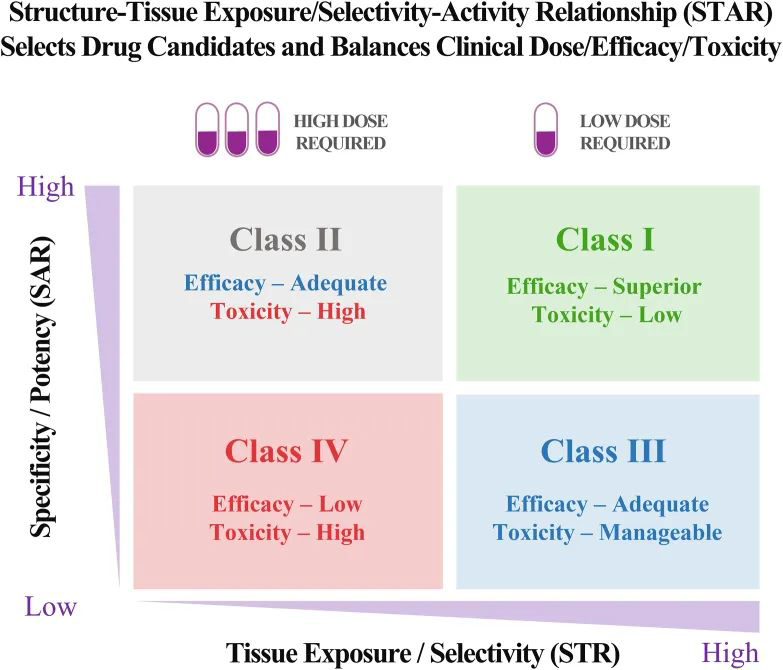
图:结构-组织选择性/暴露-活性关系(STAR)可选择更好的候选药物并平衡临床剂量/疗效/毒性,以改善药物优化,从而成功进行临床药物开发
在该STAR系统中,I类候选药物具有高特异性/效价和高暴露/选择性,这需要低剂量以达到平衡的有效性/安全性,并且以较高的成功率最为理想。II类候选药物具有高特异性/效价和低组织暴露/选择性,需要高剂量才能达到足够的疗效,但可能具有无法控制的毒性。Ⅱ类候选药物需要谨慎评估,以平衡临床剂量/疗效/毒性。III类候选药物具有相对较低但充分的特异性/效价,但组织暴露/选择性较高,可能需要低至中等剂量以达到充分的疗效和可控的毒性。Ⅲ类候选药物可能具有较高的临床成功率,但由于药物发现早期血浆药物暴露较差,常被忽视。第四类候选药物特异性/效价低,暴露量/选择性低,往往需要高剂量,且疗效不充分,毒性大,应尽早终止。
结论
在过去的几十年中,90%的临床药物研发在临床I期、II期和III期临床研究和药物批准过程中失败,原因可能有四个:缺乏临床疗效、毒性难以管理、药物样特性差、缺乏商业需求和战略规划不佳。
在临床药物开发中,为了在临床剂量、疗效和毒性之间实现微妙的平衡以优化患者的获益/风险比,理想的候选药物将具有高效、特异性地抑制其分子靶点而不产生脱靶效应,疾病靶向组织中的高药物暴露以在最佳剂量(理想情况下为低剂量)下达到足够的疗效,健康组织中的药物暴露量最小以避免最佳剂量(即使在高剂量)下的毒性。临床试验中候选药物临床剂量/疗效/毒性的微妙平衡不仅取决于其抑制分子靶点的效力/特异性(通过SAR研究),还取决于其在疾病靶向组织和正常组织中的组织暴露量/选择性(通过STR研究)。然而,当前的药物优化过程在SAR研究中过分强调了药物的效力/特异性,但在STR研究中忽略了药物在疾病靶向组织与正常组织中的组织暴露/选择性,这可能误导了候选药物的选择,影响了临床剂量优化,并使临床疗效和毒性的平衡倾斜。
研究提出了一个改进药物优化过程的STAR系统,该系统根据三个方面将候选药物分为四类:药物效力/特异性(高或低)、药物组织暴露量/选择性(高或低)和平衡临床疗效/毒性所需的剂量(高或低)。4种不同类别的候选药物(I‒IV类)需要不同的策略来选择先导候选药物、优化临床剂量和平衡临床疗效/毒性。
未来,利用AI辅助计算建模、体外筛选、体内测试和非侵入性成像技术可以改进STAR系统。STAR的应用将提高4类不同候选药物的药物优化和临床研究效率,以提高临床药物开发的成功率。
参考文献:
Sun D, Gao W, Hu H, Zhou S. Why 90% of clinical drug development fails and how to improve it? Acta Pharm Sin B. 2022 Jul;12(7):3049-3062. doi: 10.1016/j.apsb.2022.02.002. Epub 2022 Feb 11. PMID: 35865092; PMCID: PMC9293739.

 产业资讯
产业资讯
 同写意
同写意  2025-05-17
2025-05-17
 126
126

 产业资讯
产业资讯
 一度医药
一度医药  2025-05-17
2025-05-17
 121
121

 产业资讯
产业资讯
 Being科学
Being科学  2025-05-17
2025-05-17
 114
114