 产业资讯
产业资讯
 Insight数据库
Insight数据库  2022-12-30
2022-12-30
 2707
2707
12 月 29 日,君实生物的口服核苷类抗新型冠状病毒(SARS-CoV-2)药物 VV116(JT001)头对头辉瑞 Paxlovid 治疗伴有进展为重度包括死亡高风险因素的轻至中度新冠病毒(COVID-19)感染的 III 期临床数据在国际顶级期刊 NEJM 上重磅发布!
这是 NEJM 发表的首个中国自主研发新冠创新药临床试验。在如今疫情形势之下,「一药难求」始终是无数人为之焦虑的问题。国内获批用于新冠的抗病毒药物目前仅辉瑞 Paxlovid 和真实生物阿兹夫定,但迄今尚未有在奥密克戎变异株流行期间针对国内 COVID-19 患者的头对头的小分子药物 III 期临床发布。
君实在今年 5 月宣布这项临床研究取得成功,今日其详细数据终于见刊。结果显示,该项研究达到设计的非劣效终点,相比 PAXLOVID,VV116 组的临床恢复时间更短,安全性方面的顾虑更少。
下文中,我们来看一看具体数据。

疗效非劣,安全性更优
此次研究由上海交通大学医学院附属瑞金医院牵头开展,是一项多中心、单盲(研究者保持盲态)、随机、对照 III 期临床试验(NCT05341609),于 2022 年 4 月 4 日至 5 月 2 日期间,在上海的 7 家新冠肺炎定点医院联合开展 ,共纳入 822 例确诊为伴有进展高风险的轻度至中度 COVID-19 成人患者,按照 1:1 的比例被分配至 VV116 组和 PAXLOVID 组。最终,共有 771 例(全分析集,FAS)患者接受了 VV116(n=384)或 PAXLOVID(n=387)的治疗。
其中,FAS 患者的中位年龄为 53 岁(范围:18~94),女性占比 50.2%,轻症患者占比 92.1%,75.7% 的患者全程接种新冠疫苗或接种过加强针,77.3% 的患者在症状出现 5 天内接受了 VV116 或 PAXLOVID 治疗。
患者中最常见的高风险因素包括:年龄≥60 岁(37.7%)、心血管疾病(包括高血压)(35.1%)、肥胖或超重 BMI≥25(32.9%)、目前吸烟(12.5%)和糖尿病(10.1%)。
研究的主要终点是从随机至持续临床恢复的时间,风险比(HR)两侧 95% 置信区间(CI)下限 >0.8 定义为非劣效性。次要疗效终点包括截至第 28 天进展为重度/危重 COVID-19 或全因死亡的患者比例,COVID-19 相关症状评分和 WHO 临床进展量表评分变化、至持续症状消失的时间、SARS-CoV-2 核酸阴性时间等。安全性终点包括不良事件(AE)和严重不良事件(SAE)情况。
根据最终分析结果(截至 2022年 8 月 18 日),在 FAS 人群中,VV116 与PAXLOVID 在「至持续临床恢复的时间」达到非劣效(HR=1.17,95%CI:1.02~1.36),且 VV116 组比 PAXLOVID 组的中位恢复时间更短(4 天 vs. 5 天)。
FAS 人群的至持续临床恢复时间最终分析结果
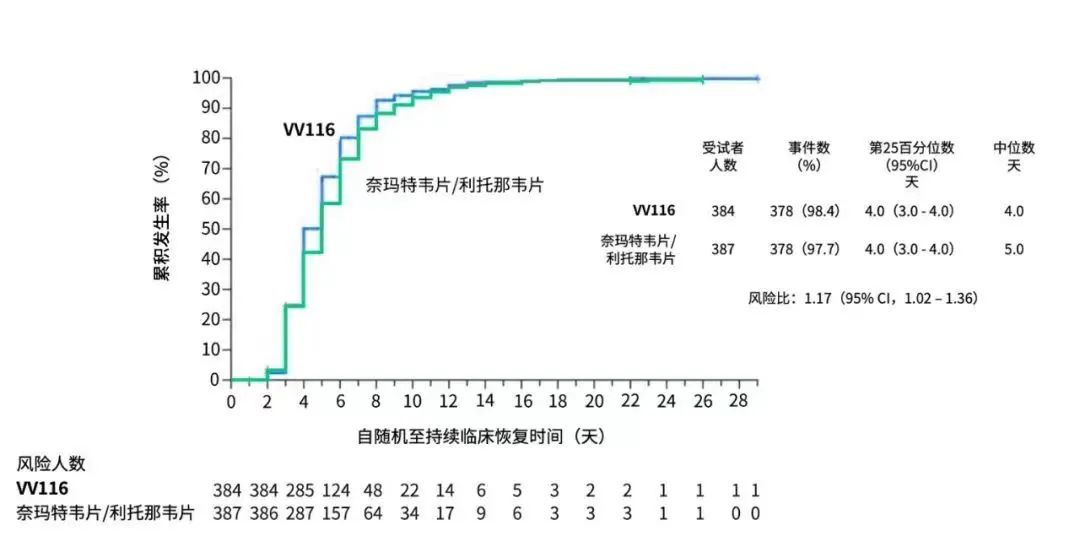
VV116 组和 PAXLOVID 组在「至持续症状消失的时间」、「至首次 SARS-CoV-2 核酸阴性时间」方面表现类似,中位时间均为 7 天。在每一个预设时间点(第 5、7、10、14、28 天),VV116 组症状缓解的患者比例均高于 PAXLOVID 组。两组患者均未发生进展为重度/危重 COVID-19 或死亡。
此外,本研究中约 3/4 的患者曾接种过新冠疫苗,而此类患者在大多数的研究中会被排除在外,亚组分析结果显示,VV116 和 PAXLOVID 在接种或未接种疫苗人群中的治疗结果无统计学差异。
在安全性方面,VV116 比 PAXLOVID 的安全性顾虑更少。VV116 组的 AE 发生率低于 PAXLOVID 组(所有级别的 AE:67.4% vs. 77.3%,3 或 4 级 AE:2.6% vs. 5.7%)。
值得注意的是,PAXLOVID 与多种药物存在相互作用,而 VV116 不会抑制或诱导主要药物代谢酶,或者抑制主要药物转运蛋白,因此与合并用药发生相互作用可能性小。
拓展患者人群覆盖
在君实新闻稿中,全球研发总裁邹建军博士表示,在本次这项试验设计、试验质量和试验结果都受到国际学术界高度认可的研究之后,君实还在持续投入 VV116 在其他人群中的适应症的临床开发工作,为我国乃至全球新冠患者提供效果更好、更安全的治疗选择。
君实生物 VV116 研发进程时光轴
截图来自:Insight 数据库(http://db.dxy.cn/v5/home/)
比如,同样针对轻中度 COVID-19 患者,君实在 10 月份启动的 III 期临床研究(登记号:NCT05582629)采用双盲、安慰剂对照。在该试验中纳入的患者并非一定要伴有高危风险 COVID-19 患者,意味着试验可参与人群相对更广泛。
该研究的 PI 为中国工程院院士李兰娟,研究的主要终点为临床症状持续至消退的时间。目标入组人数为 1200 人,当前正在招募中。
NCT05582629 试验设计、终点指标、纳入标准

截图来自:Insight 数据库
君实还在探索 VV116 在轻中度新冠感染病毒反弹率的研究,刚于 12 月 19 日注册了一项头对头 Paxlovid 的 III 期临床试验(注册号:ChiCTR2200066811),由上海交通大学医学院附属瑞金医院院长宁光院士主持。该研究主要终点指标为随机后 60 天内反弹率,目标入组人数为 478 人,预计于 2023 年 12 月完成试验。
ChiCTR2200066811 临床试验信息

来自:Insight 数据库网页版
除轻中度患者外,君实在今年 3 月在 ClinicalTrials.gov 上登记了一项针对中重度新冠患者的国际多中心 III 临床研究(登记号:NCT05279235),这是一项与法匹拉韦(Favipiravir)比较疗效与安全性的多中心、双盲、随机研究。不过,在 ClinicalTrials.gov 网站显示,该研究尚未开始招募。
NCT05279235 试验设计与干预方案

来自:Insight 数据库网页版
君实也早早为上市后的生产做准备。今年 5 月,君实宣布与海正达成合作,将委托海正生产 VV116 原料药。
新冠抗病毒药「一药难求」何时可解?大量国内企业冲刺中
目前,新冠疫情仍然在全球范围内持续快速传播,病毒的传播与逃逸能力随着变异不断增强。口服类抗病毒药物因具有给药便利、耐药屏障高、运输存储限制少等优势,有助于缓解医疗负担,被认为是抗疫必不可少的防治手段之一。
不过目前,可及性、安全性等原因仍是导致药物应用受限的众多因素之一。如辉瑞 Paxlovid,其获批范围遍布全球多国,出现供不应求的状态,甚至有传言称辉瑞正版 P 药被炒上数万元的高价,各质量难以保障的「印度仿制药」也各行其道。
更多新药尤其是国产新药的问世无疑是支持目前国内新冠治疗、缓解新冠焦虑的重要解决之道。本次公布结果的 VV116 是其中佼佼者,近期其他新药也释放出积极信号。
据 Insight 数据库显示,目前国内新冠小分子化药的研发主要集中在 3CLPRO 和 RDRP 这两个靶点上。
全球新冠化药靶点热力图
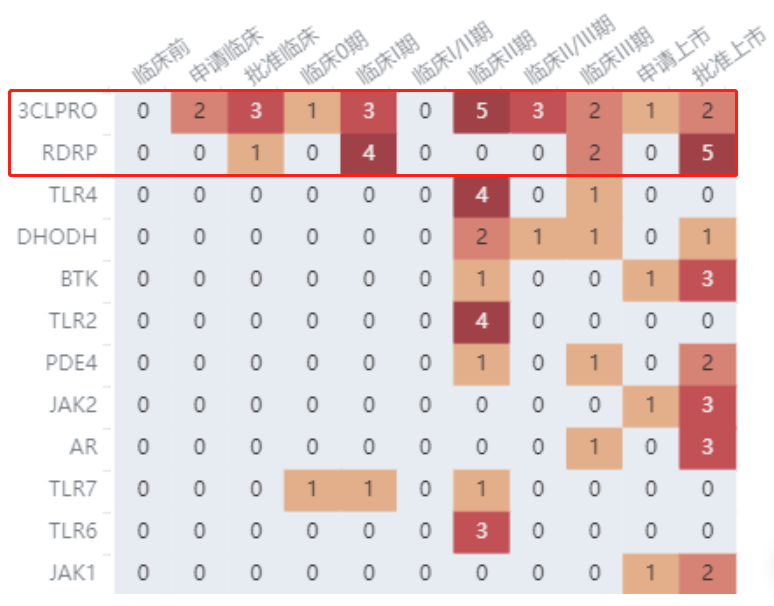
截图来自:Insight 数据库全球新药模块(http://db.dxy.cn/v5/home/)
RDRP 靶点的典型代表,进口药维度是 Molnupiravir(默沙东)、瑞德西韦(吉利德),国产药以君实 VV116、真实生物阿兹夫定为主。目前在国内,阿兹夫定已经获批,Molnupiravir 正在上市申请当中。随着 VV116 积极临床结果不断释放,何时有望上市?
3CLPRO 靶点则更受药企追捧。3CLPRO 在新型冠状病毒的 RNA 复制中具有重要作用,保守性高,这一靶点的代表就是辉瑞的明星药 Paxlovid,这是当前国内唯一获批的 3CL 蛋白酶抑制剂;以及盐野义的 Ensitrelvir,正在上市申请中,国内分销已经牵手上海医药。
Paxlovid 和阿兹夫定此前就已经作为第九版新冠诊疗方案药品而被临时性纳入医保支付范围,Paxlovid 2300 元/盒,阿兹夫定 270 元/瓶。不过由于阿兹夫定的新冠适应症获批较迟,因此通过医保初审、将在今年争取正式医保目录的新冠适应症准入的只有辉瑞的 Paxlovid。
12 月受疫情影响,医保谈判推迟了 1 个多月,不过已有确切消息称,2022 年医保谈判将在 1 月 5 日 ~ 8 日举行,尤其新冠药物的谈判结果更受瞩目。近日,Paxlovid 也已在各省下调挂网价,由 2300 元/盒调整至 1890 元/盒。后续国谈还将降价多少?
辉瑞医保谈判信息 PPT

截图来自:医保局公开资料
而国产药中,进度最快的 3 款分别是先声药业的 SIM0417、前沿生物的福布特韦、众生药业的 RAY1216。先声药业目前已完成 II/III 期临床患者全部入组,正在加速推进,冲刺国产第 1 款 3CL 蛋白酶抑制剂。
这项 II/III 期临床研究在国内 20 个省市自治区 43 家临床研究中心开展,自 2022 年 8 月 19 日首例入组后的四个月内完成了全部 1208 例患者入组,同样针对奥密克戎毒株中国患者。
SIM0417 研发进度甘特图
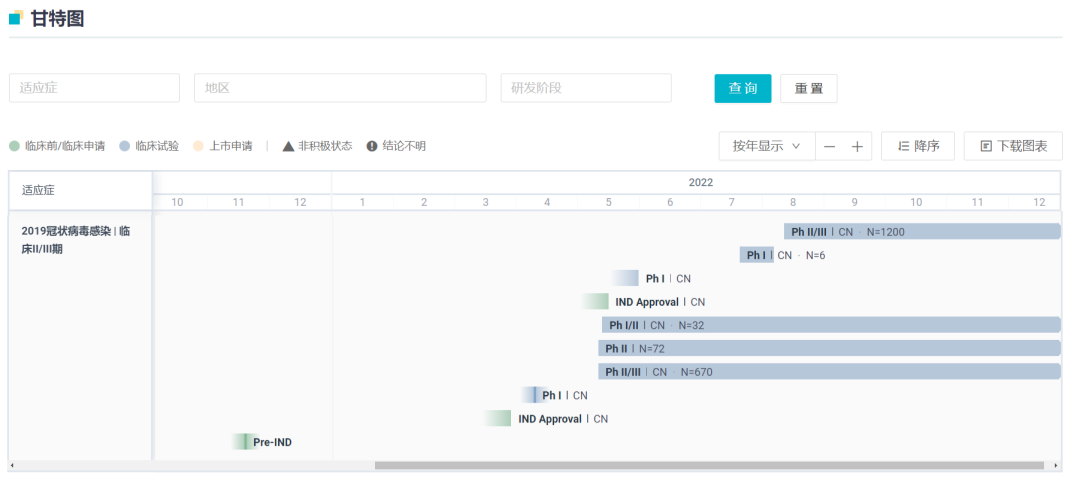
截图来自:Insight 数据库
目前,国内药企均在不断加速开发新冠小分子抗病毒药,以应对疫情形势的复杂和严峻。据 Insight 数据库显示,仅 12 月就有 4 款国产新冠小分子化药推进到新的阶段,涉及石药、信立泰、广生堂、众生药业。

 产业资讯
产业资讯
 药渡
药渡  2025-11-07
2025-11-07
 37
37

 产业资讯
产业资讯
 药时代
药时代  2025-11-07
2025-11-07
 50
50

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-11-07
2025-11-07
 39
39