 产业资讯
产业资讯
 求实药社
求实药社  2023-01-06
2023-01-06
 5957
5957
肿瘤免疫疗法概述
2011年,伊匹木单抗(ipilimumab)获批用于黑色素瘤治疗,标志着肿瘤免疫疗法革命的开始。肿瘤免疫疗法对肿瘤综合治疗模式产生了巨大影响,成为继手术治疗、放化疗和分子靶向药物治疗之后的新型肿瘤治疗手段。
2013年肿瘤免疫疗法被Sdmce杂志评为年度科学突破之首。2018年诺贝尔生理或医学奖授予了美国科学家詹姆斯•艾利森和日本科学家本庶佑,以表彰他们在“发现负性免疫调节治疗癌症的疗法”中所做出的贡献。
近10年来,肿瘤免疫疗法取得了突破性的进展,获得了良好的临床疗效。以免疫检查点抑制剂、过继细胞疗法、肿瘤疫苗等为代表的肿瘤免疫疗法相继进入市场 ,给肿瘤患者带来更多治疗选择。
随着科研人员对肿瘤免疫疗法的日益关注,越来越多的肿瘤免疫治疗潜在靶点被逐渐发现,包括程序性死亡受体1/程 序 性 死 亡 受 体 配 体 1 ( programmed cell death protein 1/programmed cell death ligand-1,PD-l /PDLl)、细 胞 毒 性 T 淋 巴 细 胞 相 关 抗 原 4 (cytotoxicT-lymphocyte-associated antigen 4 ,CTLA~4) 、 B 细胞成熟抗原(B cell maturation antigen, BCMA)、 T 细胞免疫球蛋白粘蛋白-3 (T cell immunoglobulin domain and mucin domain-3,TIM-3)、淋巴细胞活化基因-3 (lymphocyte activation gene 3 ,LAG3 ) 、血细胞族分化抗原(CD)19、CD4 7 等。
目前研究最为广泛的肿瘤免疫疗法主要为针对PD-1/PD-L1 的免疫检查点抑制剂和嵌合抗原受体T 细胞(chimeric antigen receptor-T cell, CAR-T )疗法。截至 2021 年 4 月 I日,全球范围内获批上市的PD-1/PD-L1 抗体药物有 11款 ,获批适应证主要包括黑色素瘤、非小细胞肺癌、肝细胞癌、胃癌、结直肠癌、头颈癌、霍奇金淋巴瘤等;获批上市的CAR-T 细胞疗法有 5 款,获批适应证为淋巴瘤、急性淋巴细胞白血病以及多发性骨髓瘤等血液肿瘤。
随着CAR-T 疗法在临床上的应用范围逐渐扩展 ,一些缺陷也随之显现:治疗性抗体只能识别细胞外蛋白,对患者的疗效有限,并伴有组织渗透性差、半衰期长、生物利用度低、生产难度大、成本高昂等缺点;CAR-T 细胞疗法至今只在血液肿瘤领域取得突破,对实体瘤尚未取得令人满意的疗效。
与大多数抗体药物相比,小分子药物具有更好的组织渗透性,从而可以直接靶向细胞内或细胞外的靶点来提高抗肿瘤免疫反应。
此外,相对较短的半衰期可以减少小分子药物在循环中的累积,从而降低全身毒性风险 。这些特征促使小分子肿瘤免疫药物在近年来受到广泛关注,有望作为抗体药物的补充,进一步提高免疫治疗的疗效并降低毒性反应。
小分子肿瘤免疫治疗药物
目前,小分子免疫药物的研发已经取得了一些积极进展。进人临床研究阶段的小分子免疫药物作用的靶点(见 图 1 )
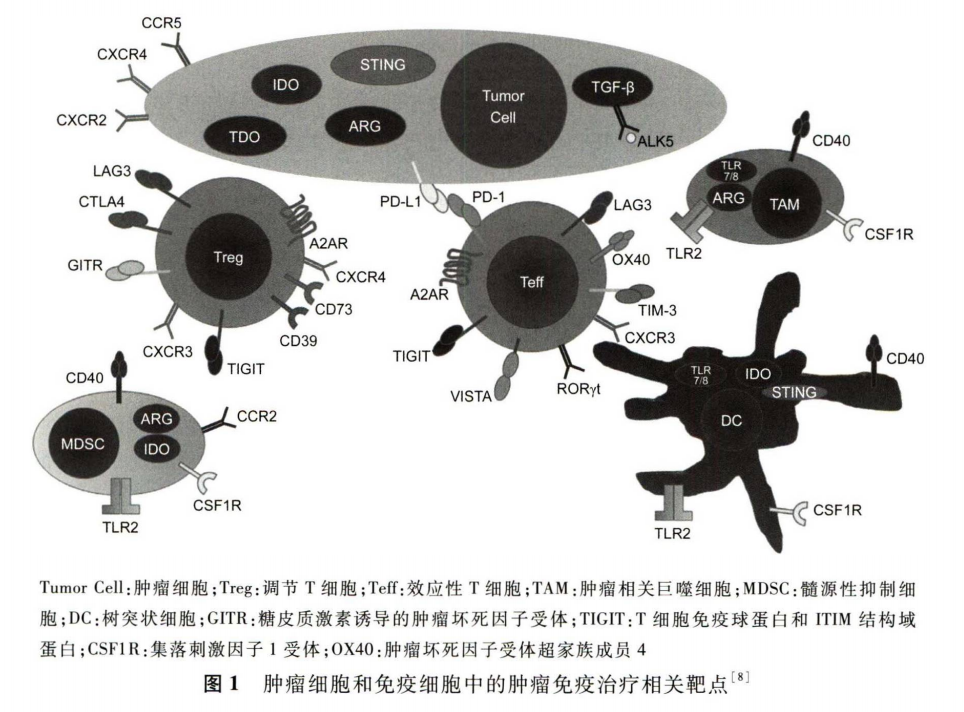
主要包括:PD-1/PD-L1、干扰素基因刺激蛋白( stimulator of interferon genes,STING) 、吲哚胺-2,3-双加氧酶 ( indoleamine 2 ,3-dioxygenase,IDO) 、 腺苷A2A 受体 (adenosine2A receptor,A2AR)、趋化因子受体、Toll样受体( toll like receptor, TLR)、维 A 酸相关孤儿受体 γt ( retinoicacid receptor-related orphan receptor γt , RORγt )、精氨酸酶(arginases, ARG)、T 细胞活化的免疫球蛋白抑制V 型结构域(V-domain immunoglobulin suppressor of T-cell activation , VISTA )、转化生长因子p(transforming growth factor β ,TGF-β)等。本文基于这些靶点对研发进展较快的小分子免疫药物进行介绍。
2.1 PD-1/PD-L1抑制剂
PD-1于 1992年被日本学者发现并命名,是 B7/CD28家族的I 型跨膜糖蛋白。作为激活型T 细胞的一种表面受体,当 PD-1与位于抗原呈递细胞( antigen presenting cells, APC)表面的配体结合后,可抑制T 细胞的激活,从而起到免疫抑制的作用。
然而,肿瘤细胞可利用这一抑制性通路,诱 导 PD-L1 在其表面表达,从而起到抑制T细胞的作用,实现免疫逃逸。阻 断 PD- 1和PD-L1 的相互作用可以逆转免疫抑制状态,提高机体免疫细胞对肿瘤细胞的杀伤能力。
目前已有多款针 对 PD-l /P D -L l的治疗性抗体获批上市,并取得了良好的疗效。然而并非所有患者都能从现有的PD-1抗体药中获益,在黑色素瘤治疗中PD-1抗体表现出 50% 左右的缓解率,但对其他实体瘤的总体缓解率普遍较低,约为20 %。
PD-1/PD-L1 小分子抑制剂作为抗体药的补充,目前多处于早期开发阶段,进人临床研究阶段的在研药物有 4 款 (见表1 ) ,进展最快的是C uris公司和 Aurigene公司共同研发的CA-170。

CA-170是一款小分子PD-L1/VISTA双重抑制剂,目前有多项临床研究正在进行中,在研适应证包括淋巴瘤、间皮瘤和非小细胞肺癌等。
在动物实验中,CA-170可明显消除PD-L1 对T细胞的抑制,促进T 细胞分化和增殖,并 诱 导1干扰素(IFN-7 )的产生。CA-170在多种体内肿瘤模型中表现出与PD-1单克隆抗体相似的抗肿瘤活性。
从目前的临床数据来看,CA-170对非小细胞肺癌和霍奇金淋巴瘤的疗效最好,总临床获益率( clinical benefit rate,CBR)分别为70%和77.8%,而且CA-170低剂量组(400 mg •(T1) 的疗效优于髙剂量组(800 mgcT1)。
此外,CA-170在生物安全性方面优于PD-1单克隆抗体,在剂量高达1200rngd -1时耐受性良好INCB486550由Incyte公司开发,是一款口服PD-L1 抑制剂,用于晚期实体瘤的治疗,在研适应证包括非小细胞肺癌、尿路上皮癌、肾细胞癌、肝细胞癌和黑色素瘤。
2019年4月,公司在美国癌症研究协会(American Association for Cancer Research,AACR)年会上公布了 INCB486550的体外研究数据,其在细胞中可诱导 PD-L1 二聚化并减少细胞表面的PD-L1。2020年10月,公司启动了一项开放标签、非随机的II期临床试验(NCT04629339),旨在评估INCB486550作为免疫检查点抑制剂治疗实体瘤患者的安全性和有效性。
2.2 STING激动剂
STING是锚定在内质网上感受外源 DNA人侵的重要衔接蛋白。STING作为参与固有免疫反应的关键信号转导分子,主要通过环鸟苷酸-腺苷酸 合 成 酶 ( cyclic GMP-AMP synthase,cGAS)-STING信号通路在病毒感染、自身免疫性疾病和肿瘤免疫治疗中发挥重要作用。
cGAS识别胞质内的 D N A后 发 生 二 聚 化 ,催化三磷酸鸟苷(GTP) 与 A T P 反 应 生 成 2 ’3’-环鸟苷酸-腺苷酸(cyclic GMP-AMP, cGAMP) ,随之激活 STING 蛋白,导致STING构象发生变化。
随后,STING运用囊泡转运系统实现内质网向髙尔基体的转运,在高尔基体招募 TANK 结合激酶 1 (TANK binding kinase 1,TBK1) ,从而激活干扰素调节因子3(interferon regulatory factor IRF-3),诱 导 I 型干扰素的产生,并调控抗肿瘤固有免疫应答。
当前,调 节 cGASSTING信号通路已成为针对肿瘤及自身免疫性疾病等多种疾病的重要免疫治疗新策略,STING调节剂也成为继PD-1/PD-L1 等免疫检查点抑制剂之后极具 潜 力 的 肿 瘤 免 疫 治 疗 药 物 之 一 。
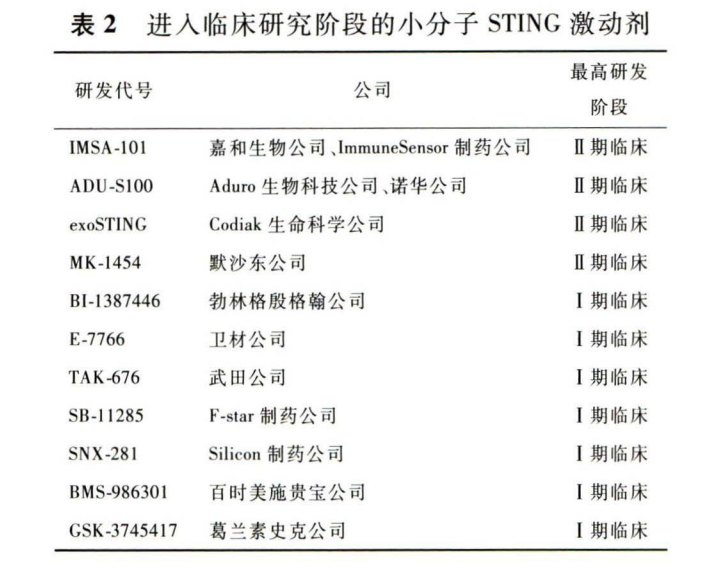
目前,STING激动剂类抗肿瘤药物开发取得了较大的进展,进人临床研究阶段的小分子STING激动剂有 11款,进 展 较 快 的 4 款 在 研 药 物 分 别 为 IMSA-101,ADU-S100, exoSTING 和 MK-1454(见表 2 )。
从分子结构来看,目前在研的STING激动剂主要可以分为 5 类 ,分别为环状二核苷酸类 、氨基苯并咪唑类 、咕吨酮类和吖啶酮类、苯并噻吩类以及苯并二茂类。
ADU-S100最初由Aduro生物科技公司研发,后授权给诺华公司联合研发,是一款环状二核苷酸类免疫调节剂,采用直接瘤内注射的方式给药,既可作为单一药物,也可与细胞毒性化疗、靶向治疗或检查点抑制剂联合使用,目前正在进行针对转移性头颈癌和鱗状细胞癌的II临床试验(NCT03937141 )。
在临床前研究中,ADU-S1 0 0表现出了 一定的异位效应 ,即使局部给药,ADU-S100对未直接给药的肿瘤也可能产生远程作用。
小鼠实验数据表明,ST1NG激动剂的剂量对抗肿瘤免疫效果至关重要,低剂量的 ADU-S100处理可以诱导持久的CD8+ T 细胞免疫应答,而高剂量的ADU-S100处理很可能诱导CD8+ T细胞凋亡,损害持久的免疫应答。M K -1454是由默沙东公司开发的环状二核苷酸类 STING激动剂,拟用于转移性实体瘤、淋巴瘤或头颈部鳞状细胞癌的肿瘤内治疗。
2020年3月 ,公司启动了一项II期临床试验(NCT04220866),旨在评 估 M K-1454联合帕博利珠单抗(pembrolizumab)在一线治疗转移性或不可切除复发性头颈部鱗状细胞癌患者中的疗效。
2.3 IDOl 抑制剂
色氨酸(L-tryptophan, L-Trp)代谢的犬尿氨酸途径在免疫调节过程中具有重要作用。该途径的第一步也是限速步骤,由 ID01,ID02和色氧酸2 ,3-双加氧酶( tryptophan 2,3-dioxygenase,TD0 )催化。
1D01,ID0 2和 TD0 虽然都催化相同的生化反应,但三者在结构、组织分布和底物特异性上表现出明显的不同。ID01在肿瘤细胞和APC中存在过度表达现象,为肿瘤细胞创造一个免疫抑制微环境,从而逃避有效的免疫应答。
TD0 也具有类似的免疫抑制作用,但主要在肝癌中异常表达。而 ID0 2催化 L-T rp代谢的活性极低,在病理状态下也基本不存在异常表达现象,目前其是否与肿瘤免疫反应相关仍存在争议。
在动物肿瘤模型中,基因或细胞水平上的ID01 抑制可激活抗肿瘤免疫反应。近年来,ID0 1 单靶点抑制剂和 ID01/TD0双靶点抑制剂被认为是有潜力的抗肿瘤小分子免疫疗法之一。
目前,进人临床研究阶段的小分子ID01抑制剂有7 款,ID01/TD0 双靶点抑制剂有 3 款 ,研发进展相对较快的在研药物为 linrodostat, epacadostat 和 indoximod(见表 3 )。

linrodostat是由百时美施贵宝公司开发的一款口服ID0 1 抑制剂,主要拟用于膀胱癌和黑色素瘤的治疗。目前,linrodostat联合纳武利尤单抗(nivolumab)用于晚期黑色素瘤的Ⅲ期临床试验(NCT03329846 ),以及评估linrodostat联合新辅助化疗 和 nivolumah用于治疗膀胱癌的Ⅲ期临床试验(NCT03661320)都在进行中。
epacadostat是 由 Incyte公司研发的N-经基脒类选择性 ID0 1 抑制剂,是目前研究最为深人的色氨酸竞争性ID0 1 抑制剂之一,在研适应证包括非小细胞肺癌、结直肠癌、胰腺导管腺癌、胶质母细胞瘤、肉瘤等。
epacadostat对 ID0 1 的作用具有高度选择性,在细胞内抑制ID0 1 的半数有效浓度对ID0 2 和TDO的抑制作用很弱。epacadostat在喷齿类动物的黑色素瘤模型中显示出有效性,并且在临床前毒理学研究中耐受性良好。
然而 ,2018年 4 月,epacadostat 与 PD-1 单抗帕博利珠单抗联合治疗转移性黑色素瘤的Ⅲ期临床试验(ECHO-301/KEYNOTE-252)宣告失败,联合用药相比帕博利珠单抗单药并未改善患者的无进展生存期(PFS)和总生存期(〇S)。
随后,针对联合用药,公司停止了正在进行的针对肾癌、膀胱癌和头颈癌Ⅲ期临床试验的招募,并将正在进行的非小细胞肺癌Ⅲ期临床试验转为Ⅱ期临床试验。
尽管ID01抑制剂的开发进程并不顺利,但 epacadostat等药物的临床试验数据给未来 ID01抑制剂的研发积累了丰富的经验和教训,包括潜在生物标志物的挖掘、药物剂量的调整、肿瘤类型的选择以及临床试验方案的设计等。
此外,TD0 和 ID01 在某些肿瘤中的表达是重叠的,TDO抑制剂和ID01/TD0 双重抑制剂也是未来探索的方向之一。
目前还没有选择性TDO抑制剂进人临床研究,有 3 个 ID01/TD0 双重抑制剂在开展临床I 期试验,均由中国制药公司研发,分别为山东绿叶制药公司研发的LY41013、上海迪诺医药公司研发的DN-14006131以及江苏恒瑞医药公司研发的 SHR-9146。
2.4 A2AR 拮抗剂
腺苷是一种免疫抑制代谢物。在肿瘤微环境中,腺苷通过作用于免疫细胞上表达的 A2A R 而起到免疫抑制作用,使肿瘤细胞发生免疫逃逸,无法被免疫细胞杀伤。
CD39-CD73-A2AR通路是腺苷调节免疫应答的关键通路。Treg表达胞外核苷酸酶(CD73,CD3 9 ) ,二者作为催化腺苷产生的关键酶,可通过协同作用水解组织中的A TP形成腺苷,从而提高肿瘤微环境中的腺苷水平,增强上述途径导致的肿瘤免疫逃逸。
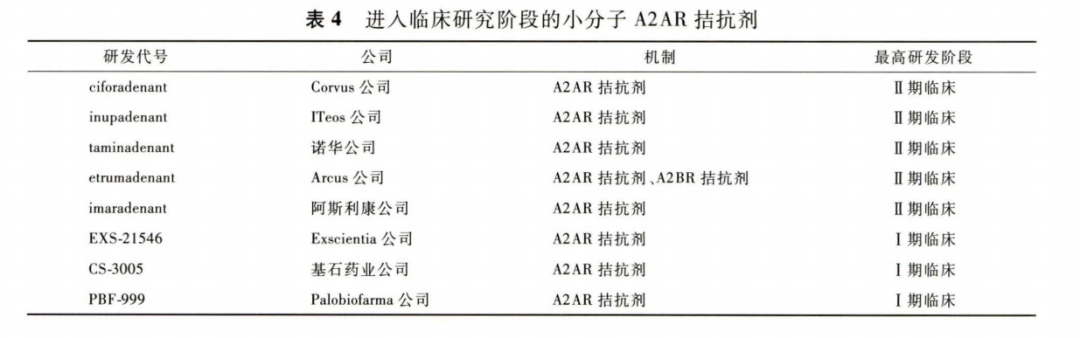
因此CD39,CD7 3 和A2A R都有望成为抗肿瘤免疫疗法中潜在的药物靶点。目前,进入临床研究阶段的用于肿瘤治疗的A2A R诘抗剂有 8 个 ,进展最快的是Corvus公司研发的ciforadenant(见表 4 )
此外,iTeos公司研发的inupadenant、诺华公司研发的taminadenant、阿斯利康公司研发的im aradenant以 及 A rcus公司研发的etrumadenant都已进入II期临床研究阶段。
ciforadenant最初由 Vernalis公司研发,后授权给 Corvus公司,是针对晚期实体瘤的潜在口服疗法。目前,公司正在积极探索ciforadenant单药或联用 PD-L1单抗、CD73单抗、CD3 8单抗的抗肿瘤效果 ,在研适应证包括肾细胞癌、非小细胞肺癌、前列腺癌、乳腺癌、黑色素瘤、结直肠癌等。
在小鼠实验中,ciforadenant与 抗 PD-L1 抗体或抗 CTLA~4抗体联用表现出良好的抗肿瘤效果,而 且 ciforadenant可以诱导系统性抗肿瘤免疫记忆。
2018年1月,公司启动了一项针对非小细胞肺癌患者的Ib/Ⅱ期临床试验(NCT03337698),用于评估多种免疫疗法联合治疗的安全性和有效性。
2 0 2 0年 9 月,公司在欧洲肿瘤内科学会( European Society for Medical Oncology, ESM0) 年会上 (线上会议) 公布了该试验的部分研究数据。ciforadenant和阿特珠单抗(atezolizumab)联合治疗组的中位OS为 11.5个月,而多西他赛对照组为9. 4 个月。
此外,联合疗法组显示了良好的安全性,接 受 ciforadenant和 atezolizumab联合治疗的患者没有发生5 级不良事件或导致停药的不良事件,而接受多西他赛化疗的患者中,1 例发生5 级不良事件,3 例发生不良事件导致停药。
此外,在一项纳人6 8名肾细胞癌患者的 I 期临床试验(NCT02655822 )中,ciforadenant可以在体内安全阻断腺苷信号;ciforadenant单药治疗组中,17 % 的患者达到病情稳定(SD)并持续至少 6 个月,中位PFS为 4. 1 个月;接 受 ciforadenant与阿特珠单抗的患者中,3 9 % 的 患 者 达 到 SD 并 持 续 至 少 6 个月,中位PFS 为 5.8 个月。
CS3005是由中国制药公司基石药业开发的一种 A2A R拮抗剂,可通过阻断腺苷和其A2A R结合,进而逆转腺苷的免疫抑制作用,激活免疫反应并提高对免疫检查点抑制剂的响应率。
CS3005将与其他药物(如 抗 PD-1单抗、蛋白酶体抑制剂等)联用,用于晚期实体瘤的治疗,目前处于治疗实体瘤的I期临床研究(NCT04233060)。
2.5 趋化因子受体抑制剂
趋化因子受体是表达在免疫细胞、内皮细胞和肿瘤细胞上的一类G 蛋白偶联受体(GPCRs)。抑制趋化因子受体可阻止巨噬细胞浸润,并可诱导肿瘤生长停滞或凋亡。
到目前为止,大约有20 个趋化因子受体和50 个配体被文献报道。有望成为肿瘤免疫小分子药物靶点的趋化因子受体主要包括CXC趋化受体因子(CXCR)2,CXCR4, C C趋化受体因子(C C R )2,C C R 4以 及 CCR5。
目 前 C X C R 1/2桔 抗 剂 SX-682, C X C R 2拮抗剂AZD5069,CXCR4 枯抗剂 mavorixafor,CCR5 诘抗剂maraviroc,CCR2/5 拮抗剂 BMS-813160 以及 CCR4抑制剂FLX 475正在作为单药或者联合免疫检查点抑制剂进行临床开发(见表5 )。

CXCR4 通常在多种实体瘤和造血系统恶性肿瘤中被激活,其通过与人趋化因子CXC配体12(CXCL12)结合来介导细胞的趋化作用,CXCR4/CXCL12途径可以促进T reg和髓源性抑制细胞向肿瘤微环境募集,并促进上皮间质转化、侵袭、转移和肿瘤血管形成。
CXCR4 措抗剂 mavorixafor最初由健赞公司研发,后授权给X4 制药公司,目前正在进行治疗罕见病WHIM综合征(疣 ,低丙种球蛋白血症,细菌感染以及无效生成性慢性粒细胞缺乏的ES,warts-hypogammaglobulinemia-infections myelokathexis syndrome, WHIM ) 的 IE 期临床试验(NCT03995108);治疗转移性肾透明细胞癌(与纳武利尤单抗联用,NCT02923531 ;与阿昔替尼联用 ,NCT02667886 ) 和淋巴瘤(与依鲁替尼联用,NCT04274738)的 II期临床试验;以及治疗嗜中性粒细胞减少症(NCT04154488)和黑色素瘤(与帕博利珠单抗联用,NCT02823405)的 I 期临床试验。
SX-682 是由 Syntrix Biosystems 公司研发的一种CXCR1 / 2双重抑制剂,在研适应证包括黑色素瘤、胰腺导管腺癌、结直肠癌、骨髓增生异常综合征等。
2019年1月,公 司 启 动 了 一 项Ⅰ/ Ⅱ期临床试验(NCT03161431 ),以测试SX-682作为单一药物或与帕博利珠单抗联用治疗黑色素瘤的安全性和有效性。
有研究表明,SX-682会增加/M S 突变肿瘤细胞对 PD -1抗体治疗的敏感性。2020年10月,公司又启动了一项I / II期临床试验(NCT04599140),拟评 估 SX-682单药或联合纳武利尤单抗治疗/M S突变微卫星稳定(MSS)转移性结直肠癌患者的安全性和有效性。
CCR5拮抗剂 maraviroc早 在2007年就获得美国 FDA批准上市,用于艾滋病的治疗。该药联合帕博利珠单抗治疗难治性MSS型转移性结直肠癌的I期临床研究(NCT03274804 )正在进行。
BMS-813160 作为 CCR2/CCR5 双重拮抗剂,正在被百时美施贵宝公司开发用于晚期实体肿瘤的口服治疗,在研适应证包括转移性结直肠癌、胰腺癌、胰腺导管腺癌和非小细胞肺癌等。
CCR4 桔抗剂 FLX4 7 5 由韩美制药和RAPT Therapeutics公司联合开发,通过抑 制 T regs的迁移发挥抗肿瘤作用,在研适应证包括胃癌、淋巴瘤、鼻咽癌、宫颈癌、乳腺癌和非小细胞肺癌等。
2.6 其他小分子肿瘤免疫药物
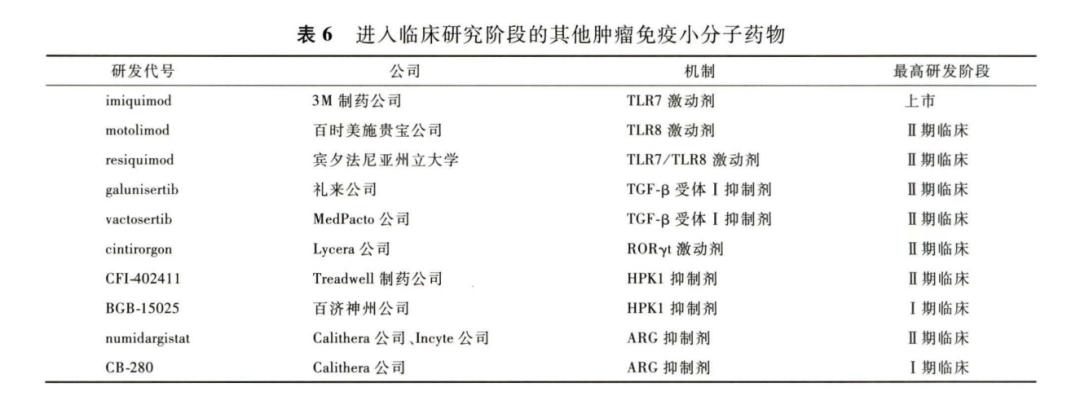
除上文介绍的在研药物以外,还有一些研发相对深入的小分子肿瘤免疫疗法,包 括 TL R激动剂、TGF-p 抑制剂、RORγt激动剂、造 血 祖 细 胞 激 酶 1 ( hematopoietic progenitor kinase 1,HPK1)抑制剂以及ARG抑制剂等(见表6 )。
TLR是一种I 型跨膜蛋白,可以介导天然免疫反应。目前针对肿瘤免疫治疗进人临床研究的TLR激动剂主要为TLR7 和 TLR8 激动剂,二者主要是通过介导树突细胞和自然杀伤细胞的活化,抑制Treg的活化来发挥其抗肿瘤作用。
imiquimod作为TLR7 激动剂,已 被 FD A批准用于外生殖器疣和基底细胞肿瘤的治疗。目前该药联合帕博利珠单抗治疗黑色素瘤的I 期临床试验(NCT03276832)正在进行中。motolimod和 resiquimod也在很多临床前研究中显示出明显的免疫刺激活性,目前正在进行临床开发。
TGF-p 是一种多功能细胞因子,TGF-p 的异常表达与肿瘤进展、血管生成、转移以及免疫逃避密切相关。研究表明,TGF-p 信号通路在肿瘤免疫逃逸和免疫检查点抑制剂治疗耐药中起着关键作用。
galunisertib 和 vactosertib 是 TGF-p 受体 I 抑制剂,目前正在作为单药或联合PD-1/PD-L1 抗体药进行临床试验,用于肿瘤治疗。
此外,研究发 现 ARG,R0 R7t 以 及 HPK1 也在肿瘤免疫过程中起到重要作用,ARG抑制剂通过阻断精氨酸分解代谢途径增强肿瘤环境中的免疫功能,RORV激动剂可以激活Thl7 和Tcl7 细胞产生抗肿瘤作用,HPK1抑制剂可以降低T 细胞的耗竭,产生抗肿瘤效应。
总结与展望
肿瘤在发生发展过程中会通过一系列“免疫逃避机制”来对抗免疫反应,这种机制通常会在晚期肿瘤中变得更加多样化和复杂化。
近年来,针对“免疫逃避机制”的肿瘤免疫疗法取得了突破性的进展,彻底改变了人类对抗肿瘤的格局。尽管PD-1/PD-L1,CTLA4 等免疫检查点抑制剂在黑色素瘤、淋巴瘤、非小细胞肺癌、肝细胞癌、胃癌等众多肿瘤中显示了出色的疗效,但该领域还存在着较多问题和挑战。
已上市的肿瘤免疫抗体药仅对有限的肿瘤类型产生疗效,整体有效率还有待提高。肿瘤免疫小分子药物凭借良好的口服生物利用度、组织渗透性以及可控的免疫相关不良反应等优点应运而生。
目前,有众多小分子免疫疗法已进人临床开发阶段,可作为单一疗法或与抗体药、传统化疗药相结合,进一步提高抗肿瘤疗效或改善检查点抑制剂耐药问题。
这些小分子疗法有多数已在早期临床试验阶段显示出良好的安全性和有效性。然而,IDOl抑制剂与帕博利珠单抗联用治疗黑色素瘤Ⅲ期临床试验的重大失利,也从侧面提示研究人员未来应该更加深入地探索肿瘤免疫机制,挖掘可靠的生物标志物以及临床设计方案。小分子肿瘤免疫疗法作为治疗性抗体药的补充,其研发道路充满挑战,但也充满希望。

 产业资讯
产业资讯
 清科研究
清科研究  2025-08-02
2025-08-02
 30
30

 产业资讯
产业资讯
 空之客
空之客  2025-08-02
2025-08-02
 33
33

 产业资讯
产业资讯
 医药魔方
医药魔方  2025-08-02
2025-08-02
 33
33