 产业资讯
产业资讯
 医药经济报
医药经济报  2023-01-12
2023-01-12
 2648
2648
卫材/渤健公司日前共同宣布美国FDA通过加速审批途径批准其阿尔茨海默病新药lecanemab-irmb(Leqembi)上市。
阿尔茨海默病是老年人中最常见的神经退行性疾病,Leqembi是近年来靶向淀粉样蛋白的第二款创新阿尔茨海默病疗法。
此前,同为渤健/卫材研发的近20年来首个获批的、基于Aβ假说的Aduhelm,遭遇了限制使用、销售惨淡、企业裁员、高管离任等一系列挫折;美国FDA前不久也因为Aduhelm审评审批行为,受到美国国会的调查。如今,Aduhelm的尴尬处境依然没有得到缓和。
本次获批的Leqembi,也被市场寄予厚望,美国FDA曾授予此疗法快速通道资格、优先审评资格、突破性疗法认定。然而,围绕产品的疗效,以及安全性和支付价等情况,自产品获批以来同样备受市场关注和热议。
本次Leqembi上市,是否可能给阿尔茨海默病治疗药物带来研发和市场转折?
AD再迎新药
27%的改善=2.6万美元?
AD 标志性特征是患者大脑中的β淀粉样蛋白(Aβ)沉积,Aβ假说(β淀粉样蛋白过度生成并聚集成淀粉样斑块)被认为是 AD 病理生理的始动环节。
Leqembi为抗β淀粉样蛋白(Aβ)抗体,能与可溶性和难溶性Aβ聚合体结合,并且促进它们的清除,具有改变疾病病理,缓解疾病进展的能力,以达到治疗阿尔茨海默病的目的。
本次FDA的加速批准基于IIb期概念验证性临床试验 (BAN2401-G000-201)结果,研究共纳入856例存在轻度认知障碍 (MCI)并经证实存在淀粉样蛋白病变的早期AD患者。
试验结果显示,治疗18个月时,每两周1次Leqembi(10mg/kg)使脑淀粉样蛋白减少0.306SUVr单位(基线平均值为1.37)。通过视觉读数,超过80%的受试者淀粉样蛋白呈阴性。并且淀粉样蛋白减少的程度与ADCOMS、CDR-SB和ADAS-cog的临床下降更慢相关。即接受Leqembi治疗患者的淀粉样蛋白呈现剂量与时间相关下降,相较之下,安慰剂组患者的淀粉样蛋白水平则维持不变。
此外,在2022年年底召开的阿尔茨海默病临床试验大会上,卫材/渤健公布了临床 III 期研究结果,Leqembi达到了研究的主要和次要终点,并显著减缓了早期阿尔茨海默病患者的病情进展。
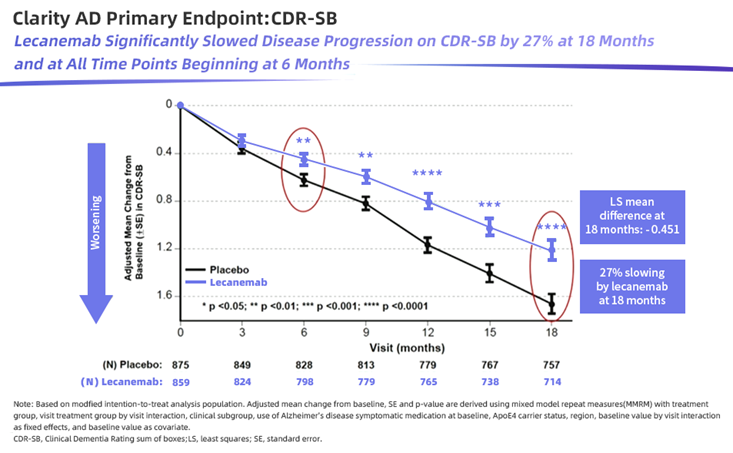
III 期试验数据表明,与安慰剂组相比,Leqembi治疗在 18 个月时显示出统计学差异。其在临床上显示出更低的认知和功能量表结果数据,受试患者认知和功能下降减少了 27%(CDR-SB评分越高意味着患者临床功能越低),并在18个月里将淀粉样蛋白沉积水平降低约70%。
并且Leqembi受试组患者病情在 25.5 个月时约与安慰剂组在 18 个月时的病情相同,这说明该药物将病情进展减缓了 7.5 个月。
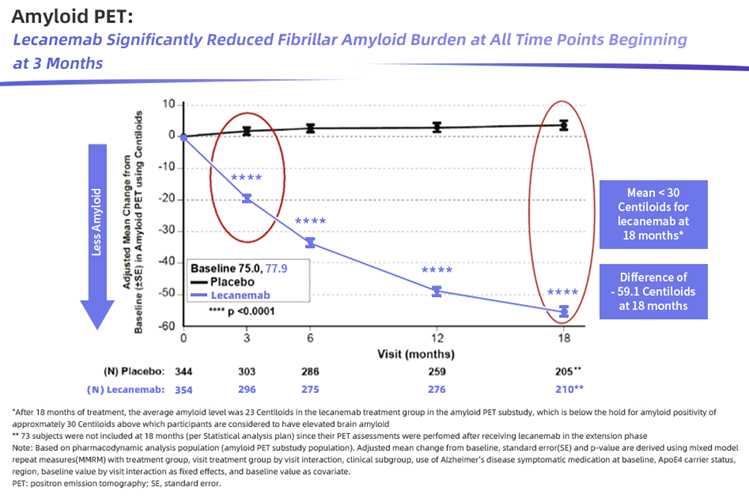
对此,业内质疑,Leqembi仍然是基于Aβ假说,但Aβ假说本身依然存在很多未知,以及多重其他假说致病机理始终无法明确。因此,有观点认为,Aβ靶向抗体作为AD 新药开发的重要方向,存在很大的不确定性。此外,Leqembi带来的27%改善,对阿尔茨海默病患者的意义有多大,依然有待在真实世界的临床治疗中进行长期观察。
实际上,专家们对Leqembi持谨慎态度,很大程度上源于 Aduhelm的遭遇。
2021年6月,美国 FDA 加速批准了Aduhelm上市,尽管几乎没有证据表明它确实能减缓AD的发展,没有委员会成员投票赞成,且专家们对药物临床数据不一致提出了担忧。对此,FDA 专家会的几名专家公开辞任以示抗议。批准当月晚些时候,国会两个委员会宣布启动对 FDA 加速批准 Aduhelm 决定的调查。
去年年底,美国众议院监督和改革委员会和能源与商业委员会在对FDA关于阿尔茨海默药Aduhelm的监管审评和批准程序以及渤健对Aduhelm的定价进行了为期18个月的调查,并且发布了一份46页的工作人员报告。

该报告揭示了以下信息:
FDA与渤健的互动是非典型的,没有遵循该机构自己的文件协议。
FDA和渤健在一个关键咨询委员会的联合简报文件中合作不当。
FDA在一个大大缩短的时间表上转向使用Aduhelm的加速审批途径。
FDA批准,渤健接受了Aduhelm的广泛标签适应症,尽管缺乏所有阿尔茨海默病阶段的临床数据,渤健也持保留意见。
渤健最初为Aduhelm设定了一个不合理的高价,每年5.6万美元,为公司“创造历史”,尽管对患者和医疗保险计划有影响。
渤健预计Aduhelm将成为医疗保险的负担,给患者带来高昂的费用。
另一方面,过于昂贵的价格也是大众争议之一。根据卫材消息,经过对多因素的考量和估算,Leqembi在美国的定价为 2.6万美元/年。
加州大学旧金山分校神经外科名誉教授John Forsayeth博士对此持怀疑态度。Forsayeth在一次采访中说:“我不认为为了27%的改善而花那么多钱符合医疗保健系统的利益。”
此前Aduhelm就因5.6万美元/年的过高定价一直备受争议,尽管在当年12月份,渤健便将Aduhelm在美国的批发价格削减一半。
市场分析,2022年6 月,卫材发布分析得出的结论是Leqembi的成本效益在每年1万美元至 3.5万美元之间,似乎就在为本次定价做了铺垫。不过,2.6万美元/年的定价,仍然十分昂贵。
前不久,非营利组织美国临床与经济评价研究所(ICER)发布报告,根据Leqembi目前已经发布的临床试验结果,基于可量化改善生活质量的价值指标,每年的产品价格应在8500美元至20600美元之间。
安全性引担忧
AD研发如何攀越“山峰”?
在Leqembi的有效性和经济性之外,药物安全性也是药物价值的重要考评指标之一。无论是Leqembi在临床试验阶段,还是本次获批上市,产品的安全性始终是引人关注的话题。
2022年12月21日,《Science》报道了Leqembi在临床试验中出现的第三例死亡案例,这名79岁妇女在接受Leqembi治疗后出现大面积脑肿胀、出血以及癫痫发作后于9月中旬死亡。

根据该名患者的医疗记录,除了早期阿尔茨海默症的迹象外,没有明显的健康问题。在为期18个月的试验期间内,该女性是否接受了抗体输注或安慰剂输注尚不清楚,但她确实在延长期6周内服用了药物,在延长试验开始前,脑部扫描显示有一些微出血的迹象。
实际上,这并不是个案,2022年10月28日,STAT报道了Leqembi临床中出现的第一例死亡;2022年11月27日,Science报道了Leqembi临床中出现的第二例死亡。
对此,企业方面也发表过声明回应,根据个别病例得出的结论是不恰当的,卫材强调该试验中的前两例死亡病例与lecanemab本身无关。其中一个死亡发生在一名房颤患者身上,该患者正在服用抗凝剂阿哌沙班。

另一个案例,企业方面回应指出:“虽然t-PA似乎是死亡的近因,但这是一个不寻常的病例,我们理解作者为什么要强调一个潜在的问题。这些报道与已知的‘脑淀粉样血管病’患者脑出血风险增加相一致。"
2022年12月30日,《Science》表示,渤健的开发合作伙伴卫材更新了Clarity AD III期试验的同意书,警告参与者将lecanemab与血栓药物联合使用可能导致致命的脑出血。
值得一提的是,去年12 月底,Leqembi用于治疗阿尔茨海默病的上市申请已获中国 NMPA 受理,但同时发生在药物身上的争议,也让产品未来在中国市场的前景充满变数。
目前,罗氏、礼来等企业,仍然在围绕阿尔茨海默病药物进行着临床探索,对于渤健/卫材而言,新药获得美国FDA批准,毋庸置疑是一个重要的里程碑,在可以预见的未来,产品也将面临更多的市场考验。
随着人口老龄化问题日益加剧,老年人罹患AD的可能性与危害性大大增加,我国则是新发病例全球增速最快的国家之一。值得肯定的是,Leqembi作为确实给AD患者带来有益改善的新药,其上市或将改变既往用药困局。

 产业资讯
产业资讯
 药渡
药渡  2025-11-07
2025-11-07
 58
58

 产业资讯
产业资讯
 药时代
药时代  2025-11-07
2025-11-07
 68
68

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-11-07
2025-11-07
 59
59