 研发追踪
研发追踪
 药明康德
药明康德  2023-02-13
2023-02-13
 3058
3058
今日Sage Therapeutics和渤健(Biogen)共同宣布,其潜在重磅药物zuranolone(SAGE-217/BIIB125)的新药申请(NDA)已获FDA接受并授予优先审评资格,用以治疗抑郁症(MDD)及产后抑郁症(PPD)。FDA预计于2023年8月5日前完成审查。根据渤健官方新闻稿,zuranolone是一款基于创新机制的抑郁症药物,具在14天快速缓解抑郁症状的潜力,这与市面上大部分抑郁药物需要约6-8周才能见效不同。
没有良好的精神健康状态,就谈不上真正的健康。目前,全球范围内约每8人中就有1人罹患精神疾病。其中,抑郁症是最常见的精神疾病之一,全球约2.8亿患者。与此同时,近2/3抑郁症患者无法从现有疗法中获得充分缓解。这反映出以抑郁症为代表的精神卫生问题面临着严峻的未满足治疗需求。PPD是妊娠期间和妊娠后最常见的并发症之一。PPD可能给女性带来严重的负面影响,包括严重的功能障碍、情绪低落和/或对新生儿失去兴趣,以及相关的抑郁症状,如食欲不振、睡眠困难、运动障碍、注意力不集中、精力不足和自尊心差。
尽管已有多款抗抑郁药物上市,但既往大量药物主要通过影响单胺类神经递质(如5-羟色胺、去甲肾上腺素、多巴胺)的信号传递而发挥作用,这类药物通常需要较长时间才能看到具有临床意义的应答,而且大多数患者治疗后未能获得足够的缓解。
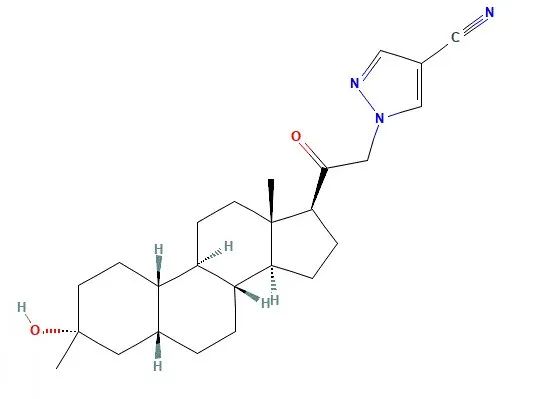
▲Zuranolone分子结构式(图片来源:PubChem)
Zuranolone(SAGE-217/BIIB125)是一种每日一次、为期两周的在研疗法,设计用于治疗MDD和PPD。它是一种口服神经活性类固醇γ-氨基丁酸A型(GABAA)受体阳性别构调节剂。GABA系统是大脑和中枢神经系统(CNS)的主要抑制性信号通路,对调节CNS功能有重要作用。Zuranolone靶向的是负责情绪、唤醒、行为和认知等功能的大脑网络。在MDD患者中,它可能有助于快速重新平衡失调的神经元网络,以帮助恢复大脑功能。Zuranolone已被FDA授予了治疗MDD的快速通道资格和突破性疗法认定,并获得了治疗PPD的快速通道资格。
Zuranolone的上市申请包含来自LANDSCAPE、NEST临床项目,以及另一项临床2期试验数据。其中,LANDSCAPE项目包括了5项针对MDD成年患者的研究(MDD-201B、MOUNTAIN、SHORELINE、WATERFALL和CORAL),NEST项目包括了2两项针对PPD成年女性患者的研究(ROBIN和SKYLARK)。
在针对MDD的研究中,此前公布的关键性3期临床试验WATERFALL的结果显示,在第15天时,通过17项汉密尔顿抑郁量表(HAMD-17)评估,与安慰剂相比,zuranolone使患者抑郁症状获得统计显著且具有临床意义的减轻(p=0.0141)。试验过程中观察到zuranolone快速起效,并表现出与既往临床研究一致的安全性特征。此前公布的纵向开放标签SHORELINE试验的结果显示,zuranolone的疗效具有持续性,有潜力作为根据需要才服用的抑郁症药物。在针对PPD患者的SKYLARK试验中,zuranolone达成主要终点以及所有的关键次要终点。试验参与者在第3天开始便有快速与显著的抑郁症状改善,并一直持续至第45天。
“我们看见zuranolone的潜力。若获批,这将成为具有意义的新治疗选项,帮助受MDD与PPD所苦的各式病患群体解决其严重的未竟医疗需求,”渤健的执行副总裁、研发负责人兼研究与全球安全与监管暂时负责人Priya Singhal博士说道,“FDA接受我们的申请并授予优先审评资格是渤健与我们合作伙伴Sage致力推动抑郁症治疗任务上的一项重要里程碑。”
虽然成千上万个病患及家庭对于抗精神病新药有着迫切需求,但新药的开发一直面临着种种挑战。而抗精神病新药难以开发的部分原因是对这些疾病的基本病理以及患者对治疗的反应了解不足。此外,这些疾病本身具有较强的异质性,它们在不同人身上往往有着不同的表现。然而随着生物医学界对精神疾病研究的深入,目前至少有163种药物正处于临床研究阶段,其适应症覆盖了一系列的精神疾病。这次zuranolone上市申请获FDA接受并授予优先审评资格更是此领域的一项重要进展,让我们期待更多创新的精神疾病药物能够早日问世,以造福广大受抑郁症等精神疾病所苦的患者,改善他们的生活!

 研发追踪
研发追踪
 医药魔方Info
医药魔方Info  2025-04-28
2025-04-28
 264
264

 研发追踪
研发追踪
 细胞基因治疗前沿
细胞基因治疗前沿  2025-04-28
2025-04-28
 266
266

 研发追踪
研发追踪
 药视点
药视点  2025-04-28
2025-04-28
 272
272