 产业资讯
产业资讯
 生物制药小编
生物制药小编  2023-02-23
2023-02-23
 3923
3923
尽管 ADC药物已经大大改善了患者的生存益处。然而,与大多数细胞毒药一样,由于耐药机制的出现,ADC作为单一疗法产生的客观反应或临床益处的持续时间是有限的。因此,近年来,ADC与包括化疗、分子靶向药物和免疫治疗在内的其他抗癌药物联合的临床前和临床试验正在进行积极的研究(图1)。
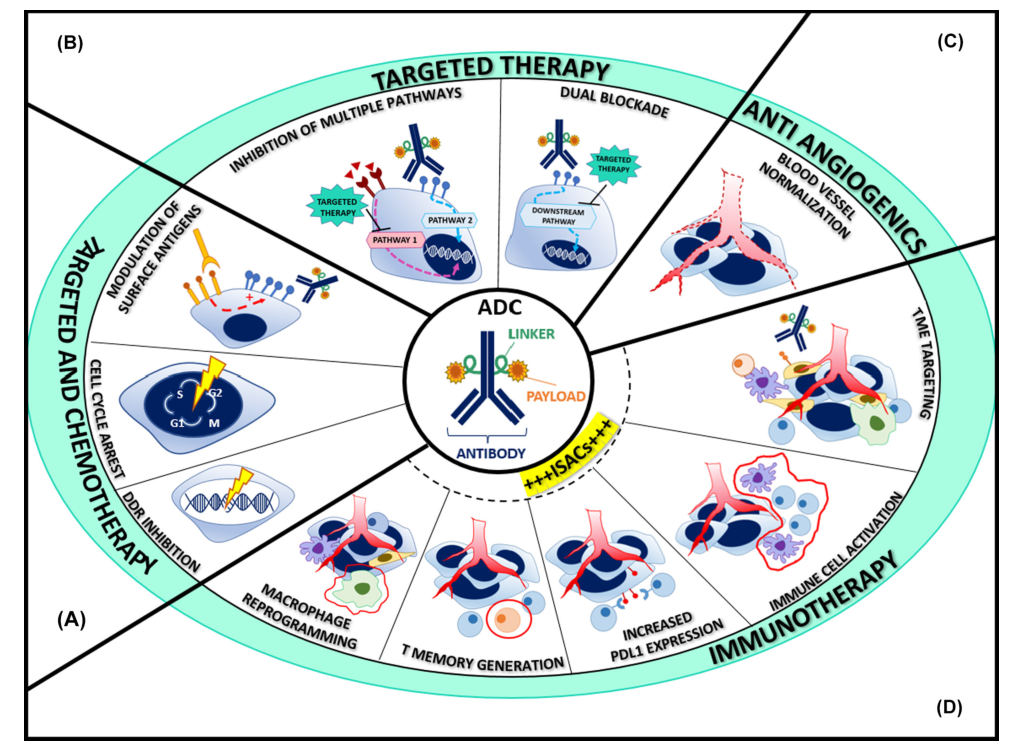
图1. ADC药物联合疗法的基本原理
ADC最有吸引力的联合药物伙伴是那些对肿瘤细胞或其微环境提供相加或协同作用而无不可接受的叠加毒性。图2总结了已经在临床试验中测试或目前正在研究中的联合方案。ADC药物与抗血管生成抑制剂、靶向药物、DNA损伤反应剂和免疫检查点抑制剂(ICIs)联合应用近年来研究最多。本文就近些年的ADC的联合用药策略做一个简要介绍。
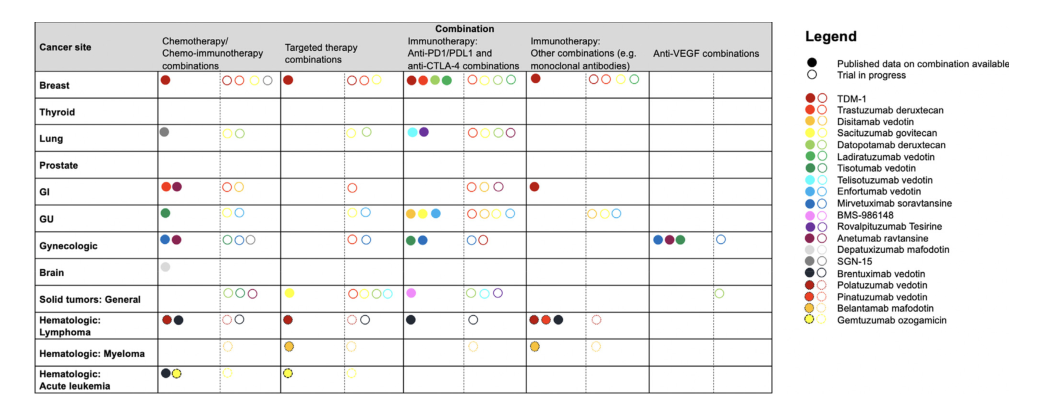
图2. 已公开或正在开发的基于ADC的联合治疗
ADC与化疗的联合
ADC与化疗药物的联合需要更好地了解独特的细胞周期相互作用和细胞毒伙伴对表面抗原表达的调节。到目前为止,越来越多的临床前和临床数据显示出了一定的成功,这为进一步的药物开发指明了方向。
细胞周期相互作用
作用于S期并导致G2/M期停滞的DNA损伤剂(如抗代谢药、铂类和拓扑异构酶抑制剂)可适当地与微管抑制剂结合,其效果在G2/M期最好。这一概念在卡铂与mirvetuximab soravtansine (FRα-DM4)、anetumab ravtansine(mesothelin-DM4)或luveltamab tazevibulin (FRα–SC239)联合在卵巢癌模型获得优异的疗效而得到印证。
在早期试验中,基于ravtansine的ADC与卡铂或阿霉素联合治疗对铂敏感和耐药的卵巢癌,基于deruxtecan的ADC与capecitabine或顺铂联合治疗胃癌和肺癌,也均取得了显著的应答率。
对于血液瘤,代表性的例子有,brentuximab vedotin(CD30- MMAE)联合CHP(cyclophosphamide, doxorubicin和 prednisone)治疗 CD30+外周T细胞淋巴瘤;Polatuzumab vedotin (CD79b–MMAE)联合rituximab-CHP治疗弥漫性大B细胞淋巴瘤。
给药时机的设计
给药时机在联合用药中是需要设计的,微管蛋白聚合是ADC内化所需的关键组成部分,而DNA损伤介导的G2/M期停滞可能需要一段时间才能发生微管干扰物致敏化。
Wahl等人在结肠癌、肺癌和乳腺癌模型中很好地展示了这一点,在这些模型中,顺序给予SGN-15(Lewis Y-doxorubicin)和紫杉醇比同时给药引起更多的DNA片段化。
表面抗原的调节
化疗可能调节ADC靶向的表面抗原的表达。在这方面,在胰腺癌细胞中,吉西他滨已被证明可以上调HER2的表达, 而吉西他滨和T-DM1的联合则增强了疗效。与上述细胞周期相互作用交织在一起,HER2上调主要发生在G2/M群体中,这是吉西他滨介导的DNA合成抑制的结果。
因此,特定的化疗药物可能更适合与ADC联合,这取决于它们增加抗原可用性的能力。这一发现是否在其他ADC-化疗联合中通用,仍需要更多的研究。
重叠毒性
靶向化疗本质上就是化疗,因此联合方案的疗效改善往往会受到不可接受的毒性的阻碍。主要毒性是由细胞毒性有效载荷驱动的。目前ADC携带高度有效的有效载荷,其IC50在nM或pM范围内,主要因为只有不到2%可以到达目标肿瘤部位。具有更高DAR和可切割连接子的ADC可能会引起更高的脱靶毒性。在设计联合策略以及潜在的药代动力学(PK)相互作用和标志性有效载荷毒性时,必须仔细考虑此注意事项。
虽然大多数现有数据在PK相互作用中可以忽略不计,但其中一些反复出现的毒性包括MMAE和DM1衍生物的周围神经病变,MMAF和DM4的眼毒性,DM1或拓扑异构酶抑制剂的胃肠道反应,或Calicheamin衍生物的肝脏毒性,以及几乎普遍的中性粒细胞减少和血小板减少。曲妥珠单抗与多西紫杉醇或紫杉醇联合治疗HER2+晚期乳腺癌的两项2a/b期研究说明了这一点,其中超过一半的患者需要减少剂量或停止使用紫杉烷。
较新的、更具肿瘤选择性的ADC,如mirvetuximab soravtansine和datopotamab deruxtecan,已经显示出较温和的毒性特征,使它们成为具有不同作用机制的化疗的伴侣。在这方面,与参加III期FORWARD I试验的研究人员选择化疗相比,mirvetuximab soravtansine暴露引起的骨髓抑制、周围神经病变减少,并且其与卡铂联合治疗的耐受性相当于标准护理化疗。
总体而言,尽管有新的证据表明ADC和化疗联合的抗肿瘤活性增强,但它们的开发可能仍然需要大幅优化ADC的特性,并需要仔细选择肿瘤类型和化疗伙伴,以确保足够的耐受性。
ADC与靶向药物的联合
与标准化疗相比,ADC的治疗指数有所提高,对选择性肿瘤人群的活性使其有望成为靶向药物的联合伙伴。可以设想联合策略,以克服治疗耐药性和肿瘤异质性,引起对癌基因依赖的信号通路的更强抑制,增加表面抗原的可用性,并使低抗原表达的肿瘤变得敏感,调节TME,并利用合成杀伤。虽然现有的临床数据主要是T-DM1和HER2靶向策略,但这些经验可以外推到其他ADC。
用ADC替代化疗
目前,一些研究试图用ADC替代标准的化疗药物作为靶向药物的伴侣,但结果并不理想。像KAITLIN,KRISTINE和 MARIANNE这样的临床试验,是基于T-DM1联合pertuzumab的临床前协同抗肿瘤活性设计的,但在新的辅助和转移环境中,这种联合并不比紫杉醇、曲妥珠单抗和pertuzumab更有效,特别是在HER2表达较低或HER2异质性较高的患者中。同样,anetumab ravtansine与贝伐单抗联合治疗卵巢癌的疗效也不如紫杉醇。
虽然目前的结果不理想,但这些结果并不代表下一代ADC和联合靶向药也会失败。
酪氨酸激酶抑制剂(TKIs)
通过增加TKI的双靶点阻断可能提供更大的选择性和潜在改善的治疗指数。在TEAL研究中,与标准紫杉醇、曲妥珠单抗和pertuzumab联合相比,在HER2+乳腺癌患者的新辅助治疗中,T-DM1、pan-HER2抑制剂拉帕替尼和nab-紫杉醇的联合产生了更好的反应。这一效果在具有HR阳性的亚组中得到放大。
Tucatinib是一种更具选择性的HER2 TKI,与T-DM1联合使用时,在紫杉烷和曲妥珠单抗先前治疗后的晚期患者中实现了47%的ORR。这些结果刺激了正在进行的T-DM1或T-DXd与tucatinib联合的III期试验(HER2CLIMB-02和HER2CLIMB-04)。
靶向ADC耐药
越来越多的证据支持靶向已知的ADC耐药机制。例如,由于HER2对乳腺上皮细胞的恶性转化依赖于cyclin D1,CDK4/6抑制剂已与T-DM1联合应用于HER2耐药患者,其有效率适中,但毒性可接受。
另一个关键的细胞周期调节因子PLK1最近被确定为获得性和原发性T-DM1模型中上调的靶点,其被volasertib抑制导致T-DM1增敏。
在调节靶向药物的耐药机制时,ADC也可能是有效的伴侣。例如,在EGFR突变的非小细胞肺癌模型中,联合应用EGFR TKIs osimertinib和T-DM1可产生相加的抗肿瘤效应,其中T-DM1能够延缓或克服osimertinib耐药性。
表面抗原的调节
一些TKI已被证明可以调节表面抗原的可用性,潜在地诱导ADC的更强活性,并使低抗原表达的肿瘤增敏。在暴露于BRAF/MEK抑制剂的黑色素瘤细胞系中,AXL上调以及对enapotamab vedotin (AXL–MMAE)的增敏就是例证。
HER2-TKI lapatinib, neratinib, tucatinib和 poziotinib也已被证明可以增加T-DM1的疗效。然而,机制仍不清楚。
抗血管生成
抗血管生成药物可能促进ADC对肿瘤细胞的穿透和暴露。在卵巢癌的临床前模型中,已经描述了anetumab ravtansine或mirvetuximab soravtansine与贝伐单抗联合使用的优异效果。最近的一项1b期临床实验研究了mirvetuximab soravtansine与贝伐单抗的联合治疗,其在经过大量预治疗、铂耐药、FRα升高的卵巢癌患者中,实现了39% ORR。这超过了AURELIA试验的基准值(27%)。
DNA损伤反应试剂
通过将靶向DNA损伤反应(DDR)的药物与携带DNA损伤剂的ADC相联合利用合成杀伤力,可能是治疗具有基因组不稳定性的肿瘤的一种有前途的策略。DDR药物与化疗的联合传统上受到无法忍受的毒性的阻碍。虽然拓扑替康或伊立替康与olaparib 或veliparib联合使用可导致较高的毒副作用,但携带拓扑异构酶I抑制剂有效载荷的新一代ADC的卓越活性和耐受性使它们更适合作为联合伙伴。
在没有明显骨髓毒性的情况下,sacituzumab govitecan (TROP2–SN38)与olaparib 或 talazoparib联合在体内外均产生了协同抗肿瘤作用。探索这一策略的多项临床试验正在进行中,包括niraparib 和trastuzumab duocarmazine,talazoparib和sacituzumab govitecan,以及olaparib和trastuzumab deruxtecan。
由于聚腺苷二磷酸核糖聚合酶(PARP)抑制剂的合成杀伤在很大程度上取决于PARP1的抑制,PARP2主要参与血液系统的动态平衡,因而选择性的PARP1抑制剂将成主要的联合选择。这一概念在1/2期PETRA试验中正在用trastuzumab deruxtecan 和datopotamab deruxtecan进行测试。
除了PARP抑制外,ADC相对于化疗的选择性增加无疑将扩大可结合的DDR药物的范围,例如,目前正在将ATR抑制剂berzosertib与saituzumab govitecan的联合测试研究(NCT04826341)。
ADC与免疫疗法的联合
最近,将免疫疗法与ADC相联合的策略也已进入临床研究。越来越多的证据表明,ADC可能会增加免疫治疗的疗效。其机制多种多样,包括诱导免疫原性细胞死亡、树突状细胞成熟、T淋巴细胞浸润增加,以及增强免疫记忆和免疫调节蛋白如PD-L1和MHC的表达。
ADC和ICIs的联合
多种HER2靶向的ADC,包括T-DM1、trastuzumab deruxtecan和disitamab vedotin,已与ICIs相联合并证实了协同的增强活性。
KATE2研究是唯一发表的测试ADC加ICI的随机试验,在HER2+乳腺癌患者中比较了T-DM1联合atezolizumab和T-DM1联合安慰剂的效果。联合用药未能明显提高PFS(8.2 vs 6.2个月)。但在PD-L1表达阳性的患者亚组中观察到了改善PFS的趋势(8.5 vs 4.1个月),这表明在HER2+乳腺癌的靶向治疗中增加ICI可能只对PD-L1阳性人群有益处
随着某些癌症疗效的显著提高,一些联合疗法可能会取代细胞毒疗法的标准护理方案。例如,Enfortomab vedotin(Nectin 4-MMAE)和pembrolizumab已被测试为局部晚期或转移性尿路上皮癌患者的一线治疗药物(NCT03288545)。在这一人群中,联合使用导致了73%的ORR和12.3个月的PFS,这一优异的疗效获得了FDA突破性疗法认定。
在宫颈癌、三阴性乳腺癌以及霍奇金和原发性纵隔大B细胞淋巴瘤等肿瘤,PD-1抗体已与分别靶向TF、TROP2和CD30的ADCs联合使用也已显示出了优异的疗效,使它们成为了一个更好的治疗选择,尤其是具有化疗严重毒性风险的虚弱和老年患者。
在临床前模型中,belantamab mafodotin与 OX40 激动剂的联合也导致了协同的抗肿瘤作用,肿瘤内T细胞和树突状细胞的浸润和激活增加。在DREAMM-5研究(NCT04126200)中,belantamab mafodotin的联合方案正在积极地研究,在该研究中,除了与PD-1抗体外,它还与多种免疫治疗药物联合使用,包括抗ICOS抗体、OX40激动剂以及γ-secretase抑制剂。初步结果表明,在经过大量预治疗的患者中,该药物与抗ICOS抗体的联合具有良好的活性。
ADC在免疫耐药中的作用
越来越多的临床前证据表明,联合方案可以恢复免疫敏感性,但目前还没有支持免疫治疗耐药患者的临床数据。受体酪氨酸激酶AXL的表达与免疫抑制细胞因子的分泌有关,导致多种肿瘤类型的ICI耐药。因此,使用抗AXL药物可能会预防或逆转ICI耐药性。在ICI难治性黑色素瘤和非小细胞肺癌的PDX模型中,AXL特异性ADC enapotamab vedotin与PD-1抗体和MART-1特异性T细胞一起进行了测试,ADC通过诱导T细胞渗透和增强抗原提呈而增强ICI活性,并导致TME的促炎转化。
ADC联合单抗、BsAb与CAR-T治疗
Polatuzumab vedotin已被证明通过增加AKT和ERK信号转导来增强肿瘤细胞上CD20的表达,支持其与CD20抗体(例如,rituximab)和CD20xCD3双特异性抗体疗法(例如,mosunetuzumab或glofitamab)的联合治疗。
在一项对51名接受基于polatuzumab的桥接策略的患者的回顾性研究中,在polatuzumab治疗后取得进展的3名患者在CD19 CAR-T治疗后获得缓解。这是否只与CAR-T疗法的使用有关尚不清楚。然而,根据上面描述的增强AKT和ERK信号的相同原理,polatuzumab有可能增加了CD19的表达。此外,可切割连接子ADC可能有助于其穿透TME,从而提高CAR-T治疗的疗效。
新型免疫抗体药物偶联物
ADC不仅可以针对癌细胞,还可以调节TME的成分,如免疫细胞或成纤维细胞,从而改变免疫反应性。为了达到这种预期的效果,已经对ADC的有效载荷和抗体部分进行了修改。
为了加强ADC的免疫调节特性,人们设计了免疫刺激抗体偶联物(ISACs)。这种新型的ADC是通过用免疫刺激分子如Toll样受体(TLR)7/8或干扰素基因刺激剂(STIN)激动剂取代传统的细胞毒性有效载荷而制备的。这些激动剂单独已经显示出抗肿瘤活性,然而它们的全身性给药可导致广泛的免疫过度激活,限制了它们的耐受性。将这些激动剂分子偶联到抗体上制备的ISACs进行靶向递送是将其毒性降至最低的一种策略。具有不同靶点靶向的ISACs,包括癌胚抗原、HER2、TAA1和PD-L1,已经在体内外进行了评估,这类药物正在进入临床测试(NCT04278144、NCT03696771和NCT05070247)。在临床前研究中,ISACs被证明通过诱导T细胞渗透、髓系重编程、抗体依赖吞噬和持久免疫记忆来促进获得性免疫和激活先天免疫反应。当与抗PD-1抗体联合使用时,这些激动剂通过重新编程TME巨噬细胞并在对单一药物抗PD1治疗耐药的模型中诱导反应来增强ICI的抗肿瘤活性。由于ICIs和ISACs都是专门为提高针对癌细胞的免疫反应性而设计的,它们的联合引发了人们对严重免疫相关不良事件风险的一些担忧。目前正在进行评估ISACs与ICIs联合使用的安全性和有效性的临床试验(NCT04278144,NCT05070247)。
ADC也可以针对TME的特定成分进行设计,包括T淋巴细胞和基质细胞。例如,针对CD73的ADC已经显示优异的临床前活性。在NSCLC和胶质瘤模型中使用MMAE偶联的CD73抗体可导致髓系来源的抑制细胞减少,促炎肿瘤浸润性巨噬细胞和成熟树突状细胞增加,并抑制肿瘤生长。
此外,在临床前模型中,针对癌症相关成纤维细胞的ADC与pembrolizumab联合使用时,显示出CD8+T细胞介导的抗肿瘤活性增强。
目前也有使用针对白细胞介素2受体α亚单位(CD25)的ADC,该亚单位由Treg细胞高度表达。该ADC可导致Treg细胞耗尽和CD8+T细胞增加,并在与抗PD-1抗体联合应用时显示出协同活性。正在进行一项临床试验,测试该ADC与pembrolizumab的联合应用(NCT03621982)。
ADC联合中的临床试验设计
随着新的ADC联合进入临床评估,有关患者选择和试验设计的考虑非常重要,这些设计可以在保持安全性的同时提高疗效。
基于ADC联合中的抗原表达
对于ADC的单一疗法测试,基于靶标表达的患者预选的需要而各不相同,其取决于多种因素,包括DAR、清除和半衰期、旁观者效应、有效载荷效力及其释放机制。靶向反应关系被定义为靶基因表达与抗肿瘤活性之间的相关性,对于某些ADC,如trastuzumab deruxtecan 反应与HER2存在靶向反应关系,而对于另一些ADC,如CD30与Brentuximab vedotin(CD30-MMAE)不存在靶向反应关系。在ADC与分子靶向药物或免疫肿瘤学药物的联合临床试验中,患者预选通常应遵循与ADC单一治疗相同的标准,除非有数据支持靶向反应关系在联合用药时发生改变。
实验设计
评估ADC联合的临床试验设计的基本原则与国家癌症研究所研究药物指导委员会的临床试验设计工作组发表的原则是一致的。要在临床试验之前提供一个可靠的假设来证明为什么特定的药物应该被联合使用,这种联合的预期结果和预计的发展计划需要提供给临床试验。如果担心重叠的剂量限制毒性,或PK的合理机制基础,或导致临床相关不良事件的药效学相互作用,对ADC与另一种药物进行正式的I期联合评估是适合的。I期联合研究中基于剂量递增设计将允许根据观察到的毒性和药物相互作用对不同剂量进行适应性探索。如果一种药物的剂量递增计划与其联合药物的固定剂量一起进行,并且药物相互作用是可能的,那么建议采用一种设计,将最初在第一个周期中的一个药物作为单一疗法进行序贯评估,然后在随后的周期中进行联合治疗。这一设计能够评估PK和药效相互作用,可以在每个参与者内部进行比较,并与历史数据进行比较。如果没有预期的药物相互作用,那么联合的剂量递增可以直接进行开展。选择具有最佳治疗指数的组合剂量的剂量优化可以通过利用回填策略在剂量递增期间同时进行,以提供进一步的安全性、PK和药效学数据(图3)。使用随机方法评估两个或更多剂量水平后,剂量优化也可以作为一个单独的组成部分在完成剂量递增后发生。
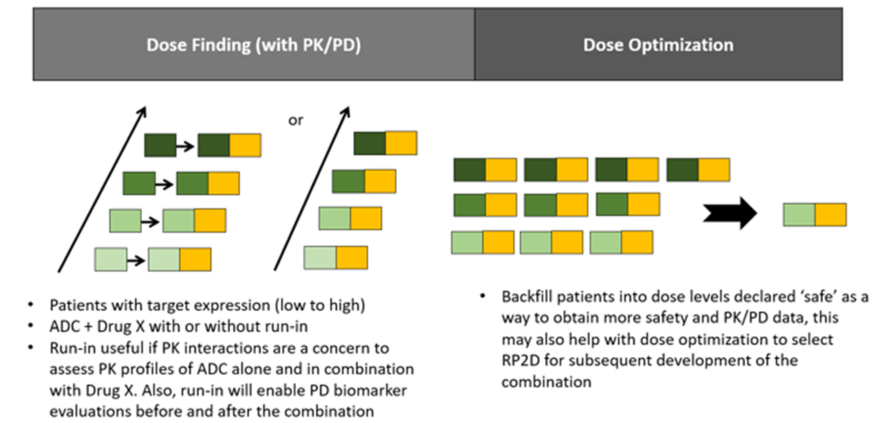
图3. ADC联合的临床试验设计中要考虑的因素
最后,基于ADC的联合用药的剂量扩展队列可以根据靶点表达的情况进行分级。这可以评估ADC的联合用药对不同靶标表达水平的抗肿瘤活性。应根据观察到的疗效考虑适应性登记,以增加参与者获得治疗益处的机会(图4)。
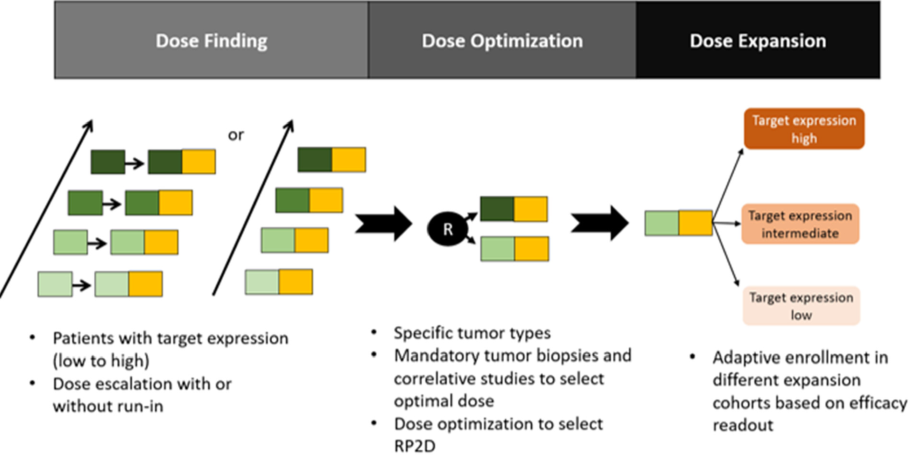
图4. 剂量扩展队列中具有不同抗原表达水平的肿瘤的适应性登记以评估疗效
小编小结
ADC作为单一药物在临床中已显示出优异的抗肿瘤效果,目前已有十几种ADC药物获得批准上市。为了进一步改善患者的生存益处,与ADC的各种联合策略也正在积极的临床前和临床研究中,有些已取得了重要进展。例如, FDA已批准了enfortumab vedotin和pembrolizumab联合治疗不能切除的局部晚期或转移性尿路上皮癌的突破性治疗方案,这些患者不适合在一线治疗中接受以顺铂为基础的化疗。随着更多的临床数据披露,也许未来ADC的联合用药将成趋势。
参考文献
1.ntibody–drug conjugates: in search of partners of choice.
2.Antibody-drug conjugates: smart chemotherapy delivery across tumor histologies.

 产业资讯
产业资讯
 清科研究
清科研究  2025-08-02
2025-08-02
 33
33

 产业资讯
产业资讯
 空之客
空之客  2025-08-02
2025-08-02
 35
35

 产业资讯
产业资讯
 医药魔方
医药魔方  2025-08-02
2025-08-02
 35
35