 产业资讯
产业资讯
 医药地理
医药地理  2023-03-07
2023-03-07
 2886
2886
2月22日,辉瑞宣布美国FDA已授予针对BCMA/CD3双特异性抗体Elranatamab的生物制品许可证申请(BLA)优先审评资格,用于治疗难治性多发性骨髓瘤 (RRMM)。同日,欧洲药品管理局(EMA)也接受了Elranatamab 在该适应症中的上市授权申请(MAA)。

来源:辉瑞官网
关于多发性骨髓瘤
多发性骨髓瘤(multiple myeloma,MM)是血液系统中的一种恶性增殖的浆细胞肿瘤,其特征是克隆性浆细胞无限增殖,在老年人群体中发病的几率较高。截至目前,MM仍无法完全治愈。MM患者的中位生存期(mOS)为2-7年,且在经过治疗后,患者体内仍然存在许多微小病灶,面临着疾病复发且进展为难治多发性骨髓瘤 (RRMM)。在病程中MM细胞克隆演变等问题是其复发以及耐药的原因之一。
根据World Health Organization2020年发布的统计死亡病例中,MM的死亡病例数目仍然比较庞大(见下图)。
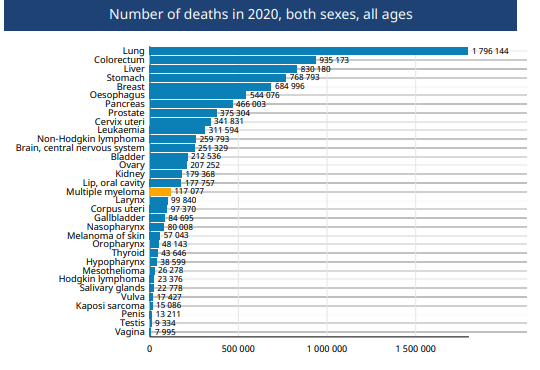
来源:World Health Organization. Globocan 2020: Multiple Myeloma.
随着不同机制的靶向药物获得新的突破,新药不断涌现而出,为MM 患者的预后得到极大的改善。
据Pharma ONE智能药物大数据分析平台统计,截至目前,针对MM治疗全球药物共涉及335个靶点,其中TNFRSF17、CD3E、CD38等靶点药物已获批上市。本次BCMA/CD3双抗Elranatamab进入FDA优先审批或将为复发难治患者提供一种新的治疗选择方案。
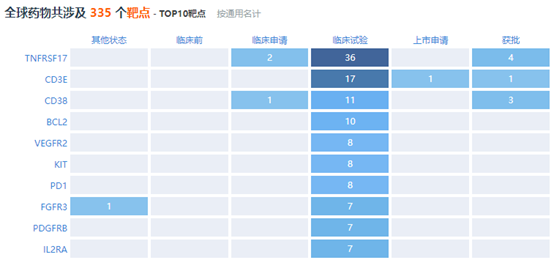
来源:Pharma ONE智能药物大数据分析平台
关于BCMA/CD3双抗Elranatamab
Elranatamab是一种皮下注射给药的B细胞成熟抗原(BCMA)/CD3靶向双特异性抗体。Elranatamab对BCMA/CD3的结合亲和力已被优化,可以潜在且有效地引发T细胞介导的抗骨髓瘤活性。该产品采用的双特异性抗体是一种新型的肿瘤免疫治疗方法,即同时结合两个不同的靶点,在与癌细胞上的特定抗原结合后激活患者自身免疫系统中的T细胞并使其更接近癌细胞将它杀死。
Elranatamab的BLA和MAA 主要基于2022年美国临床肿瘤学会年会口头报告中的一项开放标签、多中心、非随机的II期研究——MagnetisMM-3,该试验数据评估了Elranatamab 单药治疗 RRMM 患者的安全性和有效性。对蛋白酶体抑制剂、免疫调节药物和抗CD38单克隆抗体耐药的患者被分为两个独立平行队列并对患者进行Elranatamab皮下注射(76mg QW),以28天为一个治疗周期。
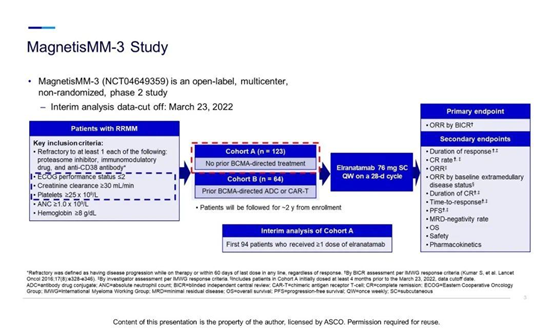
II期MagnetisMM-3研究结果显示,在队列A纳入研究的94例三重难治性MM患者中,接受至少1剂Elranatamab治疗(76mg/次,每周1次皮下注射)的患者ORR为60.6%。结果表明该产品耐受性良好,安全性可控,达到该产品预期效果。
Elranatamab目前处于III期临床阶段,在此之前,强生的Teclistamab已经成功获批上市。Elranatamab目前进展较快,或将有望成为全球第二款获批上市的CD3/BCMA双特异性抗体,为全球更多MM患者带来新的希望。

 产业资讯
产业资讯
 药渡
药渡  2025-11-07
2025-11-07
 110
110

 产业资讯
产业资讯
 药时代
药时代  2025-11-07
2025-11-07
 118
118

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-11-07
2025-11-07
 109
109