 产业资讯
产业资讯
 医药速览
医药速览  2023-03-15
2023-03-15
 2251
2251
随着科学技术的不断进步,临床未满足需求的不断探索,监管机构对于药物临床试验的监察也随之精准化。近日剑桥大学教授John Hodgson在Nature Biotechnology发表了一篇“Drug pipeline 4Q22 — sticking around”文章,罗列分析了2022年Q4 FDA批准和拒批药物,新公布结果的药物,以及2023年Q2预计获批的药物,以助力了解当前药品开发进程[1]。
从分析热门疾病领域药品开发管线来看,肿瘤适应症依旧处于“热门赛道”,其次为免疫及神经领域。就肿瘤领域来看,22年12月,FDA加速批准继安进的Lumakras (Sotorasib)之后全球第2款KRAS G12C抑制剂 Krazati (Adagrasib) ,Mirati Therapeutics开发其用于治疗携带KRAS G12C突变的局部晚期或转移性非小细胞肺癌患者。Krazati可以不可逆且选择性地结合至KRAS G12C并将其锁定在非活性状态。在KRYSTAL-1研究中其43%的ORR及优异的入脑表现使其获得FDA加速批准。就感染和代谢领域,FDA 还批准了阿斯利康和赛诺菲开发的全球首款针对婴儿群体的预防RSV抗体Beyfortus(Nirsevimab),以及 Provention Bio的全球首款治疗1型糖尿病新药 Tzield (Teplizumab)。Beyfortus采用了阿斯利康独有的YTE半衰期延长技术,靶向 RSV F 蛋白的高度保守区域,防止病毒进入细胞。通过对 Fc 区域的修饰,它具有较长的半衰期,允许一次给药即可提供整个RSV季节的病毒阻断。MELODY研究结果证明Beyfortus相较安慰剂可降低74.5%的RSV相关急性下呼吸道感染(如毛细支气管炎或肺炎)就诊率,因此也被Nature Medicine列为“2022年将改变药物未来的十大临床试验之一”[2]。
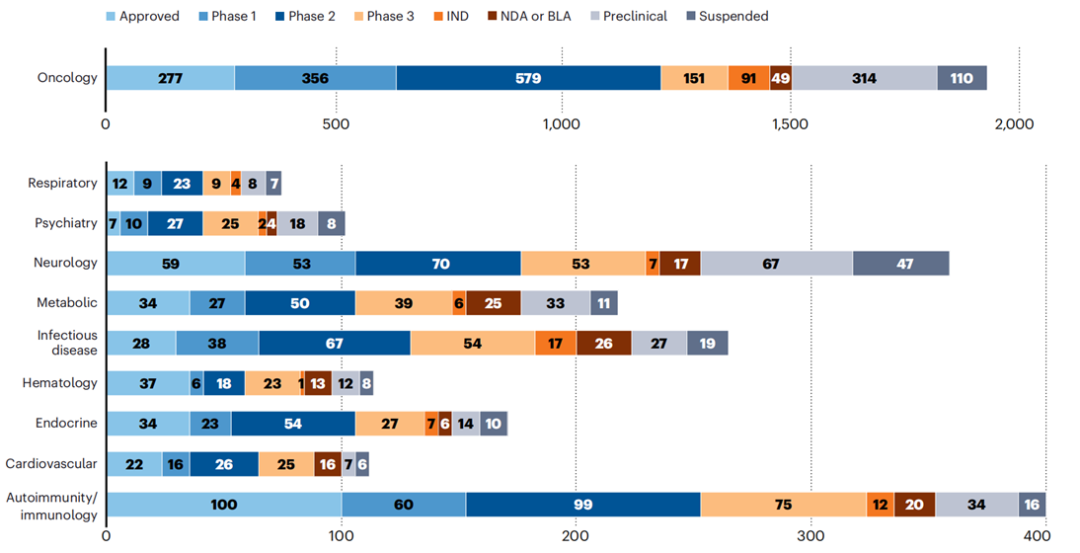
图1.热门疾病领域药品分期管线[3]Tzield为抗CD3单抗,作为第一个也是唯一的糖尿病免疫调节药物,用于延迟2期1型糖尿病(T1DM)的8岁及以上儿童和成人患者的3期1型糖尿病的发作。它可使攻击产生胰岛素的β细胞的免疫细胞失活,同时增加有助于调节免疫反应的细胞比例,基本上稳定β细胞功能。
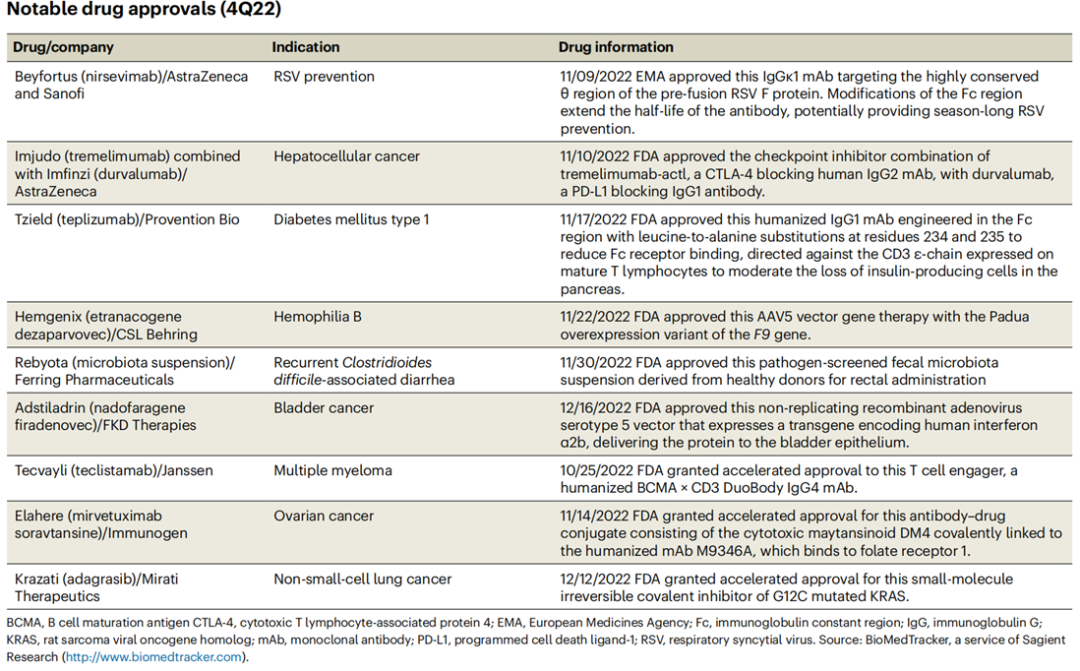
表1. 2022 Q4 FDA批准药物2023年Q2可能会出现新疗法。FDA已接收Sarepta Therapeutics的SRP-9001的BLA(生物制剂许可申请)。SRP-9001是一款Sarepta与罗氏公司合作开发的用于治疗杜氏肌营养不良的AAV递送编码缩短的功能性营养不良蛋白基因的基因转移疗法,其PDUFA日期为5月29日。在22年7月,FDA已受理Byondis 的Trastuzumab duocarmazine(SYD985)治疗不可切除的HER2阳性局部晚期或转移性乳腺癌患者的上市申请,运用了Byondis独有的ByonZine技术平台——duocarmazine连接子药物技术以提高ADC的体内稳定性,PDUFA日期定为2023年5月12日。ImmunityBio也在7月宣布,FDA受理了白细胞介素 (IL)-15 超级激动剂Nogapendekin alfa (Anktiva) BLA,用于治疗BCG无反应的非肌层浸润性膀胱癌原位癌,PDUFA日期定为2023年5月23日。而预计在 23年4 月,FDA也将对礼来的 p19 选择性抗体Mirikizumab用于治疗溃疡性结肠炎做出决定。
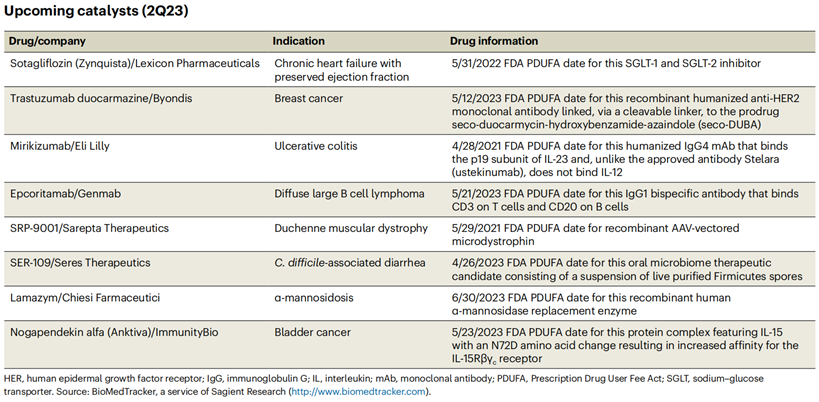
表2. 2023 Q2即将获批药物关于亨廷顿舞蹈病,小分子剪接调节剂的开发命运一波三折,目前国内外尚无获批疗法。22年10月,FDA 暂停PTC Therapeutics的PTC518亨廷顿病的II期临床试验,在此之前FDA要求提供更多关于PTC518的数据。在8月,诺华正式宣布暂停其小分子RNA靶向疗法Branaplam关于亨廷顿病的IIb VIBRANT-HD临床试验,独立数据监测委员会(DMC)发现Branaplam或可导致周围神经病变。
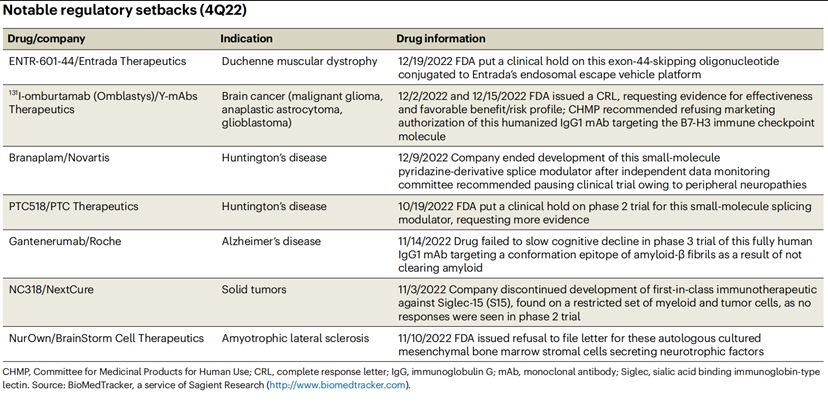
表3 2022 Q4 FDA拒批药物就神经领域来看,在22年11月29日公布积极结果的渤健(Biogen)和卫材(Eisai)联合开发Lecanemab,也在23年1月6日,FDA基于清除β淀粉样蛋白加速批准用于治疗阿尔兹海默病(AD),它是继Aducanumab后,全球第2款获批上市的靶向β淀粉样蛋白的创新疗法。而22年11月30日公布积极结果的Donanemab,一款靶向N3pG(修饰类型的β淀粉样蛋白)的单克隆抗体,在今年的1月底因提交的临床证据不足,部分患者用药没有达到12个月,FDA拒绝了其加速批准。除了阿尔茨海默病的有希望的分子外,新一代的抗炎抗体也在迈入视野。尽管在 22 年 5 月收到了FDA BLA拒绝的回复信,但UCB在22年12月分享了其抗IL-17A/IL-17F双特异性 Bimekizumab (Bimzelx) 治疗银屑病关节炎积极的临床疗效。BE SURE Ⅲ期试验显示,对比阿达木单抗,Bimekizumab治疗中重度斑块状银屑病患者主要终点方面显著更优,并且未发现新的安全风险。
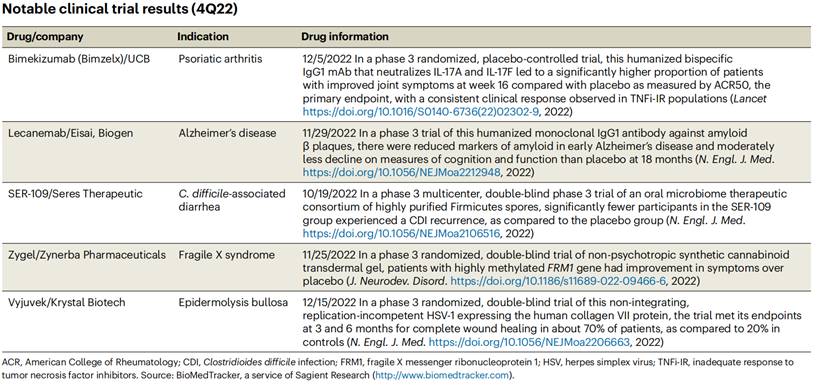
表4. 2022 Q4值得关注的临床结果
结语
基于2022年Q4 FDA获批及公布结果新药,总结盘点了部分肿瘤、神经、内分泌及感染领域等等药物。可以看出,目前全球药物开发逐步迈向精准化治疗,同时临床未满足需求也随着监管机构的严格要求不断清晰明确化,期待在已经到来的2023年,各大适应症领域药物开发的重大临床突破。
参考文献
1.Hodgson J. (2023). Drug pipeline 4Q22 - sticking around. Nature biotechnology, 41(2), 167–169.
2.Arnold C. (2021). 11 clinical trials that will shape medicine in 2022. Nature medicine, 27(12), 2062–2064.
3.http://www.biomedtracker.com

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-07-04
2025-07-04
 32
32

 产业资讯
产业资讯
 2025-07-04
2025-07-04
 31
31

 产业资讯
产业资讯
 医药魔方Info
医药魔方Info  2025-07-04
2025-07-04
 34
34