 产业资讯
产业资讯
 医麦客News
医麦客News  2023-04-04
2023-04-04
 5160
5160
2023年4月2日/医麦客新闻 eMedClub News/--据统计,2023年国内细胞治疗领域在第一季度共有36款细胞疗法取得临床申报进展,包括21款免疫细胞疗法和15款干细胞疗法,其中有24项IND获得受理,14项获批IND即将进入临床,整体申报/获批数量相较于去年第一季度显著增加。
据医麦客过往数据显示,2022年Q1申报临床的细胞疗法不足10款,其中有7款属于干细胞疗法。从表格中也可以看出,进入临床的细胞疗法类型正在变得越来越丰富和多样化。
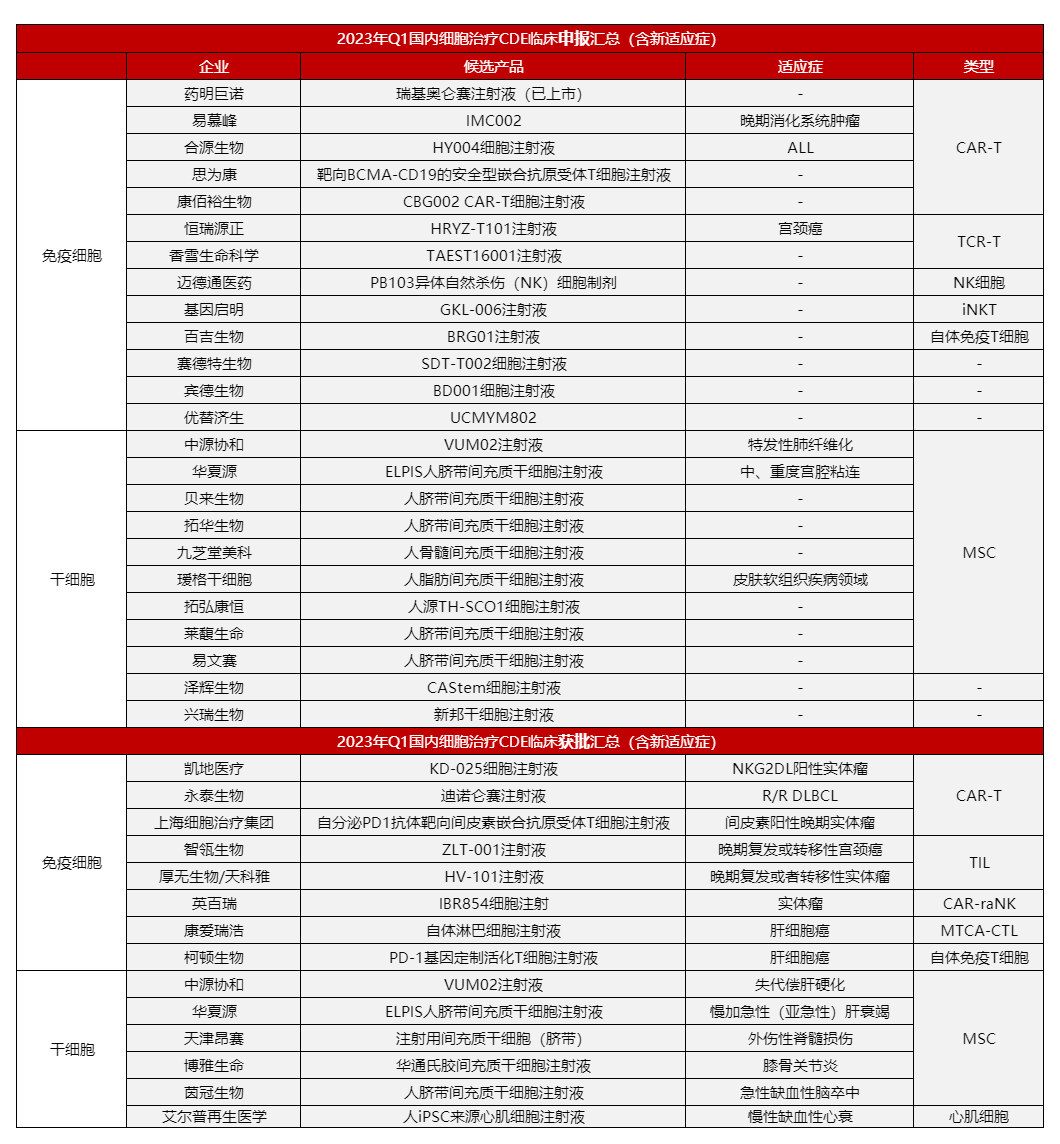
▲ 2023年1~3月国内细胞治疗领域临床申报进展
免疫细胞疗法迎来差异化发展
随着新技术的不断涌现,免疫细胞治疗的临床研究也日渐成熟,继CAR-T之后新型免疫细胞疗法例如TCR-T、TIL等疗法相继迈入临床,适应症也从集中的血液肿瘤拓展到实体瘤、自身免疫疾病等领域。据统计,在今年第一季度国内共21款免疫细胞疗法取得临床进展,同比去年Q1临床申报/获批数量大幅度增加。
其中,CAR-T依然是主角,占据半壁江山。但值得注意的是,在适应症方面,实体瘤远超血液瘤。血液瘤中以ALL为主,但相比之前的CAR-T产品也具有一定的差异性。再者,免疫细胞药物呈现类型多样化,从CAR-T药物单一竞品赛道慢慢转变成CAR-T、TCR-T、TIL、NK、CTL等多种差异化的新型免疫细胞疗法并驾齐驱的发展趋势。
01
康爱瑞浩MTCA-CTL实体瘤细胞疗法新适应症IND获批
1月4日,康爱瑞浩“自体淋巴细胞注射液”新适应症IND获批,适应症为:肝细胞癌根治术后伴高复发风险人群的辅助治疗。此前,这款自体淋巴细胞注射液产品(研发代号:KACM001)已在2022年5月获批开展用于治疗晚期不可切除或转移性胃癌的临床试验。
KACM001注射液实际上就是该公司的基于CTL的多靶点复合抗原细胞免疫治疗技术(MTCA-CTL)产品。CTL技术,即细胞毒性T淋巴细胞。该技术主要是利用癌细胞特有的、正常细胞上没有或者含量很低的蛋白质做诱饵,把外周血中那“万里挑一”的真正能抗癌的淋巴细胞,挑选出来,然后在体外进一步改良和扩增,然后回输给患者。
02
百吉生物EBV靶向T细胞产品新适应症IND获得受理
1月8日,百吉生物“BRG01注射液”新适应症临床试验申请获得受理。据披露,这是一款通过基因修饰技术将靶向EB病毒(EBV)抗原的受体表达于T细胞表面而制备成的自体T细胞免疫治疗产品。2022年12月,BRG01注射液首个适应症已获批IND,用于治疗经标准治疗后失败,且无有效治疗手段的末线复发/转移性EBV阳性鼻咽癌。
03
药明巨诺瑞基奥仑赛注射液两项新适应症IND受理
1月13日,药明巨诺自研的CD19靶向自体CAR-T细胞细胞产品瑞基奥仑赛注射液新适应症临床申请获得受理。瑞基奥仑赛注射液此前在中国获批上市用于治疗治疗经过二线或以上系统性治疗后成人患者的复发或难治性大B细胞淋巴瘤(r/r LBCL)以及经过二线或以上系统性治疗的成人难治性或24个月内复发的滤泡性淋巴瘤(r/r FL),是中国首个获批为1类生物制品的CAR-T产品。
2月8日,瑞基奥仑赛注射液另一项新的临床试验申请再次获得CDE受理。目前,这两项临床试验的适应症均未公开,而从药明巨诺研发日所公布的信息来看,公司计划将该产品拓展到更多血液瘤领域,包括套细胞淋巴瘤(MCL)、急性淋巴细胞白血病(ALL)及慢性淋巴细胞白血病(CLL)等B细胞相关的恶性肿瘤,并且向二线、一线治疗推进。与此同时,自身免疫性疾病也是倍诺达®未来将涉及的适应症之一,药明巨诺计划在2023年完成倍诺达®针对系统性红斑狼疮(SLE)的IND申请,目前这一适应症的早期临床试验正在进行中。
04
易慕峰CLDN18.2靶向自体CAR-T产品IND受理
1月16日,易慕峰自研的靶向CLDN18.2的自体CAR-T产品IMC002临床试验申请获得受理,适应症为CLDN18.2表达阳性的晚期消化系统肿瘤,包括但不限于晚期胃癌/食管胃结合部腺癌、晚期胰腺癌。据悉,IMC002是首个基于高特异性VHH纳米抗体在中国申报临床试验的靶向CLDN18.2的自体CAR-T细胞治疗产品。
05
合源生物CD19/CD22双靶点CAR-T产品IND受理
1月19日,合源生物“HY004细胞注射液”的新药临床申请获得受理。HY004是合源生物的CD19/CD22双靶点CAR-T,适应症为急性淋巴细胞白血病(ALL),此前处在探索性临床阶段,开展了一项只有2人样本的IIT研究,此次的新药临床申请或许基于此前的小样本探索性临床试验结果。
06
CRO公司迈德通医药通用型NK细胞疗法三项IND获得受理
1月19日,迈德通医药的“PB103异体自然杀伤(NK)细胞制剂”三项临床申请获得受理。据公开资料显示,迈德通医药是一家位于苏州的CRO企业,致力于对临床试验的全过程进行系统性管理,本次的新药申报是该公司首次申报药物的临床试验,此前曾助力其他生物制药公司药物过评。
07
智瓴生物实体瘤TIL细胞疗法IND获批
1月28日,智瓴生物的“ZLT-001注射液”获得CDE临床试验默示许可,适应症为晚期复发或转移性宫颈癌,这是华南区首个获批临床的TIL药物,也是第三家在国内获批临床的TIL企业。
ZLT-001是智瓴生物自主研发的第二代TIL细胞药物,基于YoungTIL-Exp™平台研发,采用时间轴激活、靶向耦合化、TME抗扰等独特技术对TIL进行纯化,增强TIL的活性与对实体肿瘤杀伤能力,并将数量扩增到十亿甚至是百亿级以上,从而实现回输到患者体内后快速、有效杀伤肿瘤细胞,控制肿瘤生长的目的。这也是智瓴生物的原型细胞药GTIL管线体系中的第一个药物。
08
厚无生物/天科雅实体瘤TIL细胞疗法获批临床
1月29日,厚无生物/天科雅联合提交的全新一代自体TIL细胞治疗产品"HV-101注射液"获得临床试验默示许可,适应症为晚期复发或者转移性实体瘤。
09
柯顿生物PD-1基因定制T细胞疗法IND获批
1月31日,柯顿生物的“PD-1基因定制活化T细胞注射液”获得临床默示许可,适应症为:肝细胞癌。据一项专利说明书称,此款疗法使用患者自身的T细胞在体外敲除PD-1基因,这些T细胞是病人自身的免疫细胞,无免疫排斥作用,细胞来源方便,易在体外培养扩增 ;同时,由于采用于患者自身的T细胞,相较于抗体治疗费用低,具有安全性、针对性持久性、全身性及彻底性。
10
全球首创!英百瑞非基因修饰实体瘤CAR-raNK细胞疗法IND获批
1月31日,英百瑞一款5T4靶向通用CAR-raNK细胞疗法“IBR854细胞注射液”获得临床试验默示许可,用于不可切除的局部晚期或转移性且目前无或不耐受标准治疗的实体瘤患者的治疗,这是国内首个针对实体瘤的非基因修饰方法的CAR-raNK细胞疗法。
据悉,IBR854注射液是一款全球创新的5T4抗体与NK细胞复合偶联的产品,该产品的核心构造是将靶向肿瘤抗原5T4的特异性抗体通过linker与同种异体的NK细胞进行共价偶联。
11
基因启明iNKT细胞疗法申报IND
2月14日,基因启明细胞治疗产品“GKL-006注射液”新药研究申请获得受理。目前,暂未有相关信息披露,但笔者通过专利查询,基因启明拥有6项细胞治疗相关专利。其中一项名为《表达靶向GPC3嵌合抗原受体的恒定自然杀伤T细胞(iNKT)及其制备和应用》的发明介绍了基因启明GPC3 iNKT细胞疗法的详细信息。
该专利介绍:嵌合抗原受体为包含按串联结构域连接的识别GPC3的C末端表位的单链抗体GPC3ScFv、CD8的hinge区、跨膜区和胞内信号区。嵌合抗原受体修饰的iNKT细胞制备包括:构建嵌合抗原受体pRRLgc3328BBz,感染iNKT细胞,体外特异性扩增后获得针对GPC3靶向性的iNKT细胞。本发明中编码嵌合抗原受体蛋白的核酸,包括含核酸的质粒、含质粒的病毒以及病毒转导的转基因iNKT淋巴细胞可以有效地被用于肿瘤免疫治疗中。
12
恒瑞源正宫颈癌TCR-T产品IND获得受理
2月21日,恒瑞源正自主研发的“HRYZ-T101注射液”新药IND申请获得受理。据恒瑞源正官网得知,HRYZ-T101注射液是一款用于治疗宫颈癌的TCR-T细胞治疗产品,但其靶点尚未公布。
13
香雪生命科学TCR-T细胞疗法申报新适应症
3月2日,香雪生命科学的“TAEST16001注射液”新适应症IND获得受理。据悉,TAEST16001注射液为一款NY-ESO-1抗原特异性高亲和性T细胞受体转导的TCR-T细胞治疗产品,是经过T细胞受体(TCR)基因修饰的自体T细胞,该T细胞表面表达了特异性识别HLA-A*02:01限制型的纽约食管鳞状上皮癌抗原1(NY-ESO-1)的高亲和性TCR。该产品于2019年首次获批IND,用于治疗软组织肉瘤,目前已经进入临床2期。
14
思为康BCMA-CD19 CAR-T疗法IND获受理
3月4日,湖南思为康医药有限公司自主研发的“靶向BCMA-CD19的安全型嵌合抗原受体T细胞注射液”临床试验申请获得受理。
15
康佰裕生物CAR-T细胞疗法IND获得受理
3月7日,康佰裕生物提交的"CBG002 CAR-T细胞注射液"临床试验申请获得受理,这是康佰裕生物首款申报的生物创新药。目前没有这款CBG002 CAR-T细胞产品的官方信息披露,而通过专利信息查询,康佰裕生物名下有数项CAR-T细胞相关专利,涵盖血液瘤及实体瘤领域。
16
国内首个!凯地医疗NKG2DL靶向实体瘤CAR-T细胞疗法获批临床
3月17日,凯地医疗KD-025细胞注射液获批临床。KD-025细胞注射液是国内首个获批靶向NKG2DL的自体CAR-T细胞治疗产品,适应症为NKG2DL阳性实体瘤,包括结直肠癌、肝癌、胶质瘤等,既诊断为无标准治疗的NKG2DL阳性晚期实体瘤。
KD-025 CAR-T细胞与肿瘤细胞表面NKG2DLs结合后,可引起CAR-T细胞内信号通路的活化,从而发挥杀伤肿瘤细胞的作用。据公开报道显示,KD-025细胞注射液还具备除直接杀灭肿瘤之外的其他功能,如:1、抗血管生成作用,即破坏肿瘤周边血管特异性内皮细胞;2、降低肿瘤微环境对KD-025CAR-T免疫抑制;3、诱导长期抗肿瘤免疫记忆CD8细胞增殖,降低疾病复发;4、特异性高效杀灭肿瘤干细胞。
17
优替济生细胞疗法IND获得受理
3月17日,优替济生提交的“UCMYM802”新药研究性申请获得受理。目前优替济生尚未有官方信息披露UCMYM802的详情。根据优替济生官网公开的管线显示,目前优替济生有两款CAR-T产品处于领先阶段,即将迈入临床,一款靶向BCMA,针对多发性骨髓瘤(MM);另一款靶向MSLN,针对MSLN阳性难治性实体瘤。
18
赛德特生物细胞疗法IND申报临床
3月18日,赛德特生物制药有限公司旗下子公司,赛德特(北京)生物工程有限公司(赛德特生物)提交的“SDT-T002细胞注射液”新药研究性申请获得受理。目前对于赛德特生物这款SDT-T002细胞注射液生尚未有官方信息披露详情。
19
永泰生物CAR-T细胞疗法IND获批,同时靶向CD19和TGF-β
3月21日,永泰生物提交的T细胞治疗产品“迪诺仑赛注射液”新药研究性申请获得国家药品监督管理局临床默示许可,适应症为:CD19阳性的复发或难治性弥漫大B细胞淋巴瘤。据悉,这是一款经基因改造表达抗CD19嵌合抗原受体与拮抗TGF-β下游信号通路蛋白的T细胞治疗产品。
迪诺仑赛注射液(RC19D2)是依托永泰生物免疫细胞药物研发平台开发的一款T细胞注射液。该产品具备识别和杀伤表达CD19分子靶细胞能力并拮抗TGF-β信号的功能,从而达到延长体内CAR-T细胞存活时间并促进CAR-T细胞浸润的目的,以期提高CAR-T类产品对于r/r DLBCL的缓解率,解决CAR-T细胞治疗持久性不够、治疗效果欠佳及预防肿瘤复发的痛点,更好地满足患者需求。
20
宾德生物细胞疗法IND获得受理
3月22日,宾德生物提交的“BD001细胞注射液”新药研究性申请获得受理。目前对于宾德生物这款BD001细胞注射液还尚未有官方信息披露详情。
21
全球首款!上海细胞治疗集团实体瘤自分泌纳米抗体CAR-T获批IND
3月24日,上海细胞治疗集团的自分泌PD1抗体靶向间皮素嵌合抗原受体T细胞注射液获得临床试验默示许可,适应症为间皮素阳性的晚期恶性实体肿瘤。据悉,这是一款靶向间皮素的自分泌纳米抗体CAR-T细胞药物产品(anti-PD1 MSLN-CAR-T),也是首款获批IND的自分泌纳米抗体CAR-T细胞药物。
干细胞疗法迎来“井喷”
据统计,在今年Q1共有15款干细胞疗法取得临床进展,其中13款均为间充质干细胞产品(MSC),同比去年Q1季度呈“井喷式”大幅度增长,同时相较于去年Q4季度(4款)申报/获批数量也增长了近4倍。MSC作为再生医学中常用的干细胞类型,已成为当今医学研究领域最前沿、最热门的方向之一。目前再全球获批上市的25款干细胞药物中,MSC产品就占据了半壁江山。
而在今年3月9日,FDA受理Mesoblast间充质干细胞疗法Remestemcel-L上市申请的消息引起了业界的轰动,这意味着我们即将迎来第15款上市的间充质干细胞产品,同时也从侧面表明了,在临床应用方面,MSC相关产品的发展势头强劲,正在加速进入市场。
01
中源协和间充质干细胞疗法1项IND获批,3项新适应症申报临床
1月5日,中源协和细胞基因工程股份有限公司的全资子公司,武汉光谷中源药业有限公司提交的“VUM02注射液”IND申请获得受理。
VUM02注射液(人脐带源间充质干细胞注射液)是其自主研发的冷冻保存型干细胞制剂,是由健康胎儿脐带组织经体外分离、筛选、扩增后制备的人脐带源间充质干细胞(UC-MSC)悬液,临床拟用于治疗特发性肺纤维化患者。2月10日,VUM02注射液首个适应症临床申请获得批准,拟用于治疗失代偿期肝硬化患者。此外,在3月14日,该公司又提交了两项VUM02注射液的新适应症临床申请,目前已获得受理。
02
华夏源异体间充质干细胞疗法斩获第三项新适应症
1月11日,华夏源“ELPIS人脐带间充质干细胞注射液”新适应症临床试验申请已获得受理。申报适应症为:中、重度宫腔粘连。据华夏源官网消息称,这将是华夏源干细胞新药产品的第四个应用方向,也是国内首个治疗宫腔粘连的干细胞新药IND受理。
此前,ELPIS已获得了两项适应症的临床试验批件,分别用于治疗成年中、重度慢性斑块型银屑病;而在2月11日,该候选疗法再次斩获第三项适应症,其用于治疗慢加急性(亚急性)肝衰竭的IND获CDE批准。
03
天津昂赛间充质干细胞疗法新适应获批IND
1月17日,天津昂赛自主研发的”注射用间充质干细胞(脐带)”新适应症获批IND,用于治疗外伤性脊髓损伤。CDE显示,此前这款”注射用间充质干细胞(脐带)”已经获批了三项适应症。分别为:难治性急性移植物抗宿主病(GvHD)、慢加急性(亚急性)肝衰竭、急性呼吸窘迫综合征。
04
艾尔普再生医学“人iPSC来源心肌细胞注射液”IND获批
1月31日,艾尔普再生医学自主研发的心力衰竭细胞治疗产品“人iPSC来源心肌细胞注射液”(HiCM-188)获批临床。该候选产品是一款拟用于治疗严重慢性缺血性心衰的“现货型”细胞治疗产品,通过体细胞重编程为iPSC并诱导分化获得。
值得关注的是,由该公司开展的人iPSC来源再生心肌细胞项目此前已于2021年完成国家卫健委细胞治疗临床研究备案,目前正在国内临床中心围绕中重度心衰治疗开展临床研究,现已入组15例患者。
05
泽辉生物人胚干细胞产品两项新适应症IND获得受理
2月1~7日,泽辉生物的人胚干细胞产品“CAStem细胞注射液”新药两项新适应症IND获得受理。2月7日,该产品另一项新适应症IND再次获得受理。此前,这款CAStem细胞注射液已获批开展多项临床,包括针对急性呼吸窘迫综合征、新冠肺炎相关肺纤维化、半月板损伤等。
据公开资料披露,CAStem细胞注射液是一种由免疫和基质调节细胞组成的注射类产品,其主要成分为M类细胞(类似MSCs的细胞),由临床级人胚干细胞分化而来。泽辉生物新闻稿称,CAStem细胞注射液与MSCs相比,在纯度、均一性、功能等方面有明显优势。
06
贝来生物间充质干细胞疗法新适应症IND获得受理
2月15日,贝来生物“人脐带间充质干细胞注射液”新适应症临床试验申请获得受理。据CDE官网显示,此前该疗法已经获批两项适应症,分别为类风湿关节炎和特发性肺纤维化。
07
博雅生命首款间充质干细胞疗法IND获批
2月23日,博雅生命旗下子公司,深圳博雅感知药业有限公司提交的"华通氏胶间充质干细胞注射液"临床试验申请获得临床默示许可,适应症为:膝骨关节炎。
08
拓华生物首款间充质干细胞疗法IND获得受理
2月23,拓华生物的“人脐带间充质干细胞注射液”临床试验申请获得受理。这是该公司首款申报的干细胞疗法,目前,暂未有相关具体信息披露。
09
九芝堂美科骨髓来源间充质干细胞产品IND获得受理
3月20日,九芝堂美科提交的“人骨髓间充质干细胞注射液”临床试验申请获得受理。目前九芝堂美科还尚未有官方信息披露这款人骨髓间充质干细胞注射液详情。
10
茵冠生物间充质干细胞疗法IND获批,针对脑卒中
3月21日,茵冠生物提交的“人脐带间充质干细胞注射液”新药研究性申请获得国家药品监督管理局临床默示许可,适应症为:急性缺血性脑卒中。
据茵冠生物官方消息称,这款人脐带间充质干细胞药物通过旁分泌及免疫调节等多重机制发挥作用,改善受损局部的微环境,抑制炎症反应、减轻局部损伤、加速损伤组织的修复、减少功能障碍、促进血管新生和神经再生等,以达到急性缺血性脑卒中(AIS)患者急性期治疗及改善预后的目的,提高患者的生存率和康复质量,有望成为AIS未来治疗的新趋势。
11
瑷格干细胞首款脂肪间充质干细胞IND获得受理,拟用于硬皮病
3月21日瑷格干细胞提交的“人脂肪间充质干细胞注射液”新药研究性申请获得受理。据瑷格干细胞官方公布信息,这是其首个申报临床的在研产品,拟适应症为治疗系统性硬化症手部病变。
12
拓弘康恒人源间充质干细胞注射液新适应症IND获得受理
3月24日,拓弘康恒自主研发的“人源TH-SCO1细胞注射液”新药研究性申请获得受理。据悉,人源TH-SCO1细胞注射液是一款注射用人脐带间充质干细胞,按照细胞成药性要求,采用严格的质控手段和制备技术使干细胞的质量和生物效力保持稳定。在新鲜细胞状态下,人源TH-SCO1细胞制剂质量稳定性可长达144小时,此外在非注册临床试验中,该款注射液展现出良好的效果。
此前,该产品于2021年12月获批"非活动性/轻度活动性克罗恩病肛瘘"IND;并于2022年5月获批该产品的第二个IND,适应症为复杂性肛瘘。
13
兴瑞生物首款干细胞疗法IND获得受理
3月24日,兴瑞生物提交的“新邦干细胞注射液”新药研究性申请获得受理。目前对于兴瑞生物这款新邦干细胞注射液生尚未有官方信息披露详情。
14
莱馥生命间充质干细胞新适应症IND获得受理
3月28日莱馥生命提交的“人脐带间充质干细胞注射液”新药研究性申请获得受理。据公司产品研发层面的表述,该产品是一款通用型的干细胞药物,具有安全性高,免疫原性低,适用于规模化生产的特点,以及更加广泛的临床应用前景。
在2021年,此款药物就已获批开展用于治疗特发性肺纤维化(IPF)的临床试验。本次申报的新适应症还尚未披露,但根据其官网,该药物可用于特发性肺纤维化、间质性肺病、炎症性肠病、糖尿病肾病。
15
易文赛间充质干细胞疗法IND再申报获得受理
3月29日,易文赛的“人脐带间充质干细胞注射液”临床试验申请已经获得受理。这是易文赛第二次为这款干细胞药物申请临床试验研究,据上一次申报已过去6个月。目前,还尚未披露适应症,但据易文赛官网资料显示,易文赛公司正在和复旦大学附属中山医院、浙江大学附属第二医院、浙江大学附属邵逸夫医院合作开展干细胞治疗退行性疾病的临床研究。
从今年Q1季度来看,在细胞疗法领域,免疫细胞疗法近几年都均保持稳步的增长趋势,但其细胞类型越来越呈现差异化,以及适应症正在向实体瘤、自免领域以及血液肿瘤的前线治疗拓展。另外对于干细胞疗法而言正在越来越成为众多临床未尽之需的重要主力军,从近几年临床批件来看,其数量呈现“井喷”趋势,尤其是在2021~2022年期间。据统计,截至2022年12月31日,在国内CDE受理的57款干细胞药物中(搜索关键词“干细胞、iPSCs”),2022年共有21项,而在今年仅从Q1季度的亮眼表现来看,将极大有望实现超越,干细胞治疗正在迎来其跨时代的变革。
参考资料:
1.CDE官网

 产业资讯
产业资讯
 清科研究
清科研究  2025-08-02
2025-08-02
 40
40

 产业资讯
产业资讯
 空之客
空之客  2025-08-02
2025-08-02
 42
42

 产业资讯
产业资讯
 医药魔方
医药魔方  2025-08-02
2025-08-02
 42
42