 产业资讯
产业资讯
 2017-10-11
2017-10-11
 4121
4121
Ansun BioPharma今日宣布,FDA为Ansun的同类首款(first-in-class)在研药物DAS181颁发了突破性疗法认定,用于治疗免疫缺陷患者由副流感病毒(PIV)引起的下呼吸道感染。PIV感染导致免疫缺陷患者和住院病人高发病率和死亡率,而目前还没有治疗PIV感染的方法。

在美国,每年大约有55000到200000名住院病人被诊断为PIV感染。许多住院病人都是免疫功能低下的病人,包括接受白血病治疗、实体器官移植和造血干细胞移植的病人。如果成功完成3期临床试验并获得批准,那么DAS181将成为第一个专门用于满足这一重大医疗需求的产品。
DAS181利用一种独特的以宿主为导向的方法,通过切断人类呼吸道内的唾液酸受体来阻断呼吸道病毒传染。这些受体与大多数主要呼吸道病毒结合,导致患者感染。DAS181已经显示了对四种主要呼吸道病毒,包括流感病毒(IFV)、副流感病毒(PIV) 、偏肺病毒(MPV)和人类肠道病毒-68(EV-68)的抗病毒活性。DAS181阻断病毒感染的方式,使得依赖唾液酸受体的病毒很难产生耐药性。在多个非临床和临床研究中几乎没有发现耐药性。

▲DAS181的分子模型,绿色为唾液酸酶催化区域,蓝色为C端的锚定区域(图片来源:Researchgate)
Ansun最近完成了一项关于DAS181的2期临床研究,用于治疗免疫功能受损患者的PIV感染,目前正处于3期临床研究的规划阶段。此外,Ansun还与FDA合作,使DAS181能够在新药临床试验申请的单患者/紧急条件下,进行同情使用(compassionate use),治疗130多名儿童和成人患者。
Ansun Biopharma的首席技术官George Wang博士说:“我们对这一认定感到兴奋,并期待着继续与FDA的抗病毒产品部门紧密合作,为病情严重的患者群体计划和进行3期临床研究。”
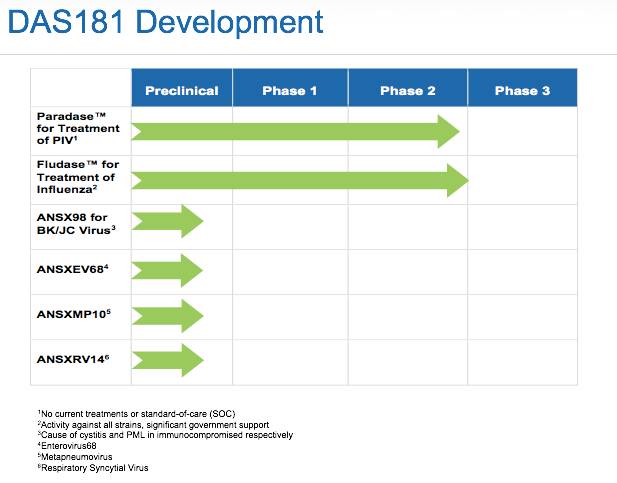
▲Ansun的多项在研新药(图片来源:Ansun官方网站)
Ansun Biopharma的首席执行官Nancy Chang博士表示: “我们已经研发了DAS181许多年,以治疗PIV感染重症患者和患有包括流感在内的其他呼吸道传染病患者。FDA授予的突破性疗法认定,对临床开发潜在拯救生命的药物来说,是一个重要的里程碑。”
Ansun主管运营的高级副总裁Mike Havluciyan博士说: “我们希望这项突破性疗法认定将使我们能够有效的加快DAS181的3期临床试验进展和产品批准,这样的话,PIV感染重症患者终于可以有了一个治疗选项。”
我们衷心期待这款药物在接下来的3期临床试验能够顺利进行,早日为患有此类病毒感染的患者带来首款药物!

 产业资讯
产业资讯
 新药猎人笔记
新药猎人笔记  2025-11-24
2025-11-24
 39
39

 产业资讯
产业资讯
 细胞基因治疗前沿
细胞基因治疗前沿  2025-11-24
2025-11-24
 42
42

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-11-24
2025-11-24
 42
42