 产业资讯
产业资讯
 Medaverse
Medaverse  2025-11-24
2025-11-24
 410
410


11月17日,强生和Halda
Therapeutics共同宣布已达成一项最终协议,根据该协议,强生将以30.5亿美元的价格收购Halda,在交割时以现金支付,但须按惯例进行调整。值得一提的是Halda刚在10月份公布其首个管线HLD-0915的一期临床数据,强生出手速度很快。Halda在2024年完成1.26亿美元B轮融资,累计融资2.02亿美元。投资者包括Deep
Track Capital、Frazier Life Sciences、RA Capital Management、Vida Ventures、Boxer
Capital和Taiho Ventures等。(超10亿美元!利用AI发现下一代RIPTAC药物;新锐!7600万美元融资,Craig
Crews教授新公司开发RIPTAC疗法;1.26亿美元B轮融资,开发RIPTAC疗法)


Halda的产品组合包括HLD-0915,这是一种first in
class的口服RIPTAC™治疗药物,正在开发中,用于治疗转移性去势抵抗性前列腺癌症(mCRPC)。最近公布的1/2期数据表明,这种新疗法具有良好的耐受性,并显示出令人鼓舞的抗肿瘤活性迹象,包括前列腺特异性抗原(PSA)的减少和实体瘤反应评估标准(RECIST)对晚期前列腺癌症患者的反应,其中许多患者在之前的多次治疗和用尽现有治疗后取得了进展。
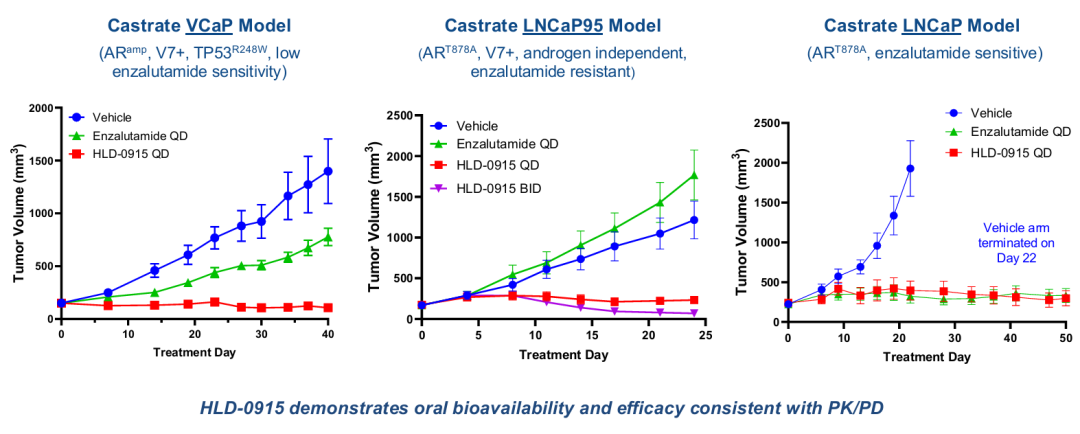
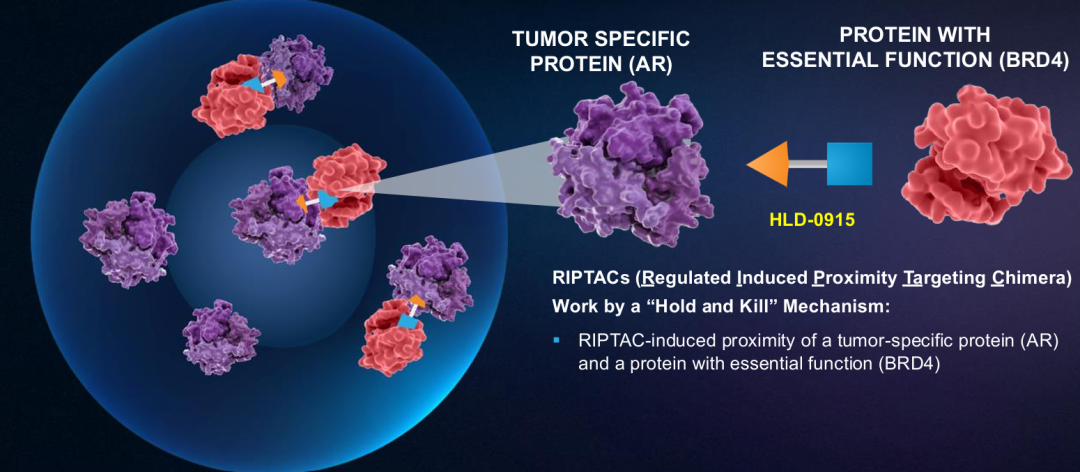
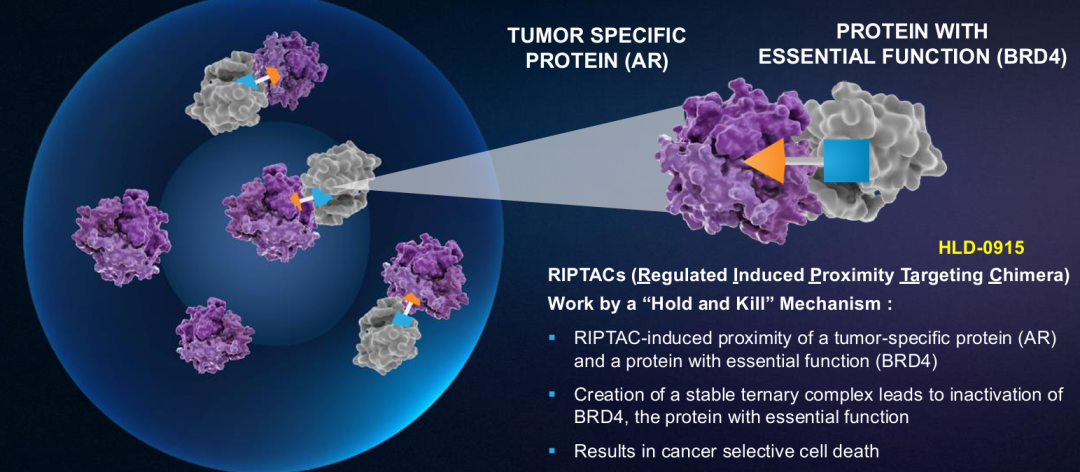
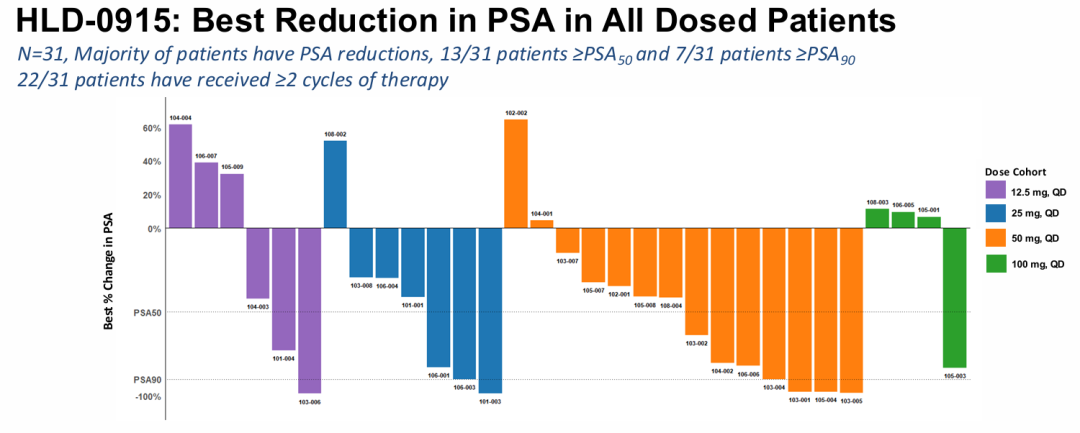
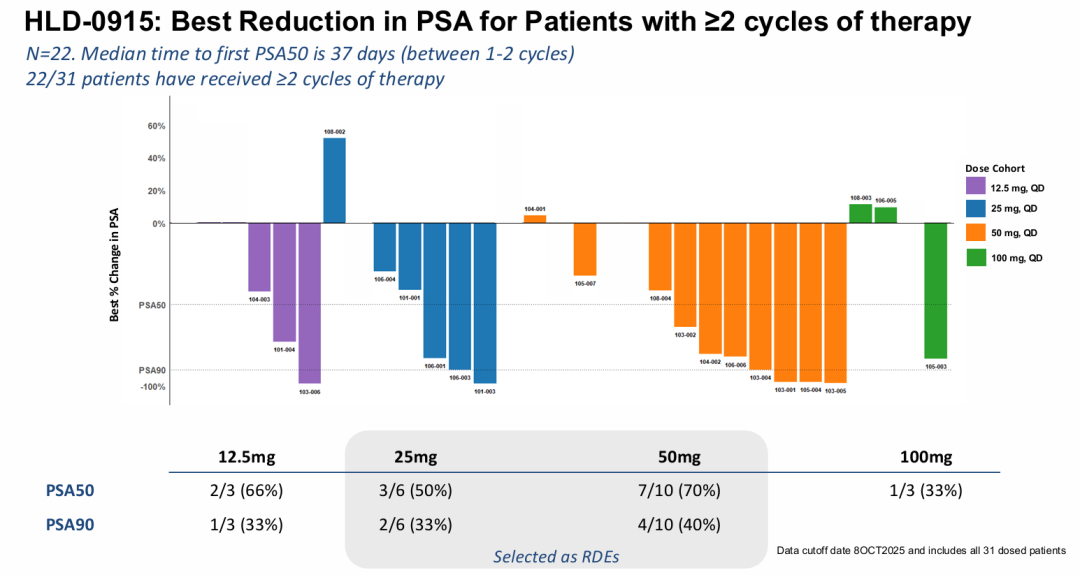
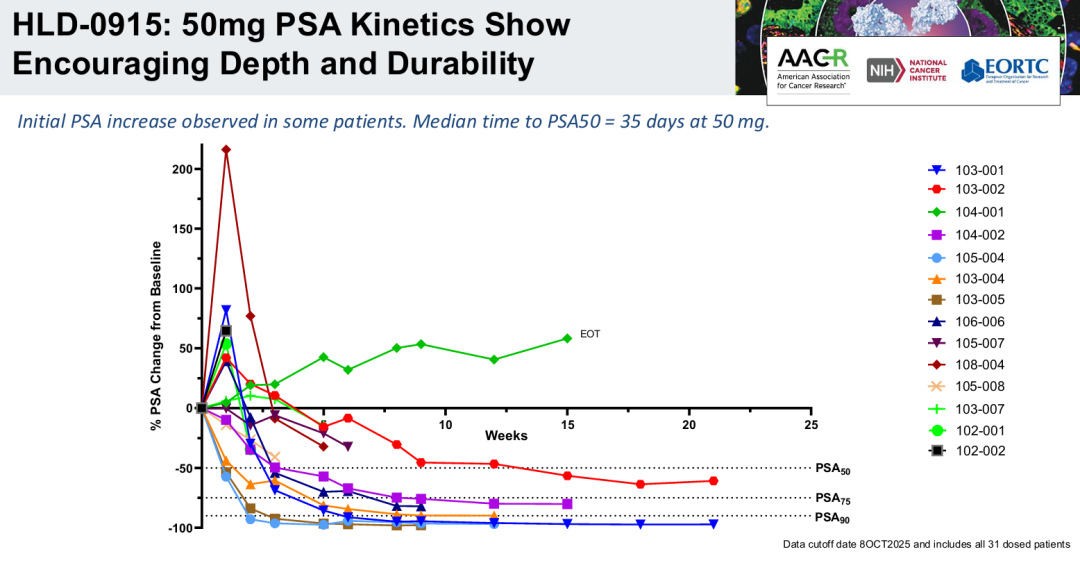
HLD-0915具有一种新的机制,旨在克服转移性去势耐受性癌症(mCRPC)治疗中的耐药性。HLD-0915同时结合两种蛋白质:雄激素受体(AR),以选择性地将RIPTAC治疗药物导向肿瘤细胞;以及一种参与转录调控的重要细胞蛋白,溴结构域4(BRD4)。由此产生的三聚体复合物导致BRD4功能的消除和选择性前列腺癌症细胞死亡。HLD-0915在前列腺癌症啮齿类动物模型中显示了对前列腺癌症细胞系的选择性体外杀伤作用和体内抗肿瘤活性。在所有剂量组中,在经过大量预处理的mCRPC患者中观察到抗肿瘤活性;在完成至少2个疗程的22名患者中,59%达到PSA50反应,32%达到PSA90反应。根据RECIST标准,所有5名患有可测量疾病的患者(5/5)在首次反应评估中均达到部分反应(PR)。2025年底进行2期临床研究。
Halda总裁兼首席执行官Christian
S.Schade表示:“Halda致力于推进其新型RIPTAC药物形式,为患有严重疾病的患者开发下一代选择性、基于邻近的小分子疗法。通过此次交易,我们将继续快速开发这项针对癌症前列腺患者的有前景的计划,并推进Halda从RIPTAC™平台到解决一系列疾病的创新管线。这一宣布是对多年来开发这种新型first
in class药物形式的科学努力的致敬,并为我们的股东带来重大价值。”
强生创新医学执行副总裁兼全球主席Jennifer Taubert表示:“此次收购进一步加强了我们的深层肿瘤学管线,在前列腺癌症领域拥有令人兴奋的领先资产,并提供了一个能够治疗多种癌症和肿瘤学以外疾病的平台,为增长提供了潜在的中长期催化剂。我们期待将Halda的产品线、平台和人员与我们世界一流的研发、商业和制造能力相结合,推进我们将这些疗法带给世界各地患者的目标。”

强生创新医学、研发执行副总裁John
C.Reed医学博士表示:“许多疗法会因耐药性而随着时间的推移而失去效果。即使癌症对标准治疗不再有反应,Halda的创新技术也能发挥作用,使用一种新的机制选择性杀死癌症细胞。HLD-0915的研究结果表明,在前列腺癌症方面,其初步疗效令人印象深刻,早期安全性也很强。我们渴望加快正在进行的HLD-0915
2期临床试验,并基于RIPTAC™技术开发一系列新的候选产品。”

Craig Crews教授
Halda Therapeutics科学创始人Craig Crews教授是耶鲁大学分子、细胞和发育生物学教授,他是诱导邻近生物学的先驱,发明了PROTAC靶向嵌合体(PROTAC®),这是一类异质双功能小分子蛋白质降解治疗剂。Crews教授是多家生物制药公司的科学创始人,其中包括Proteolix(被Onyx收购)和Arvinas。Crews随后将RIPTAC疗法视为另一类由Halda发明的异双功能小分子。
RIPTAC疗法结合了几种药物形式(modalities)的力量。与ADC、双特异性T细胞接合剂(BITE)、CAR-T疗法和放射性同位素一样,RIPTAC疗法不依赖致癌驱动因素,具有在许多耐药机制中起作用的杀伤机制。然而,它们具有小分子的优势,因为它们可以靶向细胞内蛋白质,并且更容易生产制造和递送。RIPTAC疗法具有广泛的潜力,可以提供口服、选择性、广泛适用的癌症细胞杀伤机制,用于出现耐药性的晚期癌症患者以及早期癌症患者。
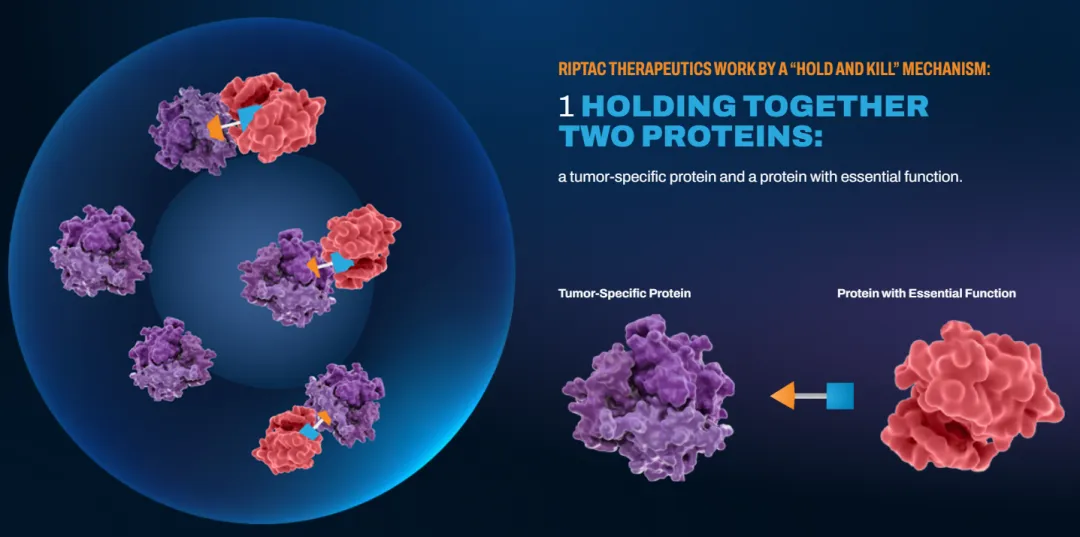
RIPTAC疗法通过一种新的“抑制和杀死”(“hold and
kill”)机制发挥作用,将两种蛋白质、一种癌症特异性蛋白质和一种具有基本功能的蛋白质结合在一起,导致基本细胞功能的丧失,进而导致癌症细胞死亡。
概念:配对算法。利用数百种癌症选择性细胞内蛋白标记物和数百种具有基本功能的蛋白质进行选择,Halda开发了一种算法来帮助选择互补对以开始RIPTAC药物设计。

设计:配体和连接物。RIPTAC治疗有三个关键组成部分:肿瘤特异性靶向蛋白配体、连接器、具有基本功能的蛋白质配体。Halda利用当今基于结构的药物设计的先进工具和双功能分子设计和合成的内部专业知识,确保蛋白质的正确排列,以驱动新蛋白质-蛋白质相互作用的形成和选择性细胞死亡。
优化:体外/体内分析。设计完成后,Halda反复测试含有RIPTAC治疗蛋白和两种蛋白的三元复合物的动力学,并评估下游药效。
调节诱导的近距离靶向嵌合体(RIPTAC™): 一种新型异双功能小分子选择性杀伤癌症细胞的治疗策略。Halda发表了RIPTAC治疗概念的化学生物学演示,该概念是一种选择性治疗癌症的新型异质双功能药物。(关注公众号后台回复“RIPTAC”获取以下最新文章)

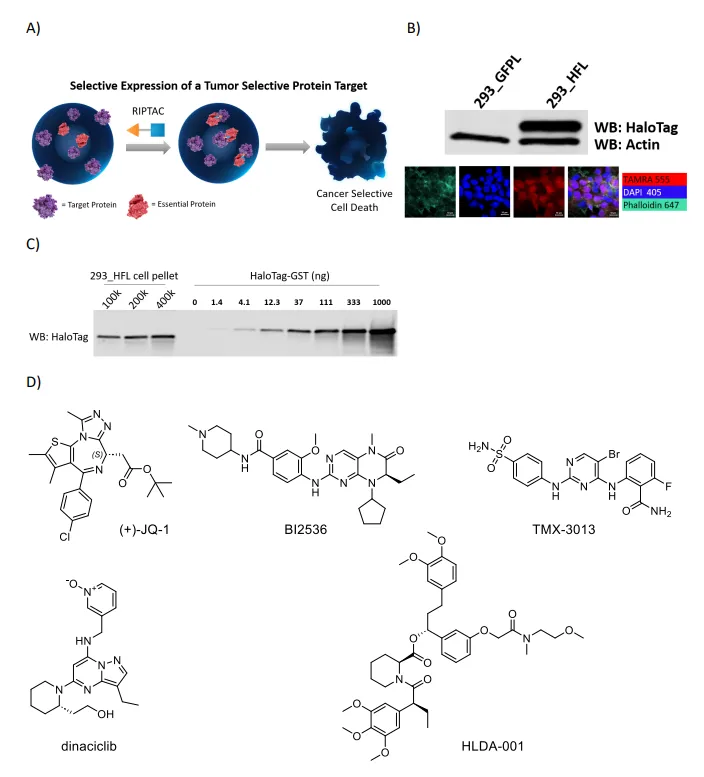
RIPTAC假设和HaloTag FKBP模型系统。a)RIPTAC依赖于靶点三元复合物形成中的细胞内积累和正协同作用选择性抑制靶蛋白表达细胞的增殖。b)
HaloTag FKBP融合蛋白是选择性的在293_HFL细胞中表达,而在对照293_GFPL细胞中不表达。c) 细胞HaloTag
FKBP的定量使用重组HaloTag GST标准曲线测定浓度。d)
RIPTAC效应配体(EL)JQ-1,BI2536、TMX-3013、Dinaciclib和FKBP靶配体(TL)HLDA-001

 产业资讯
产业资讯
 中国医药创新促进会
中国医药创新促进会  2026-01-26
2026-01-26
 31
31

 产业资讯
产业资讯
 细胞基因治疗前沿
细胞基因治疗前沿  2026-01-29
2026-01-29
 15
15

 产业资讯
产业资讯
 医药魔方
医药魔方  2026-01-29
2026-01-29
 14
14