 产业资讯
产业资讯
 医药经济报
医药经济报  2023-05-08
2023-05-08
 2755
2755
5月3日,礼来公布了Aβ抗体Donanemab治疗阿尔茨海默症3期临床TRAILBLAZWE-ALZ2的最新数据。结果显示,该研究达到了基于阿尔茨海默病综合评分量表(iADRS)评估的从基线到18个月的主要终点,显著减缓了早期阿尔茨海默病患者认知和功能的下降。Donanemab治疗相比于安慰剂,延缓了认知功能下降(iADRS)达35%(主分析人群)。

受此消息影响,截至当日收盘,礼来股价大涨6.67%,市值增加近300亿美元,总市值达到4093亿美元,这不仅让礼来迅速登顶纯药企市值第一名,也让其距离强生4300亿美元市值只有一步之遥。
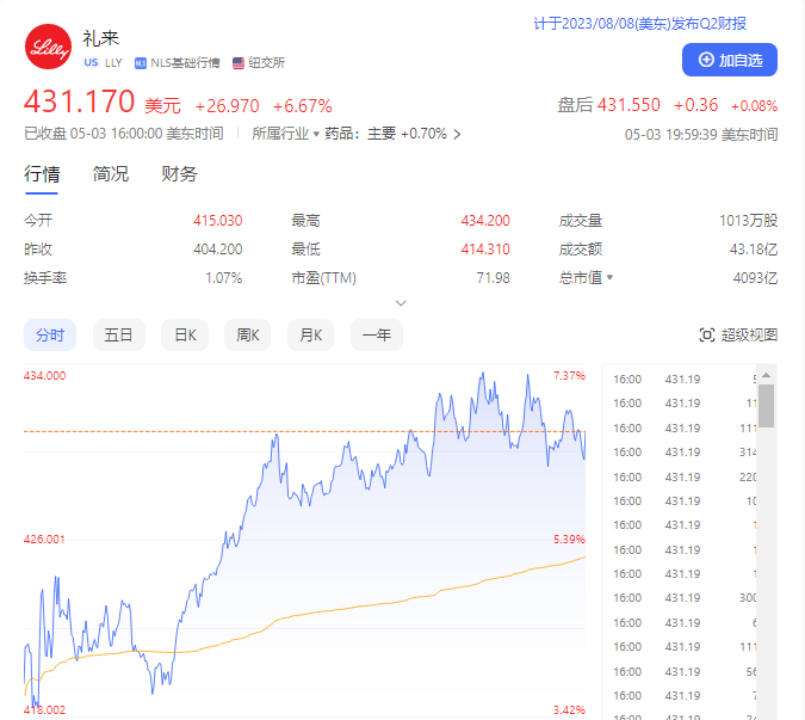
实际上,过去五年多时间,礼来股价一路走高,增长了5倍之多,这与其始终坚持纯药物研发布局密切相关。业内人士认为,礼来在治疗糖尿病、减重等领域已有“称王”的架势,凭借聚焦GLP-1及相关产品的研发,已推出度拉糖肽、Tirzepatide等不断迭代的超级爆款产品;如今又有阿尔茨海默病的潜在重磅加持,GLP-1药物和AD药物“双核”或将带动新一轮增长。
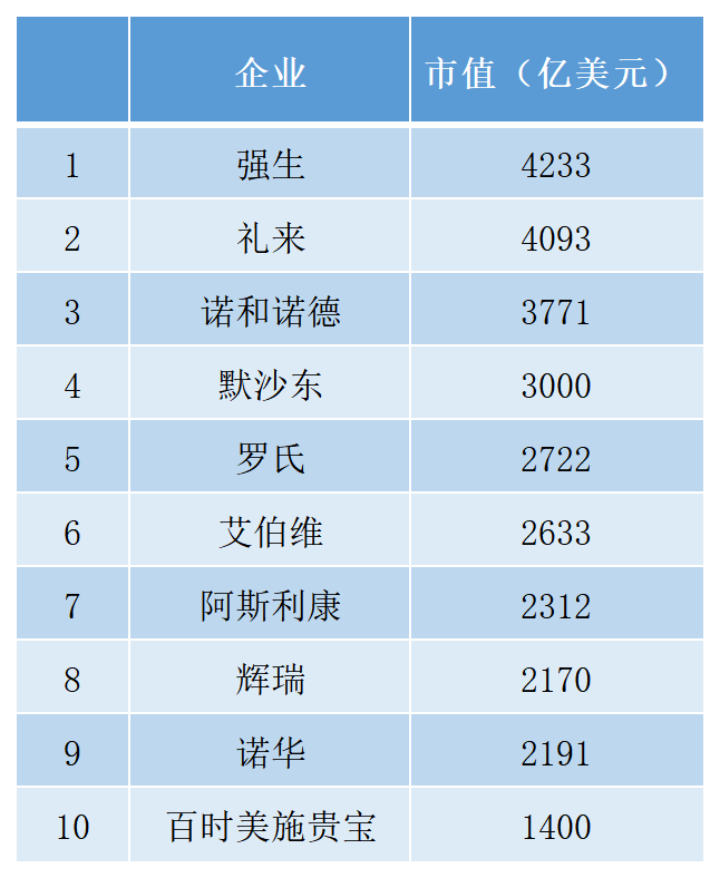
最新全球药企市值TOP 10
礼来Donanemab被寄予厚望AD领域依然前景广阔?
对于医药研发人员来说,如果能攻克阿尔兹海默病(AD),将是职业生涯中最有成就感的履历之一。如今,礼来负责Donanemab(下称“D药”)引发的热潮仍在席卷。
TRAILBLAZER-ALZ 2是礼来继2期临床TRAILBLAZER-ALZ、3期临床TRAILBLAZER-ALZ 4的又一项获得积极临床结果的3期临床试验。
在之前的试验中,D药展现出的治疗潜力,不仅相较于安慰剂可明显降低患者iADRS评分达32%(TRAILBLAZER-ALZ),还在与卫材/渤健Aduhelm的头对头试验(TRAILBLAZER-ALZ 4)中,D药组有37.9%的受试者实现了脑淀粉样蛋白斑块清除,而Aduhelm组仅有1.6%;在斑块清除比例上,D药也以65.2%的数据碾压Aduhelm的17.0%。
值得注意的是,在TRAILBLAZER-ALZ 2之前,卫材/Biogen开发的另一款AD药物Lecanemab(下称“L药”)已经证明了其将“除斑”转化为“延缓疾病进展”的能力,并在今年1月获得FDA加速批准上市。
正因如此,对于本次D药的临床研究展现出的研究结果,同样引发了市场高度关注。
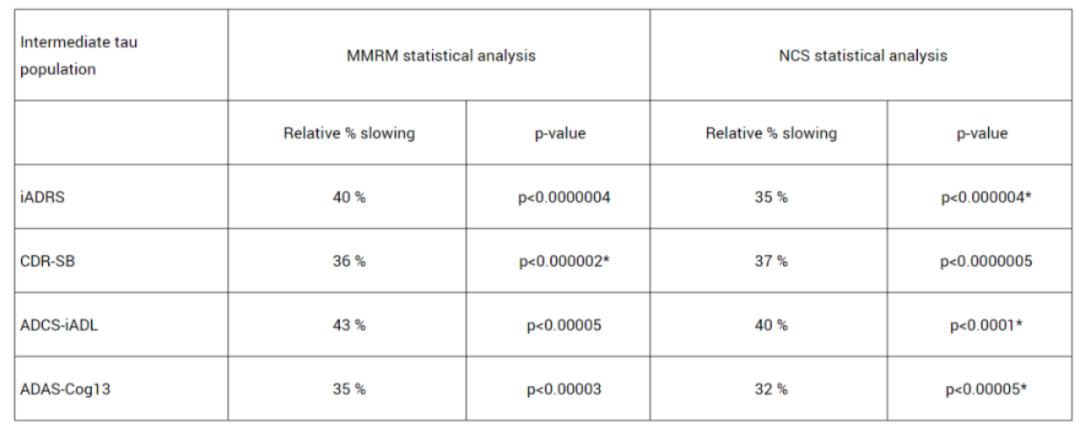
据悉,TRAILBLAZER-ALZ 2主要分析人群(n=1182)为tau蛋白水平中等且有明显AD临床症状患者。主要终点是iADR评分从基线到18个月的变化,关键次要终点包括基线至18个月的临床痴呆评定量表(CDR-SB)评分、AD协作研究日常生活能力量表(ADCS iADL)评分、AD认知量表(ADAS-Cog13)评分的变化等。
结果显示,与安慰剂组相比,接受D药治疗组患者的iADRS评分下降速度减缓了35%;18个月时,D药组CDR-SB评分较安慰剂组下降速度减缓了36%;ADCS iADL评分显示,18个月时,D药组疾病进展速度延缓了40%。此外,D药将患者疾病进展到下一阶段的风险降低了39%。
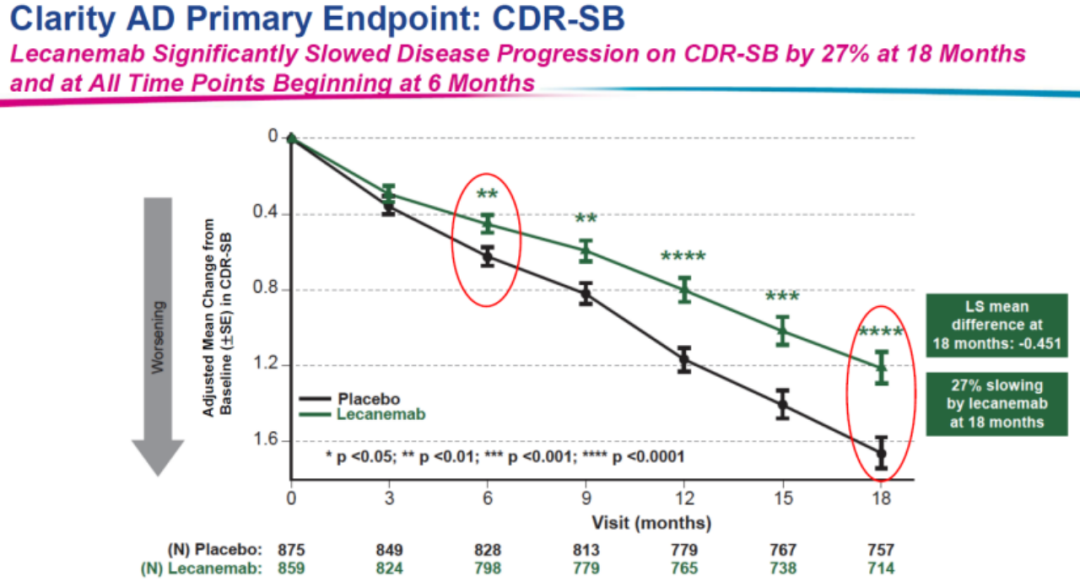
在此之前,卫材/Biogen的L药在三期临床试验中也表现出了突出的疗效,引发行业轰动。在大型全球III期验证性Clarity AD临床研究中,试验的主要终点同样为CDR-SB评分变化,结果显示:治疗18个月后,L药组与安慰剂组受试者的CDR-SB评分分别下降1.21和1.66分,意味着L药能将患者认知功能下降速度减缓27%。
礼来表示,未来将继续在多项临床试验中研究Donanemab,包括 TRAILBLAZER-ALZ 3——该试验的重点是预防临床前 AD 受试者发展成症状性阿尔茨海默病,TRAILBLAZER-ALZ 5——一项目前正在中国开展的针对早期症状性阿尔茨海默病的注册研究,和 TRAILBLAZER-ALZ 6——通过新的 MRI 序列、基于血液生物标志物和donanemab的不同给药方案来增强对 ARIA 的理解。
业内人士认为,在全球药企都扎堆于免疫、肿瘤等热门赛道的大环境下,礼来却凭借令无数人折腰的AD药物研发杀出重围,其成功之道值得深思。
坚持纯药研发“双核”能拉动增长?
相较于罗氏、强生等横跨制药、器械两大领域的全球型巨头企业,礼来无论是面对短期的营收利润压力,还是产品核心专利到期考验,依然坚持“不扩容”的主张,成为少数几个纯药物研发的MNC公司。
除此之外,礼来把“Best-in-class、Frist-in-class”作为企业研发创新聚焦的核心目标,也展现出了作为一家大型药企的“理性和务实”。
以GLP-1领域为例,作为该领域的资深玩家,度拉糖肽于2014年上市,是诺和诺德利拉鲁肽的跟随者。相比一日一次的利拉鲁肽,度拉糖肽拥有显著的依从性优势,一周给药一次。凭借这一点度拉糖肽后发先至,2019年开始便力压利拉鲁肽,稳居销量榜首。在2022年财报中,度拉糖肽增速较2021年有所减缓,不过仍以15%的增速实现74.4亿美元收入,成为礼来保持糖尿病药物市场竞争力的重磅武器。最新数据显示,度拉糖肽在2023年一季度的销售额为19.77亿美元,增长14%。
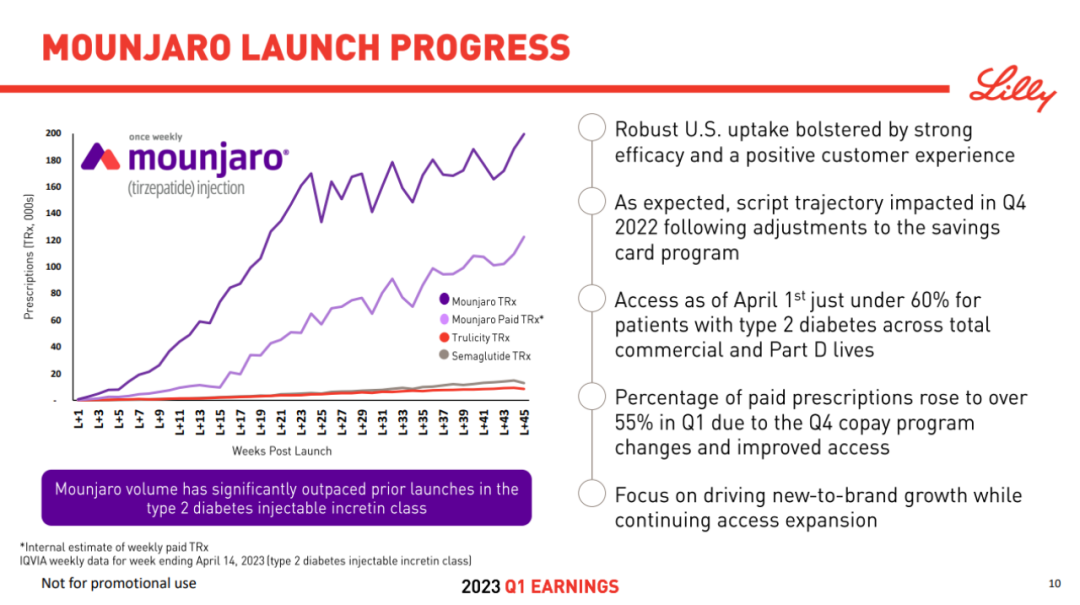
另一方面,礼来另一款每周皮下注射一次的GIPR/GLP-1R双重激动剂替尔泊肽(Tirzepatide),也展现了不可小觑的重磅潜力。该药去年5月首获FDA批准用于2型糖尿病,是近十年来获批的首个新型糖尿病药物,上市不到9个月就收获了4.83亿美元的销售额。在2023Q1财报中,Tirzepatide一季度销售额为5.68亿美元,远超去年3个季度的总和。
值得注意的是,一季度财报公布当日,礼来还公布了Tirzepatide治疗肥胖或超重的2型糖尿病成人患者的SURMOUNT-2研究数据。较高剂量的Tirzepatide可帮助患者在72周内减轻15.7%的体重,即15.6kg,而较低剂量的Tirzepatide可使患者体重减轻13.4%,即13.5kg。
、
就在几天前,礼来在clinicaltrials.gov网站上登记了一项3期临床试验(SURMOUNT-5),旨在评估Tirzepatide头对头对比司美格鲁肽的减重效果。不难感受到,对于赶超当今“减肥神药”司美格鲁肽,礼来对于产品“Best-in-class”潜力充满信心。
不过,任何创新都伴随着风险,即使是选择“Best-in-class”策略,也不见得一帆风顺。
实际上,作为全球顶级的制药大厂,礼来也难以避免市值波动。近三年,礼来为数不多的几次大波动有3次与D药有关,还有2次便是与Tirzepatide有关。
此外,去年3月份,礼来收到了美国FDA签发的关于信迪利单抗(sintilimab,Tyvyt)联合培美曲塞和铂类用于NSCLC一线治疗的新药上市申请的完全回复信(CRL)。该产品是一款PD-1抑制剂,由信达生物进行开发,于2015年与礼来达成授权合作。FDA回函表示信达/礼来此产品的新药上市申请被拒绝。去年年底,信达生物从礼来方面收回了信迪利单抗在海外的权益。
另一方面,AD领域的市场潜力依然有待进一步验证。卫材/渤健研发的Aduhelm,曾一度遭遇限制使用、销售惨淡、企业裁员、高管离任等一系列挫折。无论是产品定价还是医保支付,产品获批之后的商业化道路,对于D药而言同样面对着重重考验。
如今,礼来AD新药能否重现降糖药的奇迹,与GLP-1产品一起成为礼来拉动未来新一轮增长的“双核”?让我们拭目以待。

 产业资讯
产业资讯
 UmabsDB
UmabsDB  2025-06-23
2025-06-23
 3
3

 产业资讯
产业资讯
 支点财经
支点财经  2025-06-23
2025-06-23
 4
4

 产业资讯
产业资讯
 药视声
药视声  2025-06-23
2025-06-23
 4
4