 产业资讯
产业资讯
 Insight数据库
Insight数据库  2023-05-24
2023-05-24
 3520
3520
5 月 22 日,君实生物宣布,其在研 PD-1 单抗特瑞普利单抗新适应症申报上市并已获得 NMPA 受理,联合注射用紫杉醇(白蛋白结合型)用于 PD-L1 阳性(CPS≥1)的初治转移或复发转移性三阴性乳腺癌(TNBC)的治疗。这是特瑞普利单抗在中国递交的第八项上市申请。
当前国产 PD-(L)1 抑制剂并未有获批乳腺癌适应症,特瑞普利单抗为国产首款。
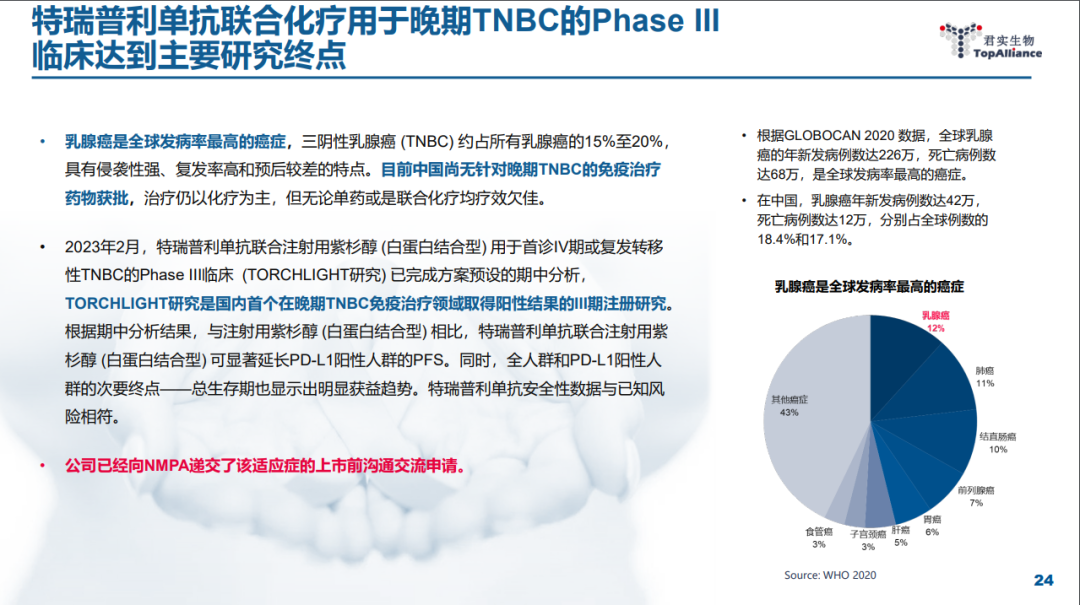
今年 2 月,君实宣布特瑞普利单抗联合化疗治疗晚期三阴性乳腺癌的 III 期临床研究(TORCHLIGHT 研究)已完成方案预设的期中分析,独立数据监查委员会(IDMC)判定研究的主要终点达到方案预设的优效界值。TORCHLIGHT 研究(登记号:NCT04085276)是国内首个在晚期 TNBC 免疫治疗领域取得阳性结果的 III 期注册研究。这项随机、双盲、安慰剂对照、多中心的 III 期临床研究,旨在首诊 IV 期或复发转移性 TNBC 患者中比较特瑞普利单抗联合注射用紫杉醇(白蛋白结合型)与安慰剂联合注射用紫杉醇(白蛋白结合型)的疗效和安全性。
来自:君实财报
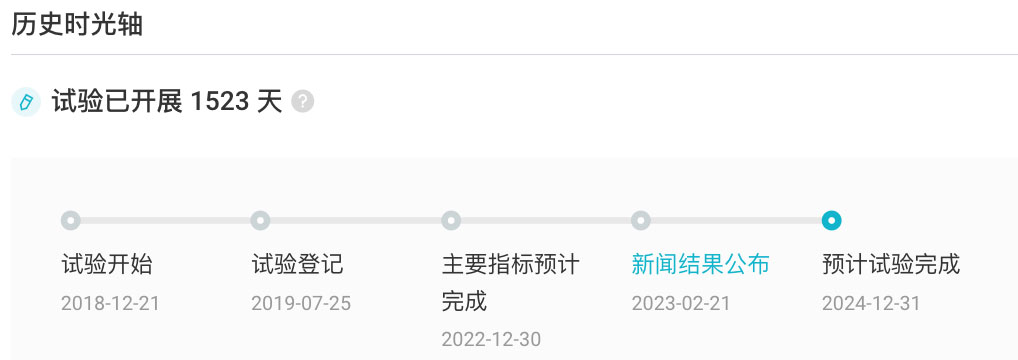
据本研究期中分析结果,与注射用紫杉醇(白蛋白结合型)相比,特瑞普利单抗联合注射用紫杉醇(白蛋白结合型)用于首诊 IV 期或复发转移性 TNBC 患者可显著延长 PD-L1 阳性人群的无进展生存期(PFS),同时,全人群和 PD-L1 阳性人群的次要终点——总生存期(OS)也显示出明显获益趋势。特瑞普利单抗安全性数据与已知风险相符,未发现新的安全性信号。详细数据将于美国东部时间 2023 年 6 月 3 日 17:54 在美国临床肿瘤学会(ASCO)年会上作为「重磅研究摘要」(#LBA1013)在快速摘要专场进行口头报告。NCT04085276 试验历史时光轴
来自:Insight 数据库网页版(http://db.dxy.cn/v5/home/)
据统计,全球乳腺癌的年新发病例数达 226 万,死亡病例数达 68 万,是全球发病率最高的癌症。在我国,乳腺癌年新发病例数达 42 万,死亡病例数达 12 万,分别占全球例数的 18.4% 和 17.1%。其中,三阴性乳腺癌(TNBC)约占所有乳腺癌的 15-20%,具有侵袭性强、复发率高和预后较差的特点。晚期 TNBC 对靶向治疗和内分泌治疗不敏感,缺乏特异性的治疗方法。
近年,以 PD-(L)1 抑制剂为代表的肿瘤免疫治疗药物在多个瘤种当中取得了一系列突破。据 Insight 数据库显示,截止今年 2 月,全球已有 19 款 PD-(L)1 抑制剂获批上市,这其中多数均已在布局乳腺癌领域,详见下图:全球已获批上市 PD-(L)1 乳腺癌适应症研究进展(II 期临床及以上)(数据截止 2 月 21 日)
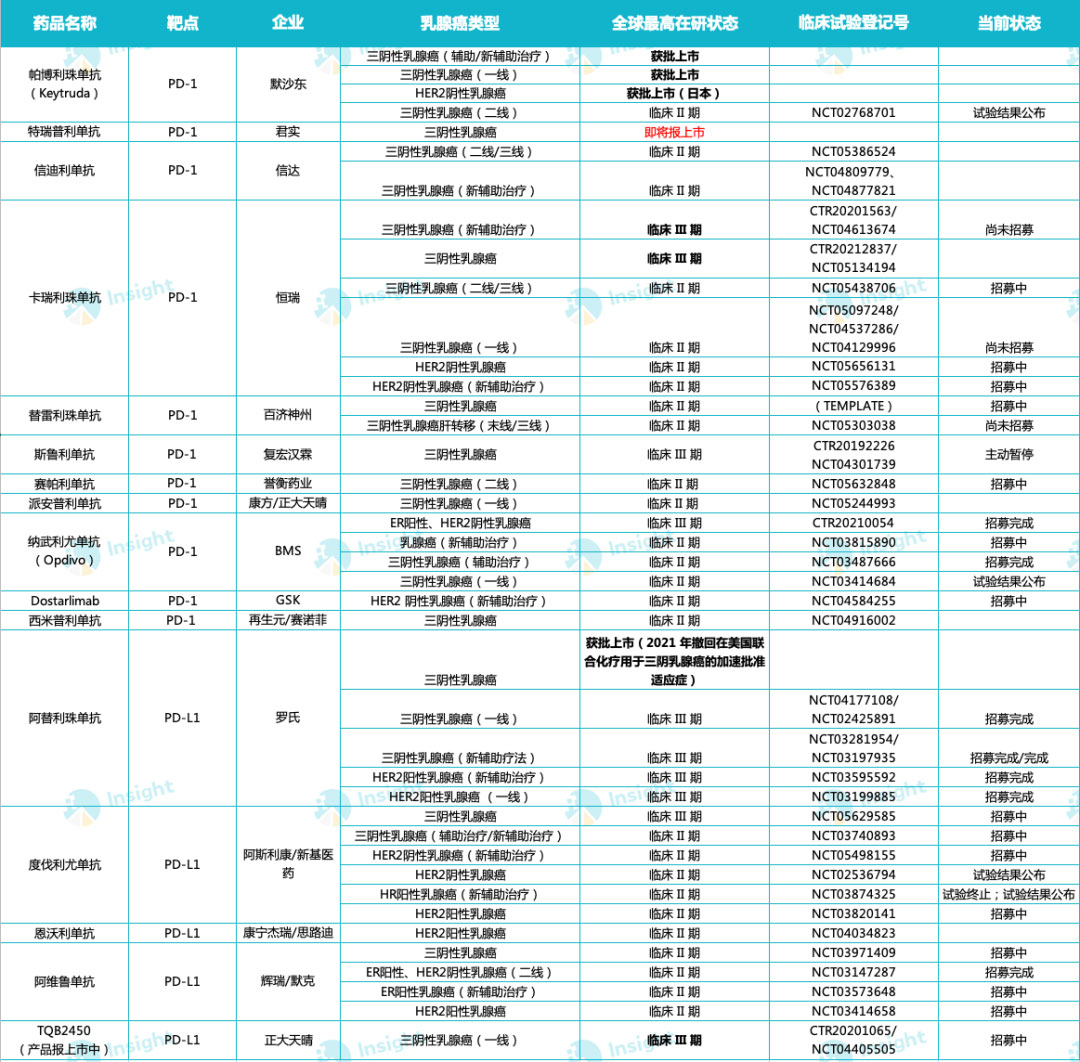
来自:Insight 整理(人工整理,如有纰漏请指正)
然而,当前仅有默沙东 K 药以及罗氏 Tecentriq 获批乳腺癌适应症。其中,K 药获批的三阴乳腺癌适应症疗法线数及类型已覆盖一线、新辅助以及术后辅助疗法。去年 11 月 K 药三阴乳腺癌适应症在国内获批。K 药国内获批三阴性乳腺癌适应症
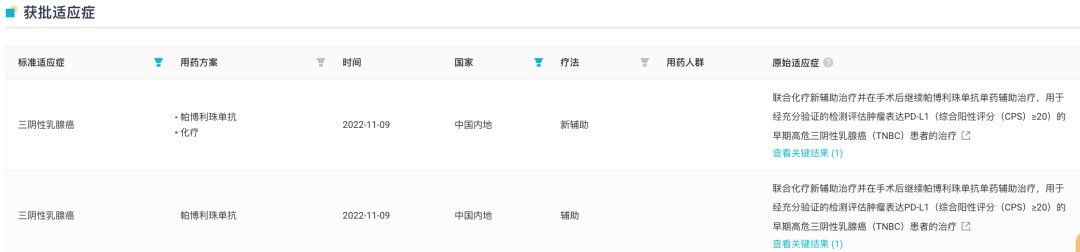
来自:Insight 数据库网页版
对于罗氏而言,其在研 Tecentriq 在该适应症的道路就并非如此顺利了。
2021 年 8 月,罗氏宣布自愿撤回 T 药联合化疗用于 PD-L1 阳性不可切除局部晚期或转移性三阴乳腺癌(mTNBC)的加速批准适应症。该决定仅影响美国的 mTNBC 适应症,不影响 Tecentriq 在美国和美国以外包括 mTNBC 在内的其他批准适应症。
对于国产药而言,当前并未有 PD-(L)1 抑制剂获批乳腺癌适应症,特瑞普利单抗是国内首个在晚期 TNBC 免疫治疗领域取得阳性结果的 III 期注册研究。此外,恒瑞卡瑞利珠单抗以及正大天晴的 TQB2450 也正在开展 III 期临床。除国内进展外,君实也在大力推进特瑞普利单抗的国际布局。目前,特瑞普利单抗联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌患者的一线治疗和单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗的生物制品许可申请(BLA)正在接受 FDA 审评。当前,已有多家国产 PD-1 在美国申报,详情如下:国产 PD-1 美国申报情况概览

来自:Insight 数据库网页版,人工整理如有纰漏还请指出
除美国外,君实也已开始把目光投向美国之外的广泛地区,第一步布局欧洲,然后通过对外合作/授权向东南亚等广泛地区渗透。
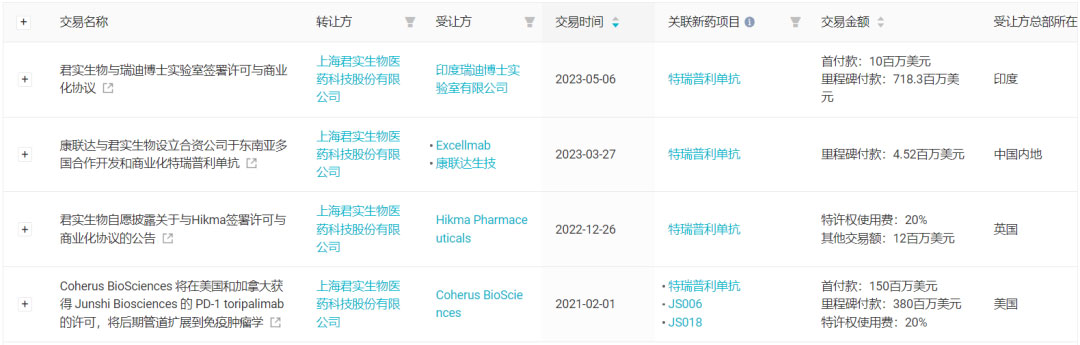
君实生物将特瑞普利单抗的北美和加拿大权益授予 Coherus,欧洲则自主提交上市申请;此外,从去年年末到今年初,又通过 3 笔交易将海外布局拓展到了中东、南非、北非、东南亚等地区。
君实生物「特瑞普利单抗」对外合作和授权
截图来自:Insight 数据库网页版
2022 年 12 月 26 日,君实生物与 Hikma 公司宣布达成合作,授予在约旦、沙特阿拉伯、阿联酋、卡塔尔、摩洛哥、埃及等中东和北非地区共 20 个国家开发和商业化的独占许可,并可获得合计最高达 1,200 万美元的付款,外加销售净额近 20% 的阶梯分成;
2023 年 3 月 28 日,君实生物与康哲药业子公司康联达生技共同宣布,将设立合资公司在东南亚地区 9 个国家,包括泰国、文莱、柬埔寨、印度尼西亚、老挝、马来西亚、缅甸、菲律宾、越南,对特瑞普利单抗合作开发和商业化;
5 月 5 日,君实生物与瑞迪博士实验室签署协议,同意授予许可于巴西、墨西哥、哥伦比亚、阿根廷、秘鲁、智利、巴拿马、乌拉圭、印度及南非开发及独占地商业化特瑞普利单抗;且瑞迪博士实验室可选择将许可范围扩大至涵盖澳大利亚、新西兰以及其他 9 个国家。

来自:君实财报

 产业资讯
产业资讯
 UmabsDB
UmabsDB  2025-06-23
2025-06-23
 47
47

 产业资讯
产业资讯
 支点财经
支点财经  2025-06-23
2025-06-23
 48
48

 产业资讯
产业资讯
 药视声
药视声  2025-06-23
2025-06-23
 50
50