 产业资讯
产业资讯
 大叔快评
大叔快评  2023-06-08
2023-06-08
 4014
4014
传奇生物和杨森联合开发的的CAR-T细胞产品(Ciltacabtagene autoleucel)的一项头对头随机对照III期临床试验(CARTITUDE-4),于2023年6月5日在2023ASCO年会上做口头报告(LBA106),并同期NEJM在线发表。前期因传奇生物较早披露了CARTITUDE-4临床试验的数据,有可能违反embargo原则,而不能上NEJM,看来这个预判错了。
这次在NEJM上发表的题目是Cilta-cel or Standard Care in Lenalidomide-Refractory Multiple Myeloma,传承了NEJM论著标题言简意赅的风格。重点是将Cilta-cel定位在来那度胺难治的多发性骨髓瘤的标准治疗,两层含义,其一、将前序接受过2-3线治疗的定义,简化为来那度胺难治的MM,排除了蛋白酶体抑制剂(硼替佐米,伊沙佐米和卡非佐米)和CD38单抗(Daratumumab和Isatuximab)对复发/难治MM定义的干扰。其二、杨森通过全球学术推广,将其产品组合精准定位,从新诊断MM到复发/难治MM,全程覆盖多发性骨髓瘤的治疗,譬如,Daratumumab单药二线,Daratumumab+硼替佐米+来那度胺方案一线+二线,Cilta-cel(CAR-T细胞)来那度胺难治的首次复发+四线。

DOI: 10.1056/NEJMoa2303379
在ASCO上口头报告的标题与NEJM发表的标题略有差别,核心点是来那度胺难治的多发性骨髓瘤。

Dr. Binod Dhakal 口头报告者和NEJM论著共同第一作者

2023ASCO LBA106
CARTITUDE-4临床试验(NCT04181827),是一项国际、随机、开放标签的III期研究,旨在评估CAR-T疗法 vs 泊马度胺、硼替佐米和地塞米松(PVd)或达雷妥尤单抗(CD38单抗)、泊马度胺和地塞米松(DPd)在复发性和来那度胺难治性多发性骨髓瘤成人患者中的疗效和安全性。该研究的主要终点是PFS。次要终点包括安全性、总生存期(OS)、微小残留病(MRD)阴性率和总缓解率(ORR)。

CARTITUDE-4临床试验设计
419名晚期复发的多发性骨髓瘤(MM)患者,他们先前接受过1至3线治疗,包括蛋白酶体抑制剂(PI)和IMiD药物。在进行白细胞分离后,研究人员随机将患者分为接受cilta-cel治疗组(208名患者)和标准治疗组(211名患者)。
在cilta-cel治疗组中,患者先接受过渡治疗,可以选择医生推荐的pomalidomide、硼替佐米和地塞米松(PVd)或达伦单抗、pomalidomide和地塞米松(DPd),然后在清淋方案处理后5到7天进行单次cilta-cel输注。在标准治疗组中,治疗包括PVd(28名患者)或DPd(183名患者),直至疾病进展。
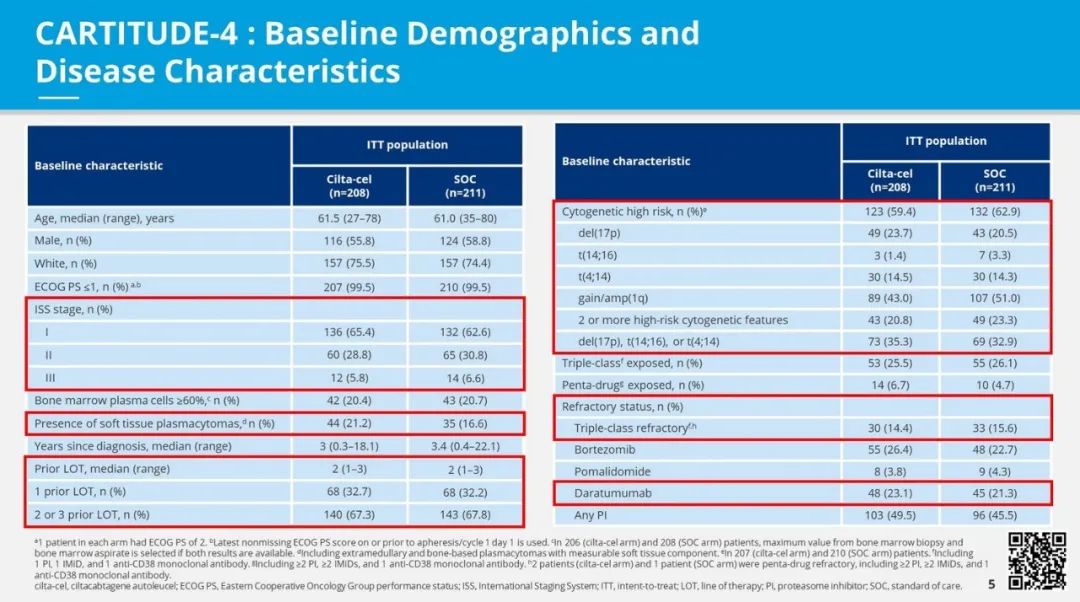
CARTITUDE-4临床试验入组患者基线特征
在基线时,cilta-cel组中有59%的患者和标准治疗组中有63%的患者被发现存在细胞遗传学高风险疾病。接受cilta-cel治疗的患者中有一半(50%)和接受标准治疗的患者中有46%对蛋白酶体抑制剂(PI)具有耐药性。此外,cilta-cel组中有23%的患者和标准治疗组中有21%的患者对抗CD38单抗具有耐药性。在cilta-cel组和标准治疗组中,各有三分之一的患者(分别为33%和32%)曾接受过1线治疗。
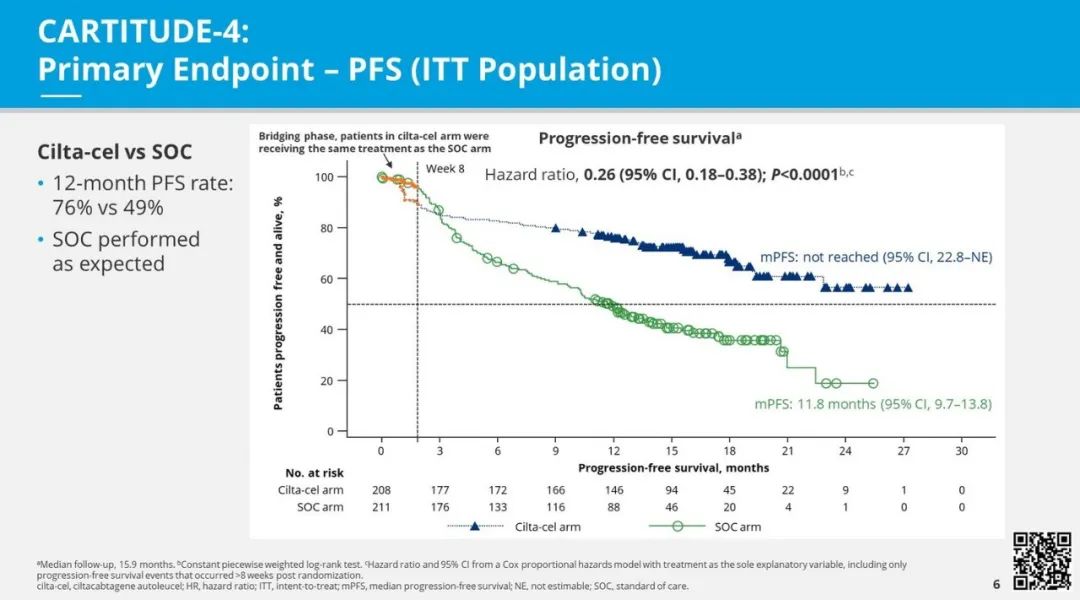
cilta-cel, ciltacabtagene autoleucel; HR, hazard ratio; ITT, intent-to-treat; mPFS, median progression-free survival; NE, not estimable; SOC, standard of care.
主要研究终点PFS方面,在中位随访期为15.9个月的情况下,cilta-cel组和标准治疗组的12个月无进展生存率分别为76%和49%(HR 0.26;P < .0001)。
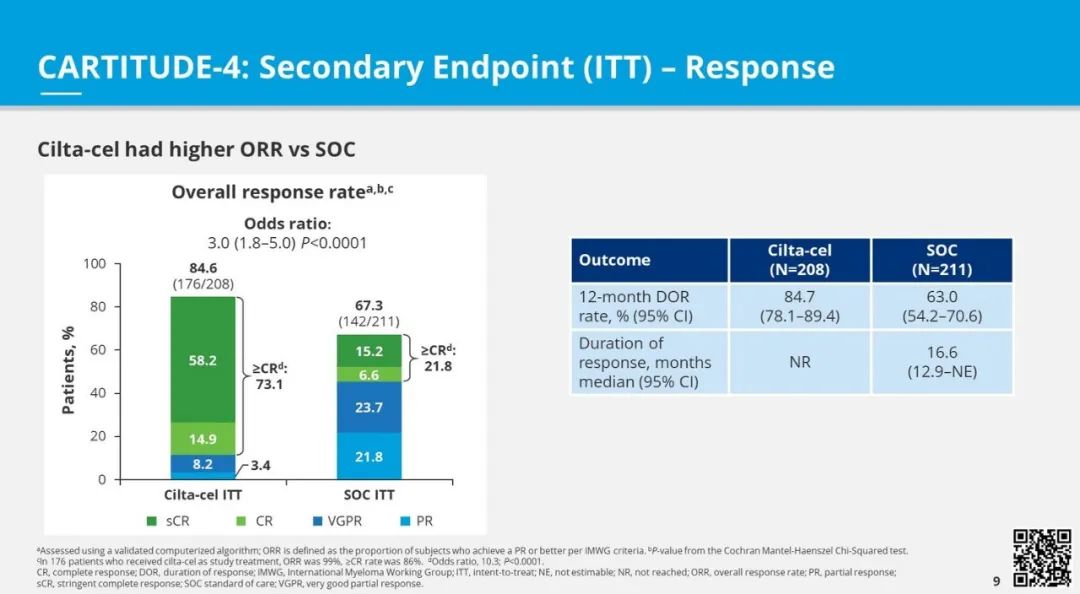
此外,与标准治疗相比,cilta-cel显著提高了总体反应率(比值比[OR] 3;P < .0001)、≥完全缓解率(OR 10;P < .0001)和总体可测量残留疾病(MRD)阴性率(OR 9;P < .0001)。此外,在cilta-cel组中,总体生存有改善的积极趋势(HR 0.78)。
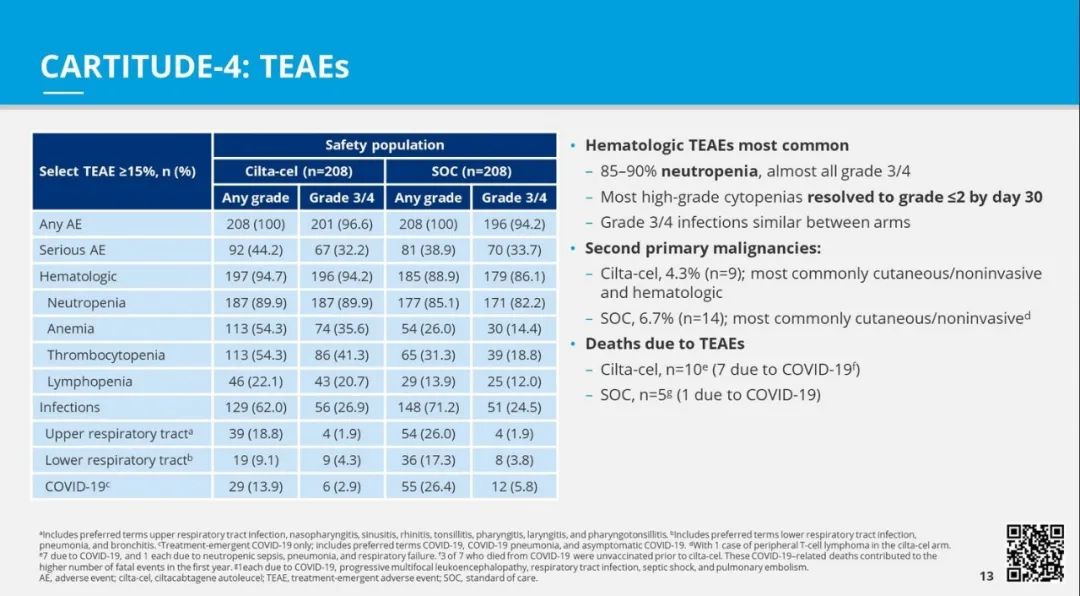
安全性方面,cilta-cel组和标准治疗组的所有患者都出现了不良事件(AEs)。94.7%接受cilta-cel治疗的患者报告了血液学相关的治疗新发AEs。在cilta-cel组中,近90%的患者出现了任何级别的中性粒细胞减少。超过半数接受cilta-cel治疗的患者出现了任何级别的贫血(54.3%)和血小板减少(54.3%),而cilta-cel组中的22.1%患者出现了任何级别的淋巴细胞减少。任何级别的感染在cilta-cel组的患者中报告为62%,其中包括上呼吸道感染(18.8%)、下呼吸道感染(9.1%)和COVID-19(13.9%)。
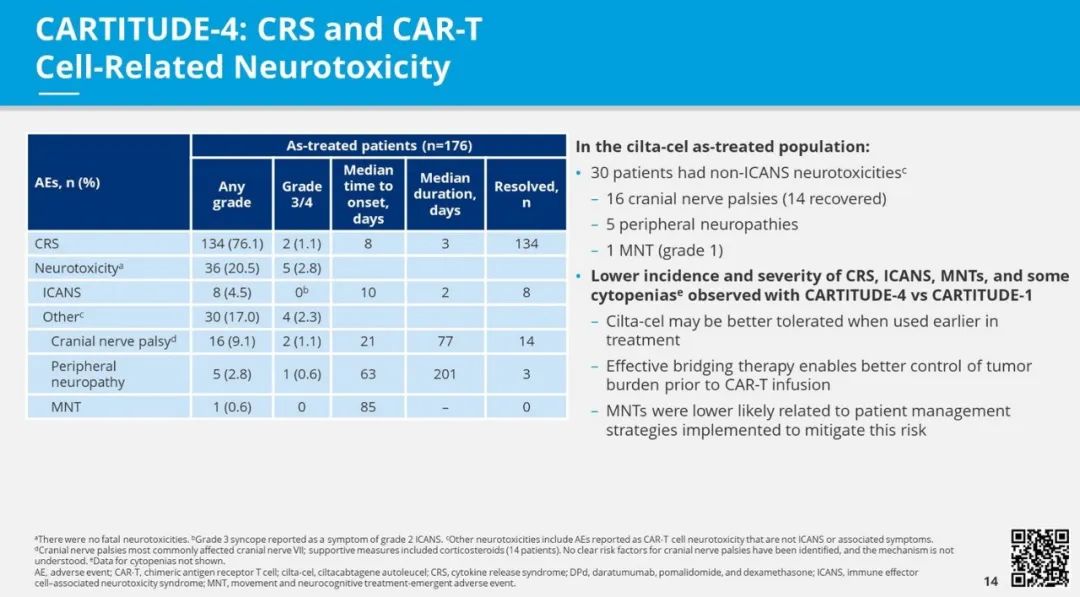
Cilta-cel和标准治疗组接受的患者中,分别有97%和94%报告了3/4级别的不良事件。这些不良事件包括感染(27%对比25%)和细胞减少(94%对比86%)。cilta-cel组有39名患者报告死亡,标准治疗组有46名患者报告死亡。在cilta-cel组中,76%的患者出现细胞因子释放综合征,5%的患者出现免疫效应细胞相关的神经毒性综合征(ICANS)。有一名患者出现了一级运动/神经认知治疗相关的AE。

研究结论:在接受过一到三种先前治疗的来那度胺难治的多发性骨髓瘤患者中,单次cilta-cel输注患者的疾病进展或死亡风险较标准治疗更低。基于CARTITUDE-4的疗效和安全性结果,cilta-cel有望成为在来那度胺难治的多发性骨髓瘤患者第一次复发后的标准治疗。
参考文献:
U.S. Food and Drug Administration. FDA approves ciltacabtagene autoleucel for relapsed or refractory multiple myeloma. Published March 7, 2022. Accessed May 24, 2023.
Chekol Abebe E, Yibeltal Shiferaw M, Tadele Admasu F, Asmamaw Dejenie T. Ciltacabtagene autoleucel: The second anti-BCMA CAR T-cell therapeutic armamentarium of relapsed or refractory multiple myeloma. Front Immunol. 2022;13:991092.
Berdeja JG, Madduri D, Usmani SZ, et al. Ciltacabtagene autoleucel, a B-cell maturation antigen-directed chimeric antigen receptor T-cell therapy in patients with relapsed or refractory multiple myeloma (CARTITUDE-1): a phase 1b/2 open-label study. Lancet. 2021;398(10297):314-324.
Agha ME, Cohen AD, Madduri D, et al. CARTITUDE-2: efficacy and safety of ciltacabtagene autoleucel (cilta-cel), a BCMA-directed CAR T-cell therapy, in patients with progressive multiple myeloma (MM) after one to three prior lines of therapy. J Clin Oncol. 2021;39:15s (suppl; abstr 8013).

 产业资讯
产业资讯
 清科研究
清科研究  2025-08-02
2025-08-02
 33
33

 产业资讯
产业资讯
 空之客
空之客  2025-08-02
2025-08-02
 34
34

 产业资讯
产业资讯
 医药魔方
医药魔方  2025-08-02
2025-08-02
 34
34