 研发追踪
研发追踪
 医药观澜
医药观澜  2023-06-12
2023-06-12
 4274
4274
6月8日消息,Vertex Pharmaceuticals和CRISPR Therapeutics宣布,美国FDA接受exagamglogene autotemcel(exa-cel)治疗严重镰刀型细胞贫血病(SCD)和输血依赖性β地中海贫血(TDT)的生物制品许可申请(BLA),同时授予该产品治疗SCD的优先审评资格。新闻稿表示,这也是FDA受理的首个CRISPR基因编辑疗法上市申请,针对SCD和TDT的PDUFA日期分别为2023年12月8日和2024年3月30日。
Vertex公司首席执行官兼总裁Reshma Kewalramani医学博士表示,非常高兴FDA接受该申请并授予其治疗镰刀型细胞贫血病的优先审评资格。Exa-cel有望成为首个获批的CRISPR基因编辑疗法,他们将继续努力,为正在等待的患者带来具有变革性潜力的治疗方法。
Exa-cel是一款自体细胞疗法,它利用CRISPR/Cas9基因编辑系统,在体外对来自患者的造血干细胞进行编辑,使血红细胞生产高水平的胎儿血红蛋白(HbF)。HbF是携带氧气的血红蛋白的一种形式,在出生时自然存在,随着婴儿的长大,血液中的血红蛋白转换为成人形式的血红蛋白。通过exa-cel治疗,可以提高HbF水平,有可能缓解输血依赖性β地中海贫血患者的输血需求,并减少镰刀型细胞贫血病患者的疼痛和使人衰弱的血管闭塞性危象。此前,exa-cel曾获FDA授予治疗镰刀型细胞贫血病和输血依赖性β地中海贫血的再生医学先进疗法认定、快速通道资格、孤儿药资格和罕见儿科疾病认定,并已在欧洲和英国递交上市申请。
2015年,Vertex公司和CRISPR Therapeutics达成战略研究合作,专注于利用CRISPR/Cas9发现和开发针对人类疾病潜在遗传原因的潜在新治疗方法。Exa-cel代表了联合研究计划中的首个潜在治疗方法。根据修订后的合作协议,Vertex公司正领导exa-cel的全球开发、制造和商业化。
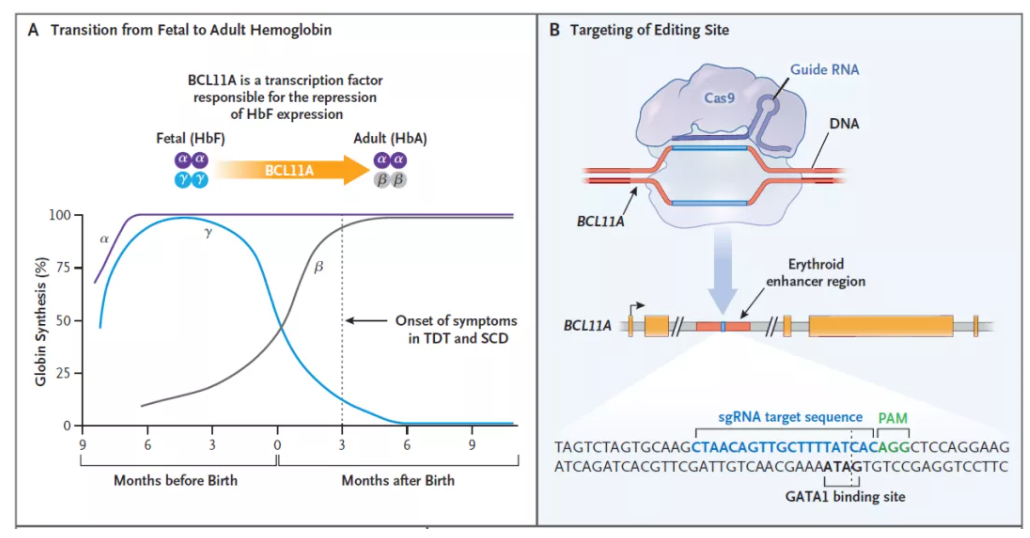
▲Exa-cel的作用机制:A,BCL11A是下调胎儿血红蛋白表达的转录因子;B,exa-cel通过对BCL11A进行基因编辑,上调胎儿血红蛋白的表达(图片来源:参考资料[3])
目前,exa-cel正在进行多项临床试验,包括1/2/3期开放标签试验CLIMB-111和CLIMB-121、长期随访试验CLIMB-131、3期开放标签试验CLIMB-141和CLIMB-151、3b期试验CLIMB-161等。研究人员会从入组试验的患者的外周血中采集造血干/祖细胞,然后利用CRISPR/Cas9技术对这些细胞进行编辑,最后将这些细胞作为自体造血干细胞移植(HSCT)的一部分回输到患者体内。
此前公布的临床试验结果显示,exa-cel具有一次治疗,提供功能性“治愈”的潜力。在接受治疗的44名输血依赖性β地中海贫血患者中,42名在随访时间为1.2~37.2个月时,不再需要接受输血,剩余两名患者接受的输血水平分别降低75%和89%。所有31名接受治疗的严重镰刀型细胞贫血病患者在随访时间为2.0~32.3个月时,均未出现血管闭塞性危象。
公开资料显示,支持exa-cel本次监管提交的关键性试验更新数据将于2023年6月11日在欧洲血液学协会年会上公布。
CRISPR Therapeutics首席执行官Samarth Kulkarni博士表示,他们很高兴看到镰刀型细胞贫血病领域创新疗法未被满足的需求和紧迫性得到了FDA的优先审评认可。这对于CRISPR领域来说是一个激动人心的里程碑,他们期待继续与合作伙伴Vertex公司进行紧密合作,将这一产品带给有需要的患者。
参考资料:
[1]FDA Accepts Biologics License Applications for exagamglogene autotemcel (exa-cel) for Severe Sickle Cell Disease and Transfusion-Dependent Beta Thalassemia . Retrieved Jun 8,2023,from https://crisprtx.com/about-us/press-releases-and-presentations/fda-accepts-biologics-license-applications-for-exagamglogene-autotemcel-exa-cel-for-severe-sickle-cell-disease-and-transfusion-dependent-beta-thalassemia
[2] Vertex and CRISPR Therapeutics Present New Data on More Patients With Longer Follow-Up Treated With exagamglogene autotemcel (exa-cel) at the 2022 European Hematology Association (EHA) Congress. Retrieved June 11, 2022, from https://www.businesswire.com/news/home/20220611005003/en
[3] Frangoul et al., (2020). CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia. NEJM, DOI: 10.1056/NEJMoa2031054.

 研发追踪
研发追踪
 药智网
药智网  2025-10-13
2025-10-13
 821
821

 研发追踪
研发追踪
 药闻天下
药闻天下  2025-10-13
2025-10-13
 747
747

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2025-10-13
2025-10-13
 755
755