 产业资讯
产业资讯
 医麦客
医麦客  2023-06-21
2023-06-21
 2770
2770
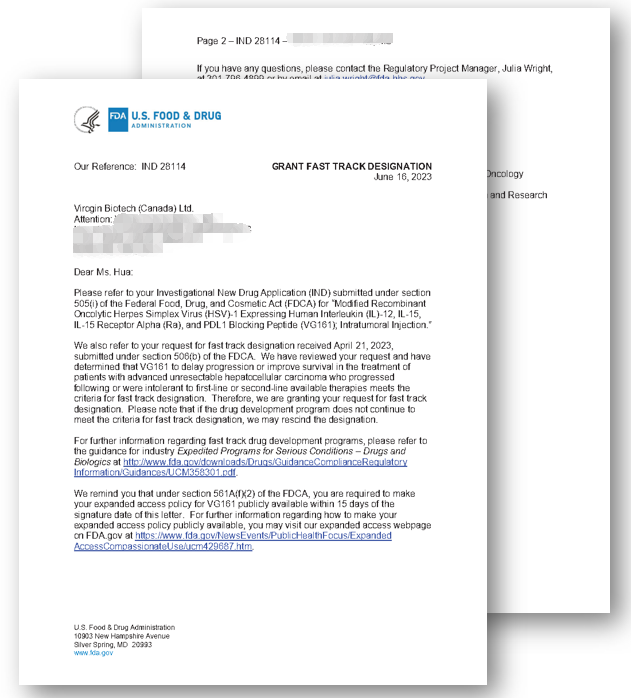
●复诺健生物宣布收到FDA治疗药品办公室(Office of Therapeutic Products)的正式书面回函,其原创开发的溶瘤病毒产品I类创新药VG161被授予FDA快速通道资格(Fast Track Designation, FTD), 用于治疗经标准治疗失败的晚期肝细胞癌(advanced unresectable hepatocellular carcinoma)。
FDA回函中表示“(对于)经过目前可用的一线或二线治疗后进展或不耐受的不可手术切除的晚期肝细胞癌患者,(VG161)能够延缓肿瘤进展或改善生存期,达到FDA审评标准”,这无疑是对VG161临床药效的认可。
“···We have reviewed your request and have determined that VG161 to delay progression or improve survival in the treatment of patients with advanced unresectable hepatocellular carcinoma who progressed following or were intolerant to first-line or second-line available therapies meets the criteria for fast track designation.Therefore, we are granting your request for fast track designation.···”
●原发性肝癌,其中大多数是肝细胞癌(hepatocellular carcinoma, HCC) ,在全球最常见的恶性肿瘤中排名第六位(我国排名第四位),全球癌症相关死亡的主要原因中排名第二。
快速通道资格
此次FDA给予VG161快速通道资格的决定,充分表明其认可VG161具有解决未满足的临床需求的潜力。VG161有望成为晚期肝细胞癌患者的更好治疗选择。
本次取得FTD主要基于正在中国和美国两地进行的临床研究(NCT04806464和NCT05223816) 。特别鸣谢中国地区临床研究主要研究者(leading PI)浙江大学医学院附属第一医院梁廷波教授团队领导和实施了该临床研究,期待产品尽快上市,造福更多患者。
VG161作为复诺健Synerlytic™技术平台的首个产品,已成功完成了I期临床试验,并正在中美两地进行多个临床II期试验(单药与联合用药),鉴于产品展现出的优越安全性和令人振奋的初步有效性结果,于2023年2月获得FDA孤儿药资格认定,现又取得快速通道认定,进一步展现出VG161作为溶瘤病毒疗法的巨大潜力。
FTD的取得,使复诺健将在后续的药物研发与审评过程中,获得更多与FDA沟通交流的机会。此外,还可以在提交上市申请(NDA/BLA)时向FDA滚动递交(rolling submission)新药研究资料。这些政策都有助于加快VG161后续研发和批准上市。
随着全球临床策略的持续稳步推进,复诺健卓越的创新研发能力和溶瘤病毒产品的治疗潜力,已经在强大的临床转化和临床研发能力的支持下逐步展现。复诺健将进一步秉持“以癌症病人的需求为导向”的理念,全力在溶瘤病毒和mRNA癌症治疗方案领域砥砺前行,开发并提供新一代抗肿瘤免疫治疗方案。

 产业资讯
产业资讯
 医麦客
医麦客  2025-06-24
2025-06-24
 28
28

 产业资讯
产业资讯
 医药财经
医药财经  2025-06-24
2025-06-24
 30
30

 产业资讯
产业资讯
 药时代
药时代  2025-06-24
2025-06-24
 32
32