 产业资讯
产业资讯
 猎药人俱乐部
猎药人俱乐部  2023-06-27
2023-06-27
 5895
5895
GLP-1非常火爆,市场无比激动。
从GLP-1被首次分离,到首款产品上市,再到口服治疗时代的开启,历经了半个世纪。将多肽药物开发成口服形式已经实属不易,科学家不断探索,下一个冲击目标是GLP-1小分子,礼来、辉瑞等药企正在厮杀。
这是GLP-1战争的最高峰。
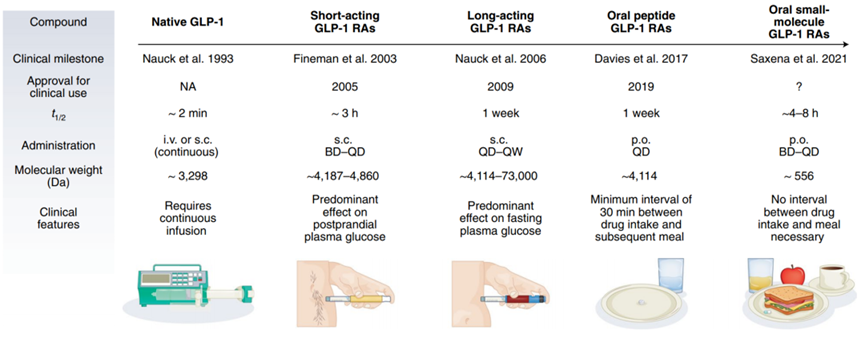
小分子 VS. 多肽
GLP-1是一种内源性活性多肽类激素,通过激活GLP-1受体可以刺激胰岛素释放并以葡萄糖依赖性方式控制胰高血糖素的分泌,从而促进葡萄糖的代谢。同时,该靶点能够延缓胃排空,通过中枢性的食欲抑制来减少进食量,从而达到降低血糖的作用。临床上,GLP-1受体激动剂不仅降糖效果明显,同时在减重、降压、改善血脂等方面也显示出益处。
尽管这个靶点优秀无比,但是GLP-1有一个致命的弱点:不稳定,易降解。GLP-1在体内的半衰期不到2分钟,极易被DPP-4(二肽基肽酶-4)降解。稳定性差这个致命的弱点给药物开发带来挑战。这也几乎是所有多肽药物开发过程中面临的问题。
于是,各大药企在药物设计策略上通过不同的化学修饰对GLP-1进行结构修饰,从而达到持续激活GLP-1受体的作用。例如,脂肪酸酰化、手性翻转、氨基酸替换等修饰方式的运用,来延长半衰期,优化药代动力学特性。
例如,度拉糖肽的诞生则是礼来运用了Fc融合蛋白这一技术,实现每周一次注射,半衰期延长为5天。
虽然注射剂很大程度上解决了稳定性差的问题,但是相比注射剂,小分子口服制剂在生物利用度上拥有非常大的优势。目前上市的GLP-1口服药物只有司美格鲁肽口服剂Rybelsus,虽然该药物使用了特殊的制剂SNAC来增加胃上皮吸收,以提高生物利用度,但是生物利用度也只有1%左右,用药剂量远超皮下注射剂。
小分子药口服生物利用度高是其得天独厚的优势所在。
另外,司美格鲁肽口服制剂是以多肽原料为主,考虑到多肽化学合成工艺的复杂性,该产品的成本注定不会便宜,与生物制剂相比,口服产品所需的原料药量要大得多。同时,司美格鲁肽片的吸收会受到食物的干扰,服用过程也有特殊限制。
在今年5月份,FDA已经将诺和诺德旗下的司美格鲁肽注射液(包括Ozempic注射液和Wegovy注射液)列入美国FDA药物短缺名单。早在今年3月份,欧洲药品管理局也发布消息称糖尿病药物司美格鲁肽(Ozempic)将面临较长时间的短缺,预计这种短缺将持续整个2023年。
司美格鲁肽的产能一直困扰着诺和诺德,面对严重的药物短缺问题,诺和诺德只能在多地增加投资扩建或者新建工厂,以提升原料药的产能以及组装和包装的能力。不过,由于 GLP-1 受体激动剂属于多肽类型,工艺要求较高,因此司美格鲁肽全球供应紧张的问题并未解决。
而小分子药物没有这些忧愁,小分子药物的生产成本远低于生物技术品,而且小分子的生产工艺相对简单且成熟。
此外,小分子药物对储存环境的敏感性相对较低,储存运输方便。

猎药人俱乐部团队整理
现有的GLP-1受体激动剂均为大分子多肽药物,存在依从性产能低、治疗成本高等限制,小分子药物固有的优势如易于生产、价格低廉等优势,无疑能够弥补肽类药物的缺点。近年来,小分子GLP-1受体激动剂的研究已成为行业热点,诸如礼来、辉瑞、vTv Therapeutics等企业正在竞相展开小分子GLP-1药物的开发。
小分子GLP-1受体激动剂研究现状
目前全球口服类GLP-1制剂仅司美格鲁肽片获批上市,且暂无已上市的小分子GLP-1受体激动剂。
截止2023年6月,据不完全统计,全球在研小分子GLP-1受体激动剂共有38款,其中,礼来的Orforglipron处于第一梯队,也是唯一处于临床3期的小分子GLP-1受体激动剂,一骑绝尘;24款GLP-1小分子处于临床前研究阶段。
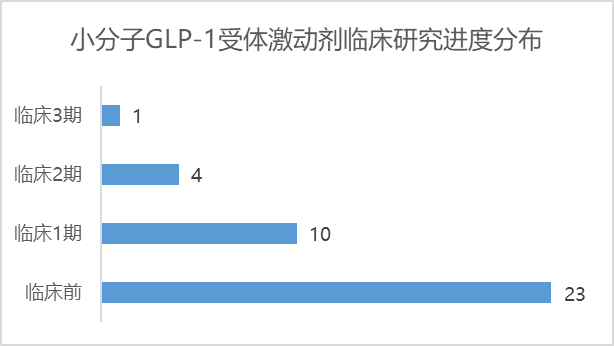
猎药人俱乐部团队绘制
GLP-1小分子制剂在糖尿病领域布局最多,其次是肥胖,也在向非酒精性脂肪肝领域冲击,另外,还有阿尔兹海默症和心血管领域的布局。这个趋势跟GLP-1肽类药物相似。
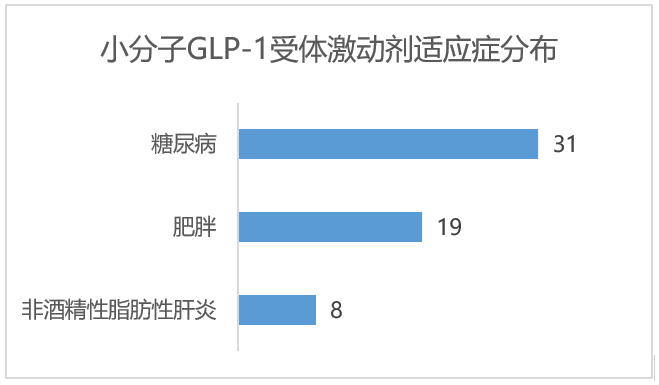
猎药人俱乐部团队绘制
各大企业在角逐小分子GLP-1受体激动剂,礼来、辉瑞、Viking Therapeutics等企业纷纷加入,期盼分羹一份。
辉瑞的Danuglipron是继礼来的Orforglipron之后,另一款相当有潜力的小分子GLP-1受体激动剂,倍受业内人士关注。目前辉瑞公布了该药物治疗糖尿病的2b期临床数据。
辉瑞还有一款小分子GLP-1制剂PF-07081532,目前处于临床2期研究阶段,拟用于治疗肥胖和II型糖尿病。
Viking Therapeutics的VK-2735用于治疗减重和NASH,3月28日公布了1期临床结果,同时其口服配方的临床1期研究开启。
Carmot Therapeutics的口服小分子GLP-1受体激动剂CT-996目前处于临床1期研究阶段,适应症为肥胖和II型糖尿病。近期,Carmot公司完成了1.5亿美元的超额认购和规模更大的E轮融资,用于代谢疾病(包括肥胖和糖尿病)的GLP-1类新药研发。
相较国外的生物公司,国内企业也在积极布局小分子GLP-1受体激动剂。锐格医药的RGT-075目前是国内最领先的GLP-1小分子制剂,处于临床2期阶段,拟用于治疗II型糖尿病。恒瑞医药的SHR-7535处于临床1期阶段,拟用于治疗肥胖和II型糖尿病。诚益生物的ECC-5004、翰森制药的HS-20094及华东医药的HDM-1002也处于临床1期。
全球在研小分子GLP-1受体激动剂

截止2023年6月,猎药人俱乐部团队整理
代表性药物
名称:Orforglipron
公司:礼来
临床进度:3期
适应症:II型糖尿病;肥胖;心血管风险
Orforglipron(LY3502970)是Chugai 公司开发的一种可口服的非肽类GLP-1受体激动剂。2018年9月,礼来与Chugai 公司达成许可协议,以5000万美元首付款获得该产品的全球开发权和商业化权。目前该药物已经进入临床3期,无疑在小分子GLP-1R赛道一骑绝尘。
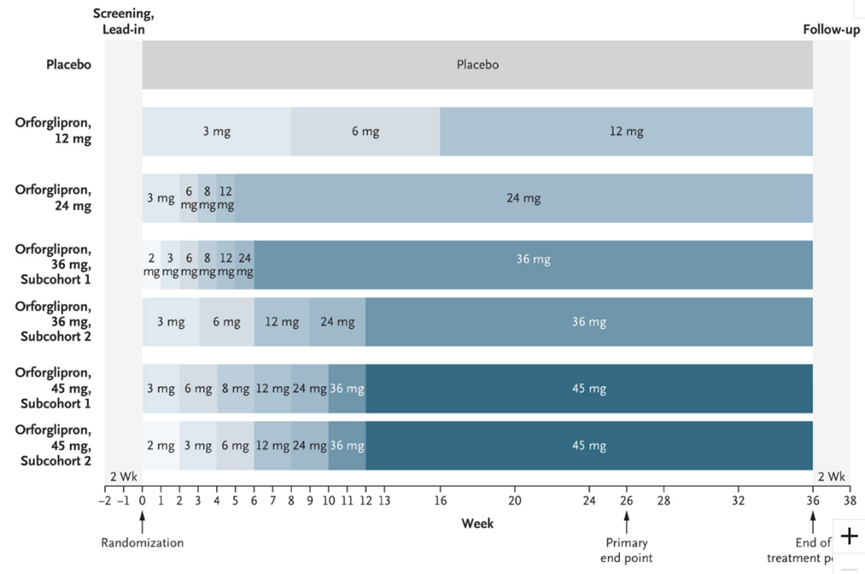
Orforglipron用药频次是每日一次,无需饮食限制。
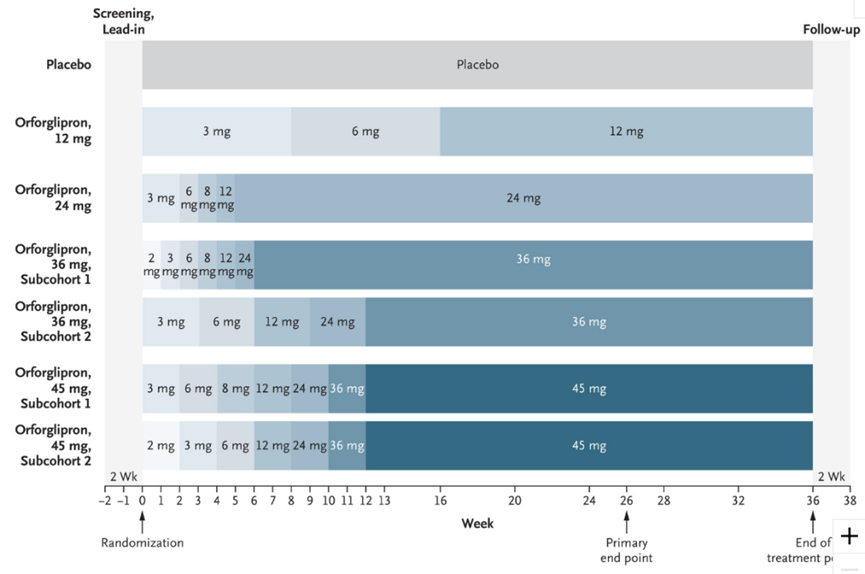
礼来启动了Orforglipron的临床3期系列研究,以进一步研究该药物在肥胖/超重(ATTAIN试验)和II型糖尿病(ACHIEVE试验)的疗效。5月24日,礼来启动了该药物的3期临床试验(ATTAIN-2),旨在评估每日1次口服Orforglipron用于治疗伴有II型糖尿病的肥胖或超重成人患者的疗效与安全性。该产品已于今年3月在中国申报临床,这是该产品首次在国内申报临床。
6月23日,礼来在美国糖尿病协会第83届年会科学会议上公布了该药物治疗肥胖和糖尿病的2期临床数据(NCT05051579:肥胖;NCT05048719:糖尿病)。Orforglipron达到了主要和次要治疗终点,并在至少有一种体重相关合并症(不包括2型糖尿病)的肥胖或者超重成年患者中显示出显著的体重减轻。
该2期临床研究数据显示,第26周的主要终点评估中,Orforglipron组(12mg, 24mg, 36mg,45mg)在所有剂量下均显示出具有统计学意义的剂量依赖性体重减轻,减重范围为8.6%(9.0kg)至12.6%(13.3kg),而安慰剂组为2.0%(2.1kg)。
在治疗36周时,Orforglipron所有4个评估剂量均达到了所有关键的次要终点,45mg剂量组减重14.7%,相比于安慰剂组减重12.2%。
体重减轻≥5%:72%(12mg)、90%(24mg)、92%)(36mg)和90%(45mg),而安慰剂组为24%;
体重减轻≥10%:47%(12mg),62%(24mg),75%(36mg)和69%(45mg),而安慰剂组为9%;
BMI较基线降低:安慰剂组0.9 kg/m2,Orforglipron的4个剂量组分别为3.4 kg/m2(12mg)、4.7 kg/m2(24mg)、5.0 kg/m2(36mg)和5.5 kg/m2(45mg);
腰围较基线减少:9.6cm(12mg),11.2cm(24mg),10.6cm(36mg),13.6cm(45mg)而安慰剂组为4cm。
另一项糖尿病2期研究结果显示,该研究达到了主要和次要终点,Orforglipron在26周时Hb1Ac降低2.1%,而安慰剂和度拉糖肽组分别为0.4%和1.1%。Orforglipron(3 mg,12 mg,24 mg,36 mg或45 mg)在患有II型糖尿病的成年人中减重10.1 kg,而安慰剂组为2.2 kg,度拉糖肽组为3.9 kg。
名称:Danuglipron
公司:辉瑞
临床进度:2期
适应症:非酒精性脂肪性肝炎;II型糖尿病;肥胖
Danuglipron(PF-06882961)是辉瑞开发一款口服小分子GLP-1受体激动剂,具有多种潜在优点,包括能够实现血糖和体重的有效控制、耐受性良好、口服剂型方便使用、生物利用度高等。
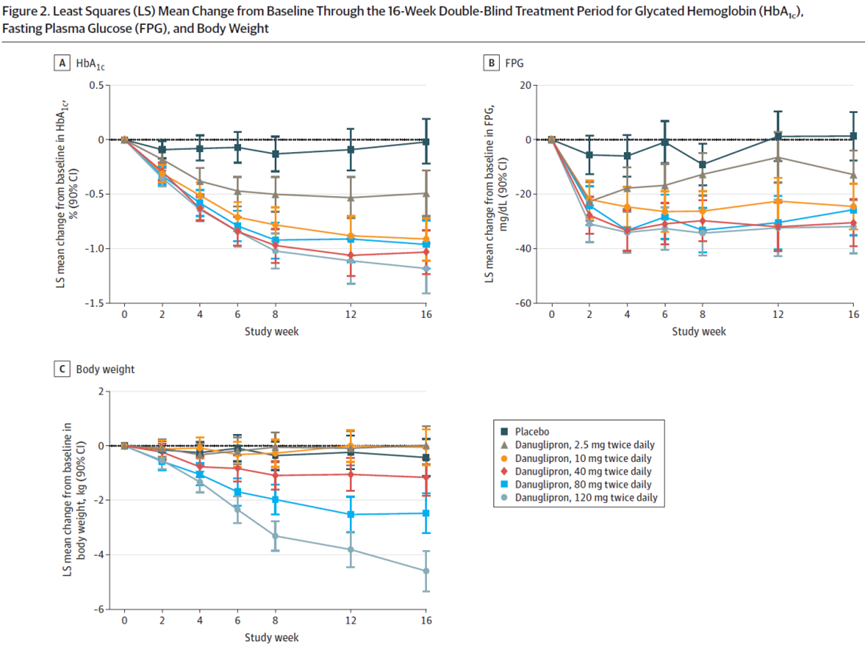
2023年5月22日,辉瑞口服GLP-1小分子激动剂Danuglipron治疗糖尿病2b期临床数据发表在JAMA期刊上。
在这项针对411例II型糖尿病患者的临床研究中,有5个剂量组2.5mg、10mg、40mg、80mg、120mg,给药频次每天两次。在治疗16周时,相对于安慰剂组,80mg、120mg剂量组的Hb1Ac分别下降0.94%、1.16%,体重分别降低2.04kg和4.17kg。
最常报告的不良事件是恶心、腹泻和呕吐。

在中国,2023年3月17日,辉瑞PF-06882961片的临床试验申请获药监局默认许可,拟开展治疗II型糖尿病的临床研究。
名称:PF-07081532
公司:辉瑞
临床进度:2期
适应症:II型糖尿病;肥胖
由于 Danuglipron 需要每天两次口服给药,由此辉瑞也在加速推进其迭代产品只需每日一次口服给药的 PF-07081532 的开发进度。目前该药物处于治疗治疗糖尿病和肥胖的临床2期研究。
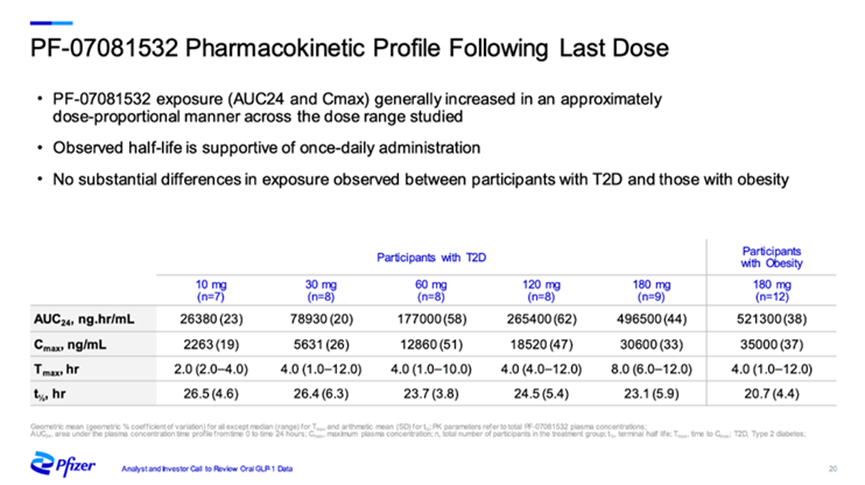
PF-07081532是一种每日一次的下一代口服小分子GLP-1受体激动剂,正在开发用于治疗2型糖尿病和肥胖症。PF-07081532是辉瑞的科学家在一项多靶点研究合作中发现的,在该合作中辉瑞获得了Sosei Heptares专有的StaR®(稳定受体)技术。
PF-07081532在 2 型糖尿病和肥胖症患者中进行的 1b 期临床结果显示,PF-07081532 半衰期超过 20 小时,支持每日一次口服给药。且在疗效方面,在治疗 6 周后,接受每日一次PF-07081532 治疗的 2 型糖尿病的 FPG 水平显著降低,已接近正常水平阈值。
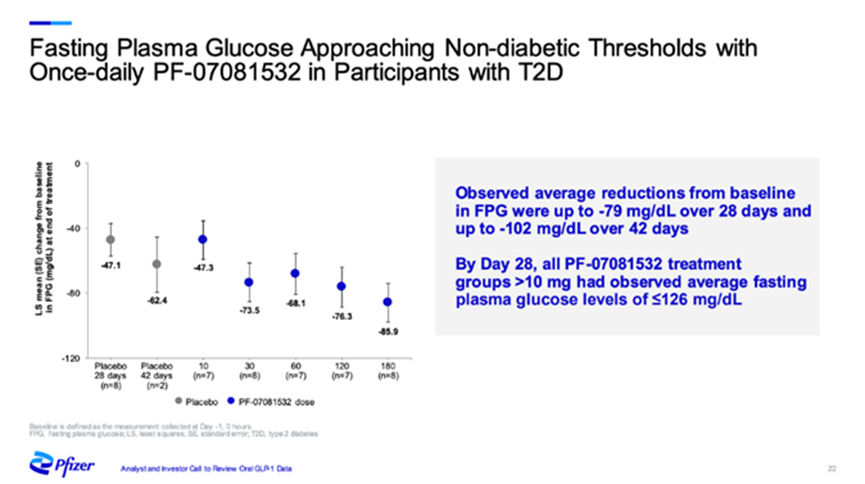
同时,在II型糖尿病和肥胖症患者中,PF-07081532剂量依赖性降低患者的体重。接受最高剂量治疗的患者在接受治疗4-6周后体重平均比基线降低约10斤。
名称:GSBR-1290
公司:硕迪生物
临床进度:1期
适应症:II型糖尿病;肥胖
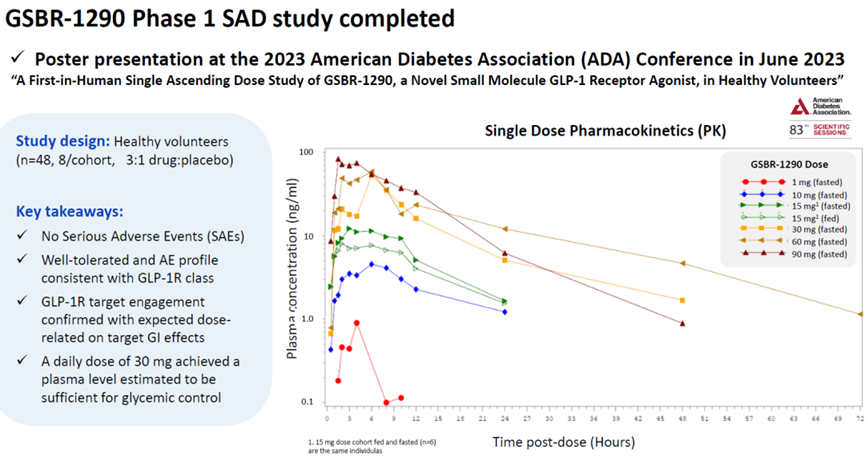
GSBR-1290是硕迪生物研发的一款口服小分子GLP-1受体激动剂,正在开发用于治疗II型糖尿病和肥胖患者。2022年9月,GSBR-1290完成了1期单次递增剂量研究,产品耐受性良好,且表现出剂量依赖性药代动力学和药理学活性。
2023年5月,硕迪生物称已完成GSBR-1290针对超重或肥胖及II型糖尿病2a期研究的首位患者给药。公司还启动了一项GSBR-1290针对日本个体的民族桥接研究,并计划在2023年底前启动另外的一项片剂桥接研究,为2024年全球2b期研究做准备。
2023年6月25日,在美国第83届美国糖尿病协会(ADA)科学年会上,硕迪生物公布了口服小分子GLP-1R激动剂GSBR-1290的最新临床数据。

Poster标题
GSBR-1290单次给药的PK数据如下。
名称:HRS-7535
公司:恒瑞医药
临床进度:1期
适应症:II型糖尿病
HRS-7535是恒瑞医药自主研发一种新型口服小分子GLP-1RA,临床拟用于治疗II型糖尿病。临床前研究发现,在无严格限食的情况下,HRS-7535可明显改善葡萄糖耐量,促进胰岛素分泌,减少摄食量。
在美国第83届美国糖尿病协会(ADA)科学年会上,恒瑞公布了HRS-7535的1期临床(NCT05347758)的最新数据。结果显示,SAD和MAD各24例。在MAD中,第28天时HRS-7535给药范围内的中位达峰时间(Tmax)为5.98~10.98h,几何平均末端清除半衰期(t1/2)为6.48~8.42h。MAD治疗29天体重下降4.38kg。在SAD中,HRS-7535给药范围内的中位达峰时间(Tmax)为5.98~5.99h,末端清除半衰期(t1/2)为5.28~9.08h。
名称:HDM1002
公司:华东医药
临床进度:1期
适应症:II型糖尿病;肥胖
HDM1002片是由中美华东自主研发的创新型小分子药物,是具有口服活性、强效、高选择性的GLP-1受体小分子完全激动剂。
临床前研究显示,HDM1002可强效激活GLP-1受体,诱导环磷酸腺苷(cAMP)产生,具有强效的改善糖耐受、降糖和减重作用并且显示出良好的安全性。
2023年4月中美华东完成向美国FDA递交HDM1002片的临床试验申请,并于5月12日获得FDA批准,同意本品开展1期临床试验。该产品在中国IND申请已于2023年2月递交。
小结
接受治疗68周后,司美格鲁肽50mg片剂患者减重17.4%。礼来口服减肥药物Orforglipron最高剂量(45mg)在用药36周后,平均减重14.7%。这一结果给了小分子GLP-1受体激动剂一定的激励。
小分子GLP-1欲要撼动多肽类GLP-1受体激动剂的地位,除了小分析药物固有的优势之外,还需要通过更多的临床数据来说话,尤其在减重层面。
无论如何,小分子GLP-1制剂是GLP-1受体激动剂领域的一个有益补充,我们期待未来更多的产品进入市场,供患者选择。
参考资料
(1) 各公司官网和官媒
(2) CDE、FDA
(3) 《礼来制药:GLP-1口服小分子治疗36周减重14.7%》,医药笔记
(4) 《寻找口服GLP-1终极答案:小分子与多肽的模态较量》,氨基观察
(5) 《2023ADA︱恒瑞医药两款降糖创新药最新研究成果齐亮相》

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 418
418

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 425
425

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 407
407