 产业资讯
产业资讯
 生物药大时代
生物药大时代  2023-07-11
2023-07-11
 2101
2101
FDA手握“生杀大权”,不仅影响着大药企,还决定着众多Biotech的生死,也牵动着国内药企们的心。据不完全统计,今年上半年已经有12款药物被拒,看看原因何在?或许能为业内理解FDA的审评标准提供帮助。
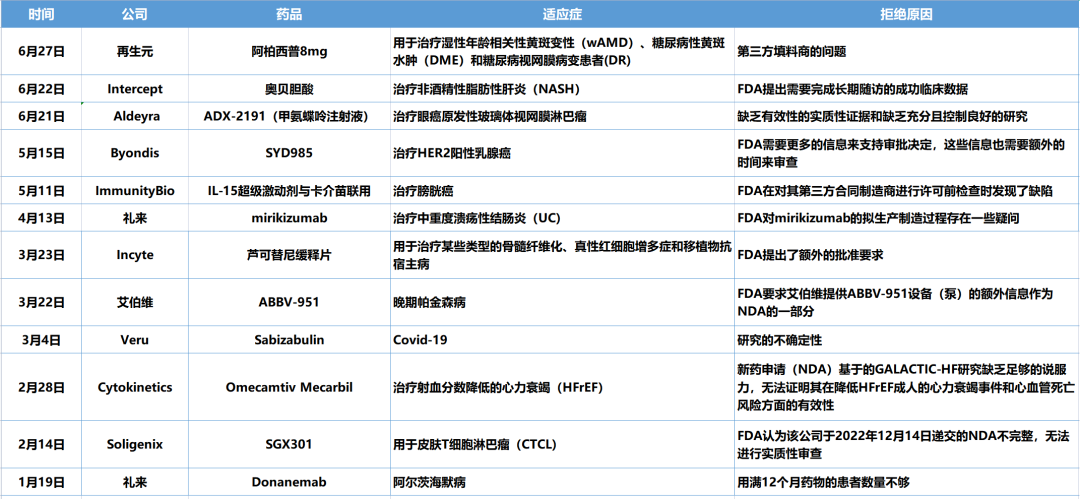
生物药大时代整理
1 再生元
6月27日,再生元(纳斯达克:REGN)宣布,已收到FDA就阿柏西普8mg制剂的上市申请发出的完整回复函(CRL)。公司表示,FDA此次拒绝批准是因为在第三方药物灌装机中发现了生产问题。与疗效、安全性、说明书和原料药生产等方面无关,也未要求提供额外的临床数据或额外开展试验。阿柏西普药物用于治疗湿性年龄相关性黄斑变性(wAMD)、糖尿病性黄斑水肿(DME)和糖尿病性视网膜病变(DR) 。再生元表示,将与FDA和第三方供应商密切合作,尽快将阿柏西普8 mg制剂带给wAMD、DME和DR患者。公司管线布局

2 INTERCEPT
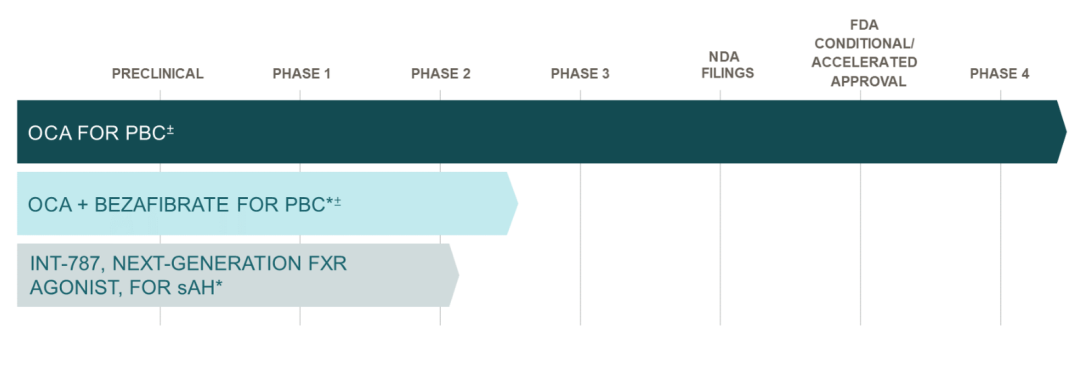
6月22日下午,Intercept宣布,FDA已经对该公司用于治疗非酒精性脂肪性肝炎(NASH)引起的肝硬化前纤维化的奥贝胆酸(OCA)新药申请发出了完全回应函(CRL)。FDA在CRL中表示,经审查确定,奥贝胆酸不能以目前的形式获得批准。根据CRL的内容,在NASH中重新提交OCA的NDA至少需要成功完成REGENERATE研究的长期结果阶段。这次受挫后,Intercept决定停止所有与NASH相关的投资,重组公司业务以加强其对罕见和严重肝脏疾病的关注,并从2024年开始加速实现盈利。公司研发管线
3 Aldeyra
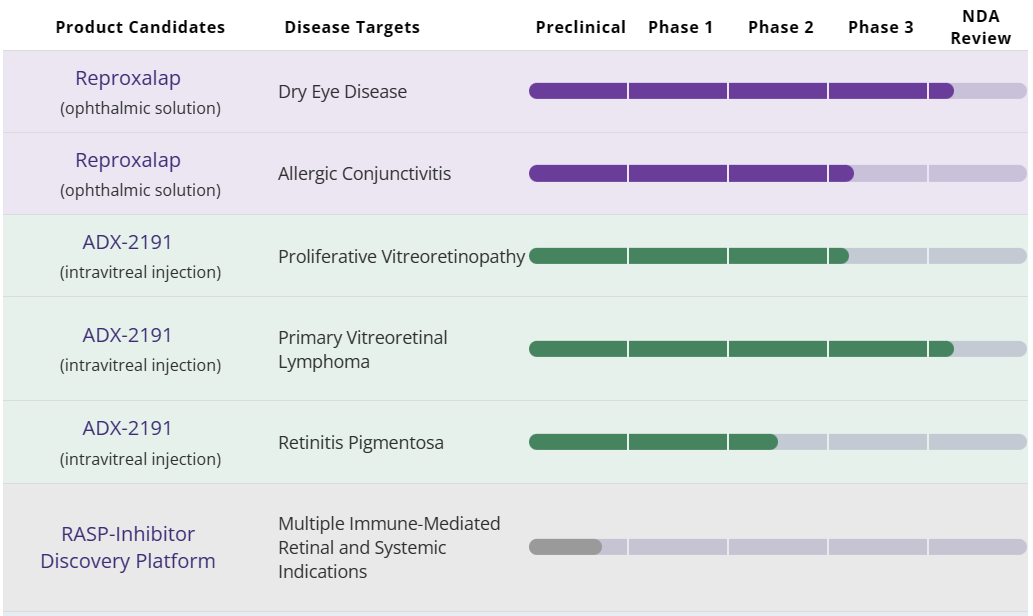
6月21日,生物技术公司Aldeyra Therapeutics, Inc.宣布收到FDA对候选药物ADX-2191治疗原发性玻璃体视网膜淋巴瘤新药申请(NDA)的完全回应函。
虽然没有发现ADX-2191的安全或生产问题,但FDA表示,由于基于文献的NDA提交中 "缺乏充分和良好的对照调查",因此 "缺乏实质性的有效性证据"。
近日,公司宣布ADX-2191治疗视网膜色素变性患者的2期临床试验积极顶线结果。相对于基线,临床试验证明了在许多不同的生理和心理物理评估中视网膜功能的统计学显著改善。
公司研发管线

4 Byondis
5月15日,Byondis公司宣布收到FDA的完整回复函(CRL)。FDA在CRL中表示,暂停对靶向HER2的ADC药物SYD985生物制品许可申请(BLA)的批准,需要更多的信息来支持审批决定。
公司研发管线
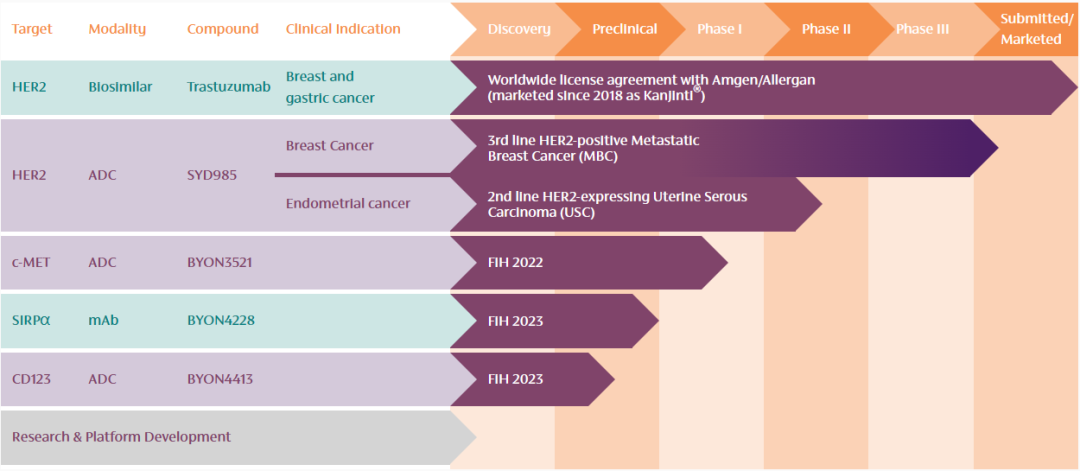
在SYD985之前,治疗乳腺癌的HER2 ADC已有两类产品:Enhertu和Kadcyla。FDA此次对Byondis的批准按下暂停键,或许是对靶向HER2 ADC提出了更高的期待。
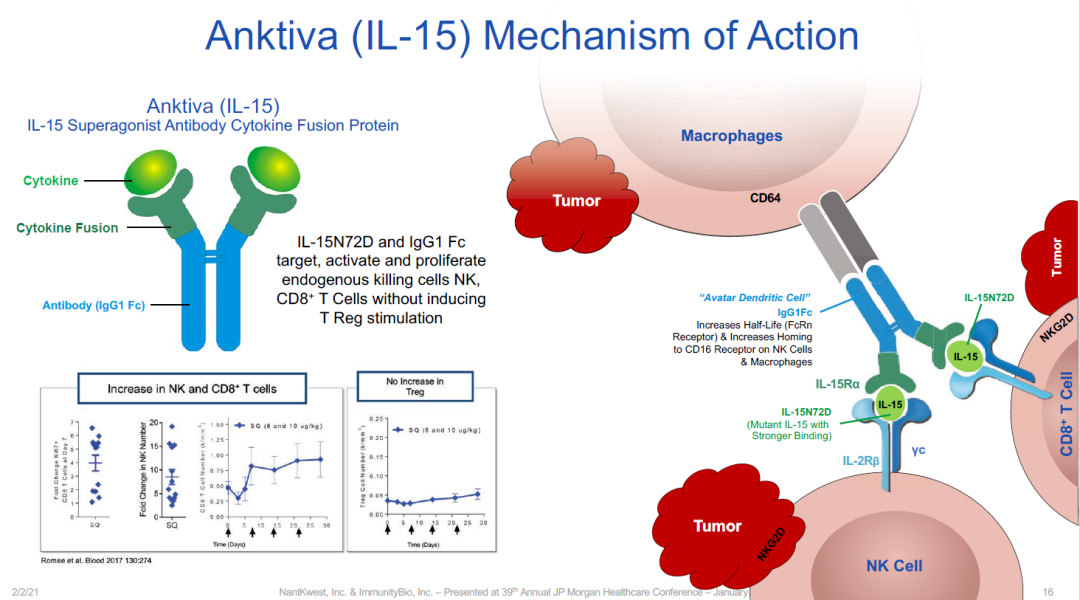
5 ImmunityBio
5月11日,ImmunityBio表示,该公司IL-15超级激动剂Anktiva(N-803)与卡介苗联合治疗膀胱癌的上市申请被美国FDA拒绝批准。此次拒批主要是由于FDA在对其第三方合同制造商进行许可前检查时发现了缺陷。
FDA还就如何解决问题给出了建议,指出了ImmunityBio必须解决的制造问题,还要求其在重新提交的文件中更新Anktiva组合的某些安全性和有效性数据。
Anktiva作用机制
6 礼来
4月13日,礼来宣布,收到美国FDA针对公司提交的mirikizumab治疗溃疡性结肠炎(UC)的生物许可证申请(BLA)发出完整的回复函,回复函中,FDA列举了mirikizumab生产相关问题,对该药物的临床数据、安全性或药品说明书未提出问题。
礼来表示,他们正在与FDA积极沟通合作,希望尽快在美国市场推出mirikizumab药物。但礼来没有给出解决制造问题可能需要多长时间的答案。
最近,礼来在日本获得mirikizumab作为一线药物治疗UC的批准。欧洲药品管理局人类用药产品委员会(CHMP)对mirikizumab用于治疗对常规治疗或生物治疗反应不足、失去反应或不耐受的中重度活动性UC成年人发表了积极意见。
结语
美国一直是创新药的超级市场,被FDA批准上市往往相当于拿到了全球通行证。但近年来FDA在创新药的上市审批上日渐趋严,以高标准、高要求将多款创新药被拒之门外。上市申请被拒除了影响产品的商业化进程外,对于严重依赖于某一单品的小型制药公司更可能是致命的,很多公司在公布CRL消息后都遭遇了重大的股市打击。
参考资料:各公司官网

 产业资讯
产业资讯
 新湾novaBAY
新湾novaBAY  2025-06-30
2025-06-30
 10
10

 产业资讯
产业资讯
 MedTrend医趋势
MedTrend医趋势  2025-06-30
2025-06-30
 9
9
 产业资讯
产业资讯
 Medaverse
Medaverse  2025-06-30
2025-06-30
 7
7