 产业资讯
产业资讯
 医药观澜
医药观澜  2023-07-20
2023-07-20
 3098
3098
7月20日,中国国家药品监督管理局药品审评中心(CDE)官网最新公示,Scynexis公司和翰森制药联合申报了枸橼酸艾瑞芬净片的新药上市申请,并获得受理。公开资料显示,艾瑞芬净(ibrexafungerp,HS-10366)是一种新型的口服抗真菌药物,此前已获美国FDA批准。翰森制药负责该产品在中国的开发、监管批准和商业化。
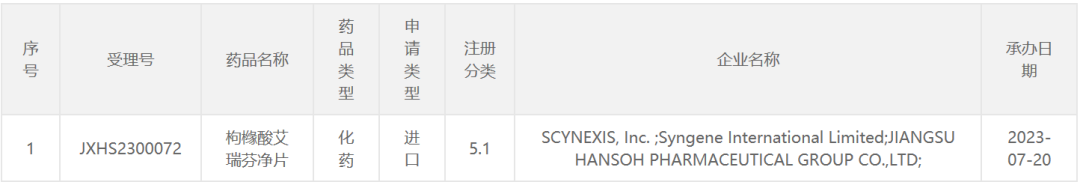
截图来源:CDE官网
根据翰森制药早前公告介绍,艾瑞芬净是一款全新三贴类结构的糖原合成酶抑制剂,是一种全新作用机制的抗真菌类药物。该药物已被验证可以高效抑制糖原合成酶活性,并具有口服和注射两种剂型方便使用,有望在住院和门诊环境中得到广泛使用。目前,该药正开发用于治疗主要由念珠菌和曲霉菌引起的真菌感染。在体外和体内研究中,它表现出了广谱的抗真菌活性。2021年2月,翰森制药与Scynexis公司签订授权协议,翰森制药将负责艾瑞芬净在中国的开发、监管批准和商业化。
2021年6月,艾瑞芬净首次获得FDA批准,用于治疗外阴阴道念珠菌病(VVC,也称为阴道酵母菌感染)。该批准基于两项3期临床研究的积极结果,试验表明,每日口服一次该药在VVC患者中表现出显著的疗效和良好的耐受性。治疗10天后,63.3%患者达到了“临床治愈”的主要终点,58.5%的患者达到了真菌学根除的次要终点,72.3%的患者获得了临床改善。
2022年12月,艾瑞芬净获得FDA批准第2个适应症,用于降低复发性外阴阴道念珠菌病(RVVC)的发病率。该批准基于关键性3期临床试验CANDLE的积极结果,数据显示,艾瑞芬净在主要终点和关键次要终点方面均显著优于安慰剂,65.4%接受该产品治疗的RVVC患者在24周内完全没有复发(vs 慰剂组53.1%),该药还表现出良好的安全性和耐受性。
根据中国药物临床试验登记与信息公示平台,此前艾瑞芬净已完成一项在中国成年外阴阴道念珠菌病患者中开展的多中心3期临床试验,目前还在开展一项针对念珠菌血症和/或侵袭性念珠菌病患者的3期临床试验。
参考文献:
[1]中国国家药监局药品审评中心(CDE)官网.Retrieved Jul 20,2023, From https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731
[2]SCYNEXIS Announces FDA Approval of BREXAFEMME® (ibrexafungerp tablets) as the First and Only Oral Non-Azole Treatment for Vaginal Yeast Infections. Retrieved June 2, 2021, from https://www.globenewswire.com/news-release/2021/06/02/2240294/0/en/SCYNEXIS-Announces-FDA-Approval-of-BREXAFEMME-ibrexafungerp-tablets-as-the-First-and-Only-Oral-Non-Azole-Treatment-for-Vaginal-Yeast-Infections.html
[3]SCYNEXIS Announces FDA Approval of Second Indication for BREXAFEMME® (ibrexafungerp tablets) for Reduction in Incidence of Recurrent Vulvovaginal Candidiasis. Retrieved Dec 01 , 2022. From https://ir.scynexis.com/news-events/press-releases/detail/314/scynexis-announces-fda-approval-of-second-indication-for
[4]「IBREXAFUNGERP片」獲臨床試驗批准通知書. Retrieved Dec 15,2021, from https://www1.hkexnews.hk/listedco/listconews/sehk/2021/1215/2021121501496_c.pdf

 产业资讯
产业资讯
 医药财经
医药财经  2025-06-25
2025-06-25
 36
36

 产业资讯
产业资讯
 医药魔方
医药魔方  2025-06-25
2025-06-25
 34
34

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-06-25
2025-06-25
 35
35